热重分析解题模型构建
2020-01-15翁华怡
翁华怡

[摘 要]热重分析题常出现在高考化学试题中,其解题思路依托于学生的知识迁移和方法积累,综合性高。学生在解答过程中常出现畏难情绪。通过对热重曲线类型和物质受热失重方式的探究,帮助学生构建m-T热重曲线和ω-T热重曲线解题模型,在问题情境中提升学生的方法技能、思维品质和科学素养。
[关键词]热重分析;模型构建;科学素养
[中图分类号] G633.8 [文献标识码] A [文章编号] 1674-6058(2020)29-0064-03
热重分析法是在一定条件下测量物质的质量随温度(或时间)变化的一种热分析方法,它是大学的知识,中学课本上没有热重分析法相关实验及仪器的介绍,但是解决热重分析题的方法却源于中学课本。热重分析题立足于学生的认知水平和知识技能,要求学生能够读取图像数据,并基于数据利用守恒思想分析化学变化,再通过定量计算进行推理,揭示反应过程,深受出题者的青睐。在2008-2019年江苏高考中出现过三次此类题型,分别是2010年、2014年的第18题和2019年的第20题。此类试题综合能力要求高,学生往往会有畏惧心理。因此,笔者认为有必要通过高考真题的探究,初步构建热重分析的一般解题模型,提升学生处理图像信息的能力和思维品质,培养学生的科学素养。
一、热重曲线类型
热重分析题通常会提供以质量(或质量比、质量百分率)为纵坐标,以温度为横坐标的热重曲线。根据图像纵坐标的差异,可将其分成m-T热重曲线和ω-T热重曲线两种类型。
二、失重方式模型构建
通过对高考真题和各地模拟题的研究可以发现:热重分析题均以图像为依托,要求学生推断不同温度下的组分,或以此来书写不同温度下的化学方程式。从图像角度对比,各试题图像有相似之处,质量(纵坐标)均随温度(横坐标)升高而呈现阶梯式下降,这表明在受热过程中,物质分步发生分解,在每个温度段区域都会形成较为稳定的物质。从物质角度对比,这一类物质往往是结晶水合物,在受热过程中容易先发生脱水,随后非金属元素形成的阴离子发生分解,若金属元素有变价,接下来常发生氧化还原反应,最终生成较为稳定的金属氧化物[1]。在变化过程中,固体中金属元素的部分是保持不变的,因此解题时应抓住金属元素守恒建立关系[2]。
三、解题模型构建
1. m-T热重曲线——三段式法
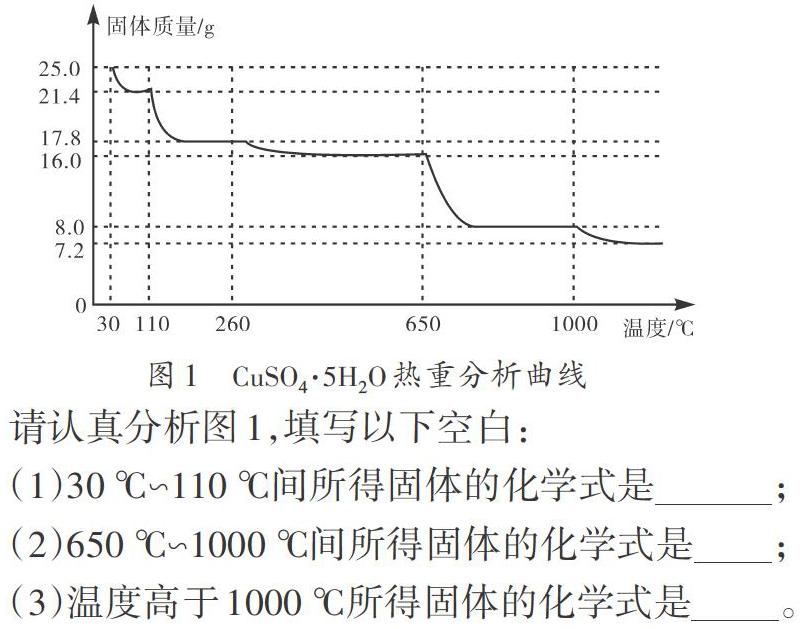
【例1】(2015年通州模拟,27)将25.0 g胆矾晶体放在坩埚中加热测定晶体中结晶水的含量,固体质量随温度的升高而变化的曲线如图1所示。
请认真分析图1,填写以下空白:
(1)30 ℃∽110 ℃间所得固体的化学式是_______________________;
(2)650 ℃∽1000 ℃间所得固体的化学式是____________________;
(3)温度高于1000 ℃所得固体的化学式是____________________。
解析:胆矾是学生熟悉的物质,我们可以参照失重方式模型找到2个特殊点:完全脱水的CuSO4和金属氧化物CuO。25.0 g CuSO4·5H2O的物质的量为0.1 mol,根据金属元素守恒,可以通过列三段式顺利计算出特殊点的质量。
对比题中数据,可知30 ℃、650 ℃、1000 ℃时固体分别为CuSO4·5H2O、CuSO4、CuO,因此在650 ℃∽1000 ℃加热阶段最终所得固体的化学式为CuO。由于110 ℃时固体质量介于16g与25 g之间,可以判定为部分脱水。根据Cu元素守恒,设110 ℃时固体的化学式为CuSO4·xH2O,根据铜元素守恒n(CuSO4·xH2O)=0.1 mol,m(CuSO4·xH2O)=21.4 g,M(CuSO4·xH2O)=160+18x=214 g/mol,解得x=3,所以110 ℃时固体的化学式为CuSO4·3H2O。
1000 ℃时固体已经是金属氧化物,考虑铜有变价,升高温度应该发生氧化还原反应,生成其他价态的金属氧化物。设高于1000 ℃固体的化学式为CuOx,根据铜元素守恒n(CuOx)=0.1 mol,m(CuOx)=7.2 g,M(CuOx)=64+18x=72 g/mol,解得x=0.5。在化学式中,各元素之比应写最简整数比,所以温度高于1000 ℃所得固体的化学式为Cu2O。
此类试题中的热重曲线的纵坐标较为简单,就是我们所要推断的组分质量。在解题时,可先找到特殊点(完全脱水产物、分解产物、金属氧化物)构建失重的过程,然后利用金属元素守恒,列三段式(m-M-n),随后对比特殊点数据和题目中所给具体数据,判断变化过程,最后就能通过精确计算,确定该温度区域下物质的化学式或书写相应的化学方程式。
2. ω-T热重曲线——巧设1 mol,转化为m-T热重曲线
在高考试题中,热重曲线中的纵坐标往往不是简单的质量,而是会发生变形,变成质量的比值。
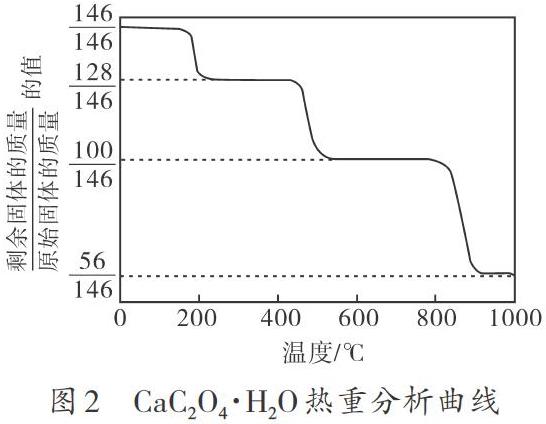
【例2】(2019年江苏,20)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化如图2所示。写出400 ℃∽600 ℃范围内分解反应的化学方程式:_________________________。
解析:观察图像可以发现纵坐标为比值形式,而分母均为146,恰好与CaC2O4·H2O的摩尔质量数值相等,因此可以假设CaC2O4·H2O为1 mol,即原始固体质量为146 g。若纵坐标统一乘以146,就可以将比值转化为剩余固体的质量,如表1所示。此时就将ω-T热重曲线转化为m-T热重曲线。
纵坐标除了变形为质量的比值,还可为固体残留率(百分数)。
解析:观察图像可以发现纵坐标为百分数,结合题意,固体残留率即剩余固体的质量分数。此时纵坐标的含义与例2接近,只要知道原固體的质量就可以进行相同的转化。为了方便计算,我们依旧设原固体为1 mol,转化数据如表2所示。
解得x=1.5,y=1.33,即290 ℃、500 ℃时所得固体的化学式为Co2O3、Co3O4,因此1000 ℃时,剩余固体成分为CoO,在350 ℃∽400 ℃范围内,剩余固体成分为Co2O3。
除此之外,纵坐标还可转化为失重率。
已知:[失重%=加热减少的质量原晶体样品的总质量×100%]。
解析:此时纵坐标的含义为减少的固体的质量分数。剩余固体质量=原固体总质量×(1-失重%),同样,可以设硫酸铝晶体为1 mol进行数据转化,如表3所示。
通过以上例题可以发现,无论纵坐标怎么改变,首先需要分析图像,理解纵坐标表达的意义;其次,巧设“1 mol”进行还原,将百分数转化为剩余固体质量,从而将ω-T热重曲线转化为m-T热重曲线来解题。
教学实践表明,在试题讲解过程中,引导学生结合图形[3],抓住关键信息,利用已有知识进行分析推理,有利于提高学生思维的严密性和迁移知识的能力。同时在解题的过程中构建模型,更能消除学生的畏惧心理,引导学生体验探究过程,激发学生的求知欲,提升学生的科学素养。
[ 参 考 文 献 ]
[1] 韩江涛,杨云. 中学化学热重曲线类试题文献分析及建议[J].化学教学,2016(7):82-86.
[2] 房寿高. 热重分析类化学计算题的解题方法[J].新高考(高三理化生),2014 (10):38-41.
[3] 高晓莹,吴春峰. 基于作图和识图角度评析热重分析图形[J].中学化学教学参考,2014 (5):50-51.
(责任编辑 罗 艳)