阿尔兹海默病的发病机制及药物治疗研究进展
2020-01-15邓青芳马风伟
邓青芳,马风伟
(1.贵州师范大学 贵州省山地环境信息系统与生态环境保护重点实验室,贵州 贵阳 550001;2.贵阳学院 食品与制药工程学院,贵州 贵阳 550005)
0 引言
阿尔兹海默病(Alzheimer’s disease,AD)是一种常见的中枢神经系统退行性疾病,临床上主要表现为进行性的认知功能障碍和行为能力损害,病因尚不明确,在老龄人口中的发病率很高,目前无特效治愈药物,仅对AD患者进行对症治疗和延缓AD进程治疗。自1906年Alois Alzheimer博士报道该病以来[1],全世界的科研人员针对AD进行了深入研究。关于AD的发病机制,存在多种学说[2],如脑内神经细胞外,β-淀粉样蛋白(Amyloid β-protein, Aβ)异常沉积;脑内神经细胞内,Tau蛋白(Tubulin-associated unit)自聚集成神经原纤维缠结(Neurofibrillary tangles,NFTs)而引起的Tau蛋白病(Tauopathies);小胶质细胞炎症(Microglia-mediated neuroinflammation)和泛素-蛋白酶体系统异常(Ubiquitin-proteasome system abnormality)等。
近年来,临床发现大脑中出现β-淀粉样蛋白沉积的老年人常常并没有出现失智症状,而且靶向β-淀粉样蛋白的药物开发在临床上常常疗效不佳[3],于是研究人员越来越重视靶向Tau蛋白药物开发来治疗AD,并取得了一定的进展[4]。同时有研究发现,小胶质细胞在AD的发生发展进程中起着重要作用。本文从AD发病的可能(Tau蛋白、Aβ、小胶质细胞、泛素-蛋白酶体系统)机制和临床治疗药物等方面进行综述,为AD的发病机制探索及AD的治疗药物开发提供帮助。
1 AD可能发病机制
1.1 Tau蛋白与AD
Tau蛋白是一种微管(Tubulin)相关蛋白,主要分布在脑部神经元的轴突中,微管蛋白为球形分子,分子量约为55 kDa,有两种亚基(α-微管蛋白和β-微管蛋白),这两种亚基有35%~40%的氨基酸序列同源;α-微管蛋白和β-微管蛋白聚合成动态微管(Microtubule),是细胞骨架的主要成分之一,对保持细胞的形态、胞内物质的运输起着重要作用[5]。Tau蛋白的生物学功能是诱导微管蛋白聚合成微管,同时防止其解聚,从而维持神经细胞的形态和功能[6]。此外,Tau蛋白还在神经元细胞可塑性、信号转导、细胞周期调控等方面发挥重要作用[7]。人类的Tau蛋白基因位于17号染色体的长臂(17q21)。Tau基因全长大约133.9 kb,包含16个外显子(Exons),其中有3个外显子(Exon 4A,6和8)未在人类大脑中出现。目前在成年人大脑中发现至少6种不同亚型(Isoform)的Tau蛋白,这6种亚型为Tau基因中3个外显子(Exon 2,3和10)选择性剪接的结果。其区别主要有以下两点:1)Tau蛋白N-端是否存在插入(Inserts)片段;2)Tau蛋白C-端是否存在不完全的重复序列(R1,R2,R3,R4)。
Tau蛋白主要包括4个功能区域,分别为:1)C-末端区域;2)N-末端区域;3)脯氨酸聚集区域;4)微管结合区域(Microtubule-binding domains,MBDs)。其中MBDs包括了4个不完全的重复序列-R1、R2、R3、R4,能够促进Tau蛋白与微管的结合。这种结合非常重要,可以诱导Tau蛋白发生构象变化。Jeganathan等人[8]通过质子光谱法研究Tau蛋白发现,其在生理状态下为自然展开,不具有二级结构,而在病理状态下,具有明显的β-折叠结构。Tau蛋白的α-螺旋或β-折叠结构与其发生过度磷酸化有关,已经证实,Tau蛋白的翻译后修饰(Post-translational modifications,PTMs)的异常过度磷酸化使其具有高度的聚集倾向,从而形成成对螺旋纤维细丝(Paired helical filaments,PHFs),进而使神经纤维缠结(Nerve fiber tangles,NFTs),构成了神经元细胞最早期的细胞骨架改变[9]。
Tau蛋白的翻译后修饰有多种类型[10],包括磷酸化、糖基化、甲基化、乙酰化、糖醛酸化、硫酸化、泛素化、硝酸化、截断修饰等(图1)。在正常人的脑细胞内,一般1分子的Tau蛋白有2~3分子的磷酸基团修饰,同时磷酸化修饰的Tau蛋白在不停的去磷酸化,Tau蛋白的磷酸化和去磷酸化作用动态平衡调节着细胞骨架的稳定性,影响着神经元轴突的形态和脑部的功能。但在AD状态下,Tau蛋白发生异常的磷酸化,每个Tau蛋白分子可发生9~10个磷酸基团连接,过度磷酸化的Tau蛋白不仅影响其与微管的结合能力,也影响其它微管集合蛋白与微管的结合[11]。

注:A:磷酸化;B:糖基化;C:甲基化;D:乙酰化;E:糖醛酸化;F:泛素化;G:硝酸化;H:硫酸化;I:截断化。图1 Tau蛋白的翻译后修饰类型Fig.1 Common types of post-translational modifications of Tau
目前,在Tau蛋白上发现的磷酸化位点至少有45个,其中大部分是发生在丝氨酸残基(Ser)和苏氨酸残基(Thr)(图2)的羟基上,并且约一半的磷酸化位点中有脯氨酸(Pro)存在[11]。Tau蛋白的磷酸化修饰受一系列激酶的调节,其中很多是Pro依赖的蛋白激酶,如蛋白激酶A、糖原合成酶激酶3β(GSK3β)、酪氨酸激酶和细胞周期蛋白依赖激酶5等。在AD患者脑中,Tau蛋白的磷酸化修饰现象异常增多,异常磷酸化的Tau蛋白发生构象变化,容易从微观蛋白上解离[12]。
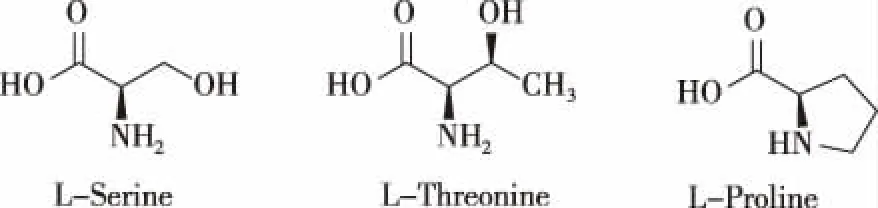
图2 丝氨酸残基、苏氨酸残基和脯氨酸残基结构Fig.2 The structure of Serine, Threonine and Proline
1.2 Aβ蛋白与AD
Aβ是由淀粉样前体蛋白(Amyloid precursor protein,APP)分解产生的[13]。APP是一种跨膜蛋白,有不同的水解途径(图3),其中经β-分泌酶和γ-分泌酶水解产生含有40或42个氨基酸的Aβ40和Aβ42蛋白[14](图4)。Aβ42蛋白更易于形成致密纤维状斑块,沉积在大脑皮层和海马区域,引起神经元的过氧化损伤,突触功能障碍,诱发神经炎症及神经细胞凋亡,最终导致AD的发生[15]。
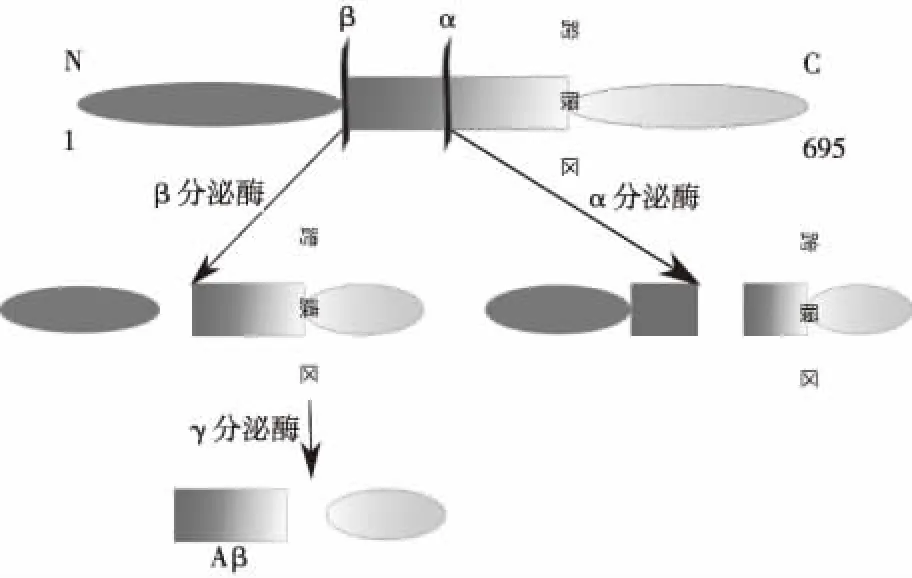
图3 APP在β-分泌酶和γ-分泌酶作用下生成Aβ蛋白Fig.3 Generation of Aβ from APP of β-secretase and γ-secretase
图4 Aβ42蛋白的氨基酸序列Fig.4 The amino acid sequence of amyloid β-protein 1-42
在AD患者的脑中,Aβ蛋白的C端羧基首先自聚合形成核因子核心,然后以此核心形成透明状的原纤维,之后再经过多次β-折叠形成Aβ纤维丝[16]。Aβ可分为三种聚合形式:单体、寡聚体和纤维,其中Aβ单体并不影响神经元的功能,Aβ纤维丝有神经毒性,研究表明,Aβ寡聚体毒性更大,其可以快速引发神经元大量死亡[17]。
有实验研究表明,Aβ寡聚体可与N-甲基-D-天冬氨酸受体结合,可使神经细胞内Ca2+浓度升高[18];同时发现Ca2+依赖性蛋白激酶活性在AD患者的海马区较非AD患者有明显加强,表明Aβ蛋白可能通过钙超载,导致神经细胞内氧化应激增加,树突棘缺失来体现Aβ蛋白的毒性作用[19]。
Aβ蛋白在脑中生成后,其清除途径有很多,但最主要的是通过胶质细胞的胶质蛋白清除,过程包括星形胶质细胞产生低密度脂蛋白受体,该受体可与Aβ结合,使其降解[20];其次小胶质细胞被激活,小胶质细胞能够吞噬Aβ蛋白,保护神经细胞。但小胶质细胞的激活以及炎症反应对神经元细胞以及AD的发生是双向[21]。
1.3 小胶质细胞与AD
小胶质细胞(Microglial cell)是神经组织中体积最小的一种胶质细胞,也是唯一一种来源于中胚层的细胞[22]。小胶质细胞是固有的免疫效应细胞,其在中枢神经系统的生理过程及AD发病过程中发挥着重要作用[23]。
生理状态下,小胶质细胞具有高度专业化形态,细胞体呈细长或椭圆形,胞体内有少量细胞器,并且从胞体发出细长且分支的突起。小胶质细胞通过不同方向的突起延伸来探测脑内环境,以约1次/时的频率与神经元细胞接触,大量的小胶质细胞大约每4~5 h即可将大脑检查一遍[23]。当机体出现生理稳态失衡时,小胶质细胞会及时作出反应,主要有以下变化:1)小胶质细胞形态改变,如胞体增大,突起收缩;2)小胶质细胞进一步活化,突起消失,形态进行“阿米巴”样改变,具有吞噬能力;3)小胶质细胞增殖,数量增加,并迁移至损伤部位;4)小胶质细胞极化分化,细胞因子的释放。
小胶质细胞介导的炎症反应与AD有密切关系,研究表明,AD患者及实验大鼠脑内的海马区附近的小胶质细胞聚集,进而引发炎症因子的分泌聚集,出现严重的中枢神经损伤[24-25]。根据小胶质细胞分泌细胞因子的不同,可以把小胶质细胞分为两种极化表型,即M1型(经典激活性小胶质细胞)和M2型(选择性激活性小胶质细胞)(图5)。其中M1型主要分泌IL-1β(白介素-1β)、IL-6(白介素-6)、TNF-α(肿瘤坏死因子-α)、iNOS(诱导型一氧化氮合酶)等促炎因子,M2型分泌IL-4(白介素-4)、IL-10(白介素-10)、TGF-β(转化生长因子-β)、PDGF(血小板源生长因子)、VEGF(血管内皮细胞生长因子)等抗炎因子及神经营养因子[24]。过度激活的小胶质细胞释放大量的炎症因子及神经毒性物质,炎症反应增加增强,Aβ蛋白沉积,神经元损伤,加剧AD的病情。
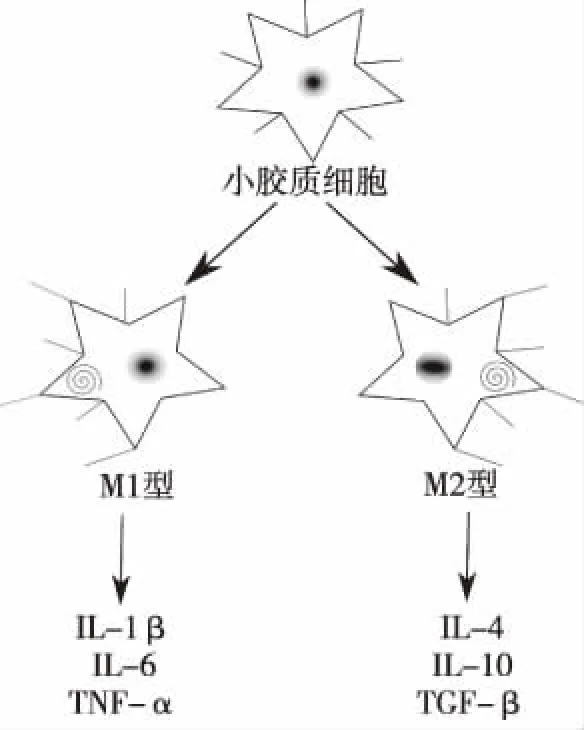
图5 小胶质细胞的分化极化及细胞因子Fig.5 M1 and M2 microglia and the factors they induced
IL-1β广泛分布于大脑中,其中在海马区域中浓度最高,而且IL-1β在AD患者和大鼠模型海马中的表达水平很高,提示M1型小胶质细胞在AD过程中起着重要作用[26]。IL-6是由小胶质细胞产生的一种糖蛋白,通过IL-6受体介导炎症反应,诱导神经元细胞凋亡,AD患者的老年斑(Senile plaque,SP)中IL-6水平高表达[27]。
1.4 泛素-蛋白酶体系统与AD
泛素-蛋白酶体途径(Ubiquitin-proteasome system,UPS)是真核生物细胞内一种高效的非溶酶体蛋白降解途径[28]。UPS也是防止神经元细胞内异常蛋白聚集的关键途径之一。泛素化蛋白的堆积和聚集是许多神经退行性疾病的标志,AD患者脑中UPS功能障碍与Aβ沉积、Tau蛋白磷酸化等均有密切关系[29]。因此,调控UPS的功能对AD的改善及治疗的影响,已成为当下研究的热点。
UPS对特定的蛋白质底物进行降解的过程可分为两步:1)泛素与蛋白质底物进行共价结合,形成泛素化标记的蛋白质底物,此过程称为泛素化;2)26S蛋白酶体对泛素化标记的蛋白底物进行降解,以及解离泛素链。泛素是一种广泛存在于真核细胞中的多肽,其单个分子由76个氨基酸组成,分子量约为8.5 kDa(图6)[30]。泛素多肽利用其末端76位甘氨酸的羧基与蛋白质底物中赖氨酸的氨基共价结合,使目标蛋白泛素化标记,以便进一步降解[31]。26S蛋白酶体是一个巨大的复合物体,分子量约为2 000 kDa,其由20S和19S两种结构组装而成,20S呈桶状,19S呈帽状。

图6 泛素蛋白的氨基酸序列Fig.6 The amino acid sequence of ubiquitin
蛋白的泛素化作用是可逆的,机体存在着去泛素化酶(Deubiquitinating enzymes,DUB)能使泛素从蛋白上切掉,从而避免蛋白被降解的命运[32]。人体的DUBs可分为5个亚家族,分别为:JAB1/MPN/Mov34蛋白酶亚家族(JAMM)、Josephin结构域蛋白酶亚家族(MJD)、卵巢肿瘤相关蛋白酶亚家族(Ovarian tumor domain,OTU)、泛素C末端水解酶亚家族(Ubiquitin C-terminal hydrolase,UCH)和泛素特异性蛋白酶亚家族(Ubiquitin specific proteases,USPs),其中USPs亚家族是DUB家族中成员最多的亚家族[32]。
2 药物治疗
2.1 针对AD的化学药物治疗
虽然关于AD的治疗药物研究进行了很多年,但是目前尚未有根治AD的药物,多数药物针对临床症状开展针对性治疗,如胆碱能神经元在大脑皮层的发育、认知功能、学习记忆等方面起着重要的调节作用,乙酰胆碱作为重要的神经递质在AD患者中出现异常,表现为乙酰胆碱合成减少,摄取不足等。故临床上常用胆碱酯酶抑制剂来降低乙酰胆碱的水解,维持大脑内乙酰胆碱水平,进而增强胆碱能神经元的突触传递效能,改善AD患者的认知功能[33]。表1列举了临床上常用的治疗AD的化学药物以及一些新型的治疗药物(免疫治疗)。

表1 治疗AD的常用化学药物Tab.1 Commonly used clinical drugs for AD cure
2.2 针对AD的植物提取物及中药复方治疗
中草药治疗AD已有千年的悠久历史[41,42],但其治疗机制尚不明确,植物次生代谢产物是其生长过程中产生的非必需的小分子类化合物,种类多样,结构复杂,有些对AD有明显的治疗效果[43](表2)。中医认为,AD属于“呆病”,是元气的崩溃以及经络、喉咙阻塞引起的,中药复方如天麻钩藤饮、六味地黄丸等常用于临床上AD的治疗。也有医家提倡“治痰即治呆”,通过治疗脾胃,减痰化痰来治疗AD,并取得了一定疗效[44]。

表2 治疗AD的植物提取物及中药复方Tab.2 Natural products source and Chinese herbal compound formula for AD treatment
3 展望
随着人口老龄化的时代到来,AD患者的发病率将逐年增加,如果将AD发病时间延迟5~10年,则大大减轻中国乃至世界的经济社会负担。近年来,虽然基因组学、蛋白组学、分子生物学的不断发展对AD发病机制有了更深入的了解,但是AD作为CNS退行性疾病,具有长期性和渐进性的特点,其具体的发病机制仍未完全清晰,特异性的预防及治疗AD的药物也仍未上市。但另一方面,随着研究的深入,AD的早期发病的分子生物学改变与神经炎症有密切关系,因此,今后可从以下3方面开展AD更深入的工作:1)小胶质细胞的生物信息学分析,以及小胶质细胞激活、增殖、分泌炎症因子的诱因研究;2)神经炎症与APP水解位点的关系及控制因素的研究;3)UPS功能障碍的诱因及诱导神经元细胞凋亡的关联研究。相信随着分子生物学技术的发展,人类对AD的研究将更深入,也将筛选出更加高效的特异性强的化学药物或中药,为AD的预防和治疗提供更精准的治疗药物和治疗方案。
