无金属条件下I2/TBHP体系促进磺酰肼与烯醇硅醚自由基偶联反应合成α-磺酰基酮
2020-01-15唐裕才张文熙王菲菲
唐裕才, 屈 煌, 张文熙, 王菲菲, 王 钢
(洞庭湖生态经济区建设与发展湖南省协同创新中心, 湖南文理学院化学与材料工程学院, 常德 415000)
砜基化合物广泛存在于天然产物和药物中, 具有广谱生物活性, 已被用于杀虫、 除草和抗肿瘤等领域[1]. 作为一类重要的砜基化合物,α-磺酰基酮在有机合成中具有十分重要的用途, 被广泛用于制备二取代炔烃[2,3]、 取代的烯烃[4,5]、 多官能化的4H-吡喃化合物[6]和光学活性的β-羟基砜等产物[7]. 此外, 特定结构的α-磺酰基酮化合物还具有杀菌活性[8]. 因此,α-磺酰基酮化合物的合成备受关注. 传统的构建α-磺酰基酮化合物的方法分为2步: (1) 将酮化合物α位预官能化(如卤化); (2) 在碱性条件下发生亲核取代反应, 脱去一分子无机盐生成终产物[9,10]. 但此类方法涉及多个反应步骤, 反应条件苛刻, 副产物多, 在实际使用中受到一定限制. 因此, 需要发展更加绿色、 简洁的构建α-磺酰基酮化合物的方法. 近年来, 科研工作者将羰基结构转化为活泼的烯醇化合物及其衍生物, 用于制备α-官能化的羰基化合物[11~16], 但利用烯醇硅醚为自由基受体合成α-磺酰基酮化合物的研究却鲜少报道[17~19]. Kamigata等[20]研究发现, RuCl2(PPh3)3能催化烯醇硅醚与磺酰氯在120 ℃下发生偶联反应, 但该反应条件苛刻, 且底物范围较窄. 在前期研究工作[21~23]基础上, 本文以I2/TBHP体系为氧化还原体系, 使烯醇硅醚与各种取代的磺酰肼发生自由基偶联反应, 合成了系列α-磺酰基酮衍生物, 该反应底物范围广, 为具有生物活性的α-磺酰基酮化合物的设计和筛选提供了可能. 反应利用廉价的碘为催化剂且副产物为分子氮气, 更加绿色环保.
1 实验部分
1.1 试剂与仪器
苯乙酮、 三甲基氯硅烷(TMSCl)、 磺酰氯、 三乙胺、 碘、 四丁基碘化铵(TBAI)、 过硫酸钾(K2S2O8)、 二叔丁基过氧化物(DTBP)、 碘化钾、 碘化钠、 五氧化二碘(I2O5)和叔丁基过氧化氢[TBHP, 70%(质量分数)水溶液]均为分析纯, 购于阿拉丁试剂有限公司; 乙腈(CH3CN)、 四氢呋喃(THF)、 甲苯(toluene)、 正戊烷、N,N-二甲基甲酰胺(DMF)、 1,2-二氯乙烷(DCE)和乙酸乙酯(EtOAc)均为分析纯, 购于国药集团化学试剂有限公司. 所用溶剂均经KOH, Na 或CaH2纯化.
Bruker AC-500型核磁共振波谱(NMR)仪, 以CDCl3为溶剂, 德国Bruker公司; SB-1100型旋转蒸发器, 上海爱朗仪器有限公司; DLSB-10/40型低温冷却液循环泵, 巩义市予华仪器有限责任公司; X-6型显微熔点测定仪, 北京泰克仪器有限公司.
1.2 实验过程
1.2.1 烯醇硅醚类化合物的合成 在100 mL充满氮气的三口烧瓶中加入25 mmol苯乙酮类化合物、 30 mmol(4.5 g)碘化钠和30 mL干燥的乙腈, 室温下搅拌反应5 min; 加入30 mmol(4.2 mL)三乙胺和30 mmol(3.82 mL)三甲基氯硅烷, 于40 ℃搅拌反应12 h; 用薄层色谱法(TLC)监测反应到完全后, 加入50 mL冰水淬灭反应. 随后加入正戊烷(20 mL×3)进行萃取; 合并有机相, 用饱和NaCl溶液洗涤, MgSO4干燥, 经柱层析分离(石油醚/乙酸乙酯体积比20∶1), 得到烯醇硅醚类化合物.
1.2.2 磺酰肼类化合物的合成 在充满氮气的圆底烧瓶中, 依此加入10 mmol磺酰氯及10 mL THF, 待完全溶解后, 冰浴下降温至0 ℃, 缓慢滴加1.21 mL(含量为60%) 水合肼溶液, 滴毕继续搅拌反应30 min; 然后加入20 mL乙酸乙酯, 用饱和氯化钠溶液洗涤3次, 有机相用无水硫酸钠干燥、 过滤; 将干燥的有机相缓慢滴加到120 mL正己烷溶液中, 搅拌10 min, 过滤, 收集析出的白色固体, 用无水乙醇重结晶, 得到磺酰肼类化合物.
1.2.3α-磺酰基酮类化合物的合成 分别将0.06 mmol单质碘、 0.3 mmol烯醇硅醚类化合物和0.6 mmol磺酰肼类化合物加入到2 mL 1,2-二氯乙烷中, 再加入0.6 mmol TBHP(70%水溶液), 升温至80 ℃继续反应8 h; 用TLC监测反应完全后, 旋转蒸发除去溶剂, 经柱层析分离(石油醚/乙酸乙酯体积比4∶1), 得到α-磺酰基酮化合物3a~3w.
2 结果与讨论
2.1 反应条件的筛选
所合成化合物的理化性质及NMR数据分别列于表1和表2. 化合物的NMR谱图见本文支持信息.
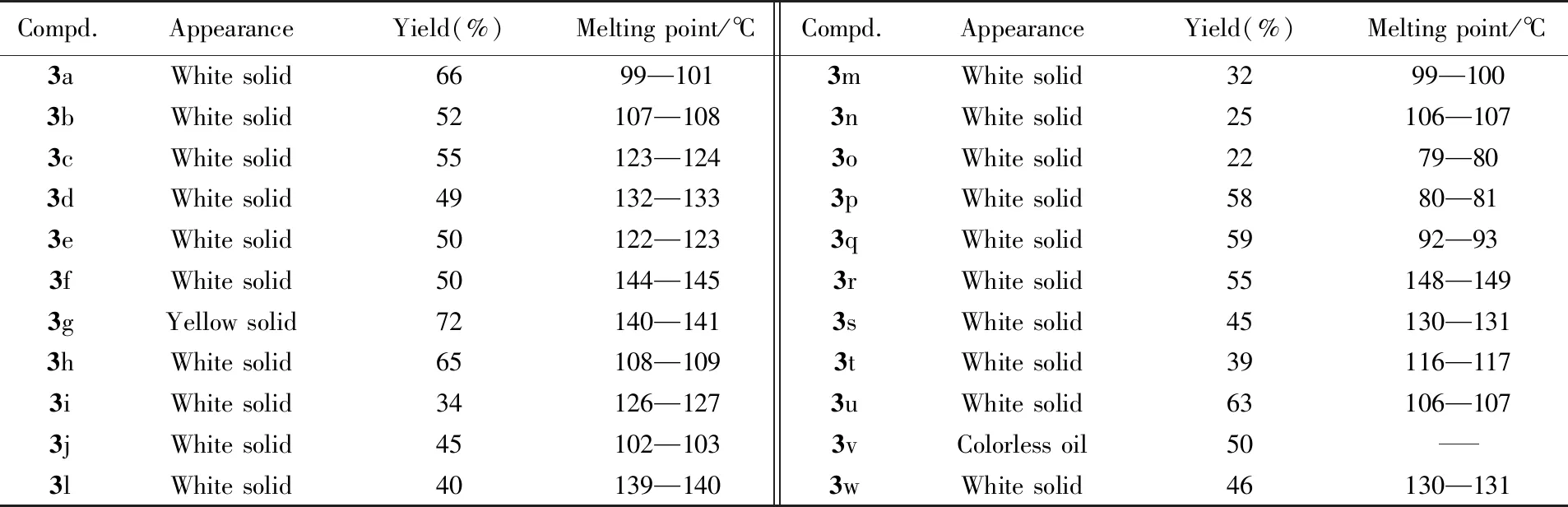
Table 1 Appearance, yields and melting point data of target compounds 3a—3w

Table 2 1H NMR and 13C NMR data of target compounds 3a—3w
Continued
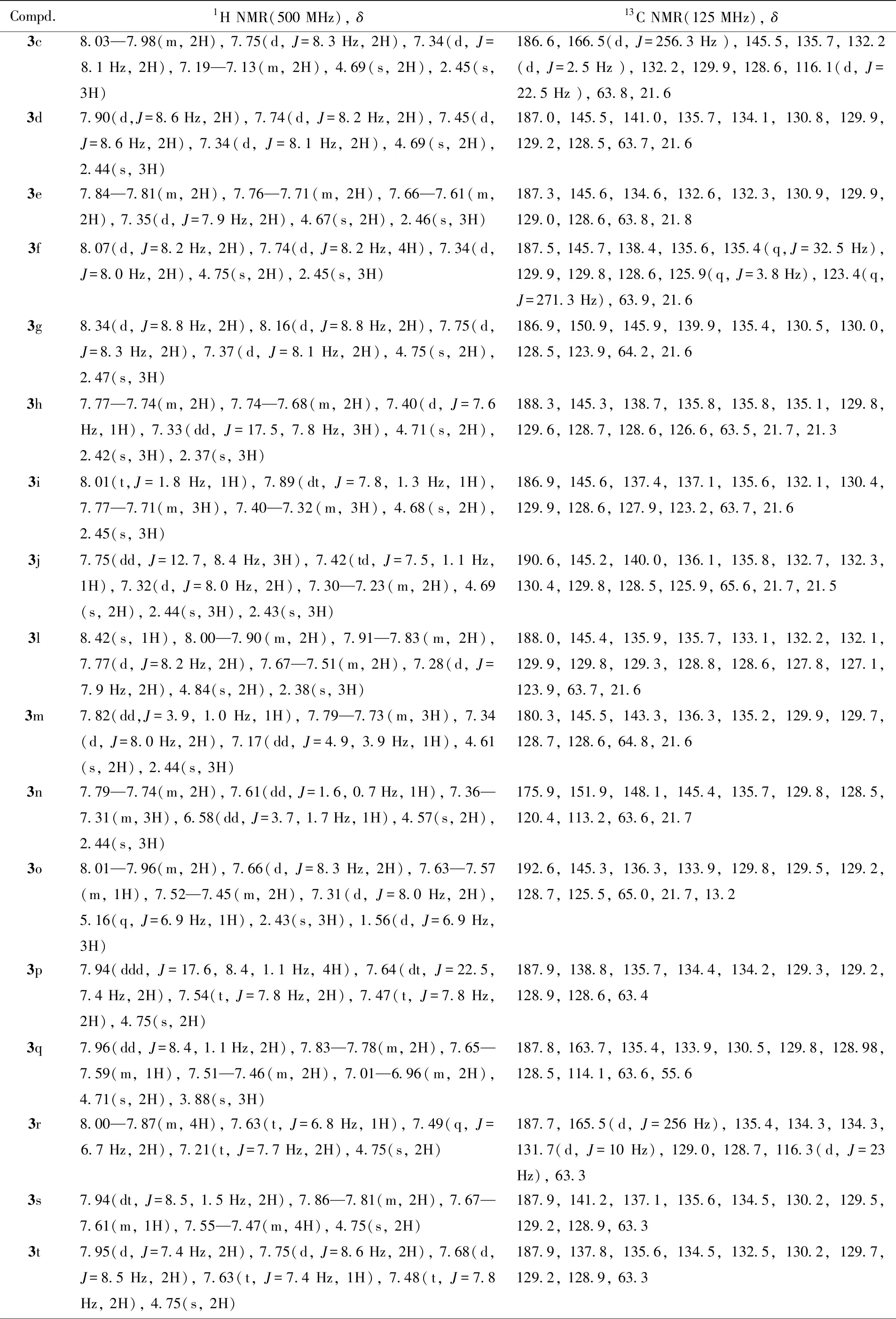
Compd.1H NMR(500 MHz), δ13C NMR(125 MHz), δ3c8.03—7.98(m, 2H), 7.75(d, J=8.3 Hz, 2H), 7.34(d, J=8.1 Hz, 2H), 7.19—7.13(m, 2H), 4.69(s, 2H), 2.45(s, 3H)186.6, 166.5(d, J=256.3 Hz ), 145.5, 135.7, 132.2(d, J=2.5 Hz ), 132.2, 129.9, 128.6, 116.1(d, J=22.5 Hz ), 63.8, 21.63d7.90(d,J=8.6 Hz, 2H), 7.74(d, J=8.2 Hz, 2H), 7.45(d, J=8.6 Hz, 2H), 7.34(d, J=8.1 Hz, 2H), 4.69(s, 2H), 2.44(s, 3H)187.0, 145.5, 141.0, 135.7, 134.1, 130.8, 129.9, 129.2, 128.5, 63.7, 21.63e7.84—7.81(m, 2H), 7.76—7.71(m, 2H), 7.66—7.61(m, 2H), 7.35(d, J=7.9 Hz, 2H), 4.67(s, 2H), 2.46(s, 3H)187.3, 145.6, 134.6, 132.6, 132.3, 130.9, 129.9, 129.0, 128.6, 63.8, 21.83f8.07(d, J=8.2 Hz, 2H), 7.74(d, J=8.2 Hz, 4H), 7.34(d, J=8.0 Hz, 2H), 4.75(s, 2H), 2.45(s, 3H)187.5, 145.7, 138.4, 135.6, 135.4(q,J=32.5 Hz), 129.9, 129.8, 128.6, 125.9(q, J=3.8 Hz), 123.4(q, J=271.3 Hz), 63.9, 21.63g8.34(d, J=8.8 Hz, 2H), 8.16(d, J=8.8 Hz, 2H), 7.75(d, J=8.3 Hz, 2H), 7.37(d, J=8.1 Hz, 2H), 4.75(s, 2H), 2.47(s, 3H)186.9, 150.9, 145.9, 139.9, 135.4, 130.5, 130.0, 128.5, 123.9, 64.2, 21.63h7.77—7.74(m, 2H), 7.74—7.68(m, 2H), 7.40(d, J=7.6 Hz, 1H), 7.33(dd, J=17.5, 7.8 Hz, 3H), 4.71(s, 2H), 2.42(s, 3H), 2.37(s, 3H)188.3, 145.3, 138.7, 135.8, 135.8, 135.1, 129.8, 129.6, 128.7, 128.6, 126.6, 63.5, 21.7, 21.33i8.01(t,J=1.8 Hz, 1H), 7.89(dt, J=7.8, 1.3 Hz, 1H), 7.77—7.71(m, 3H), 7.40—7.32(m, 3H), 4.68(s, 2H), 2.45(s, 3H)186.9, 145.6, 137.4, 137.1, 135.6, 132.1, 130.4, 129.9, 128.6, 127.9, 123.2, 63.7, 21.63j7.75(dd, J=12.7, 8.4 Hz, 3H), 7.42(td, J=7.5, 1.1 Hz, 1H), 7.32(d, J=8.0 Hz, 2H), 7.30—7.23(m, 2H), 4.69(s, 2H), 2.44(s, 3H), 2.43(s, 3H)190.6, 145.2, 140.0, 136.1, 135.8, 132.7, 132.3, 130.4, 129.8, 128.5, 125.9, 65.6, 21.7, 21.53l8.42(s, 1H), 8.00—7.90(m, 2H), 7.91—7.83(m, 2H), 7.77(d, J=8.2 Hz, 2H), 7.67—7.51(m, 2H), 7.28(d, J=7.9 Hz, 2H), 4.84(s, 2H), 2.38(s, 3H)188.0, 145.4, 135.9, 135.7, 133.1, 132.2, 132.1, 129.9, 129.8, 129.3, 128.8, 128.6, 127.8, 127.1, 123.9, 63.7, 21.63m7.82(dd,J=3.9, 1.0 Hz, 1H), 7.79—7.73(m, 3H), 7.34(d, J=8.0 Hz, 2H), 7.17(dd, J=4.9, 3.9 Hz, 1H), 4.61(s, 2H), 2.44(s, 3H)180.3, 145.5, 143.3, 136.3, 135.2, 129.9, 129.7, 128.7, 128.6, 64.8, 21.63n7.79—7.74(m, 2H), 7.61(dd, J=1.6, 0.7 Hz, 1H), 7.36—7.31(m, 3H), 6.58(dd, J=3.7, 1.7 Hz, 1H), 4.57(s, 2H), 2.44(s, 3H)175.9, 151.9, 148.1, 145.4, 135.7, 129.8, 128.5, 120.4, 113.2, 63.6, 21.73o8.01—7.96(m, 2H), 7.66(d, J=8.3 Hz, 2H), 7.63—7.57(m, 1H), 7.52—7.45(m, 2H), 7.31(d, J=8.0 Hz, 2H), 5.16(q, J=6.9 Hz, 1H), 2.43(s, 3H), 1.56(d, J=6.9 Hz, 3H)192.6, 145.3, 136.3, 133.9, 129.8, 129.5, 129.2, 128.7, 125.5, 65.0, 21.7, 13.23p7.94(ddd, J=17.6, 8.4, 1.1 Hz, 4H), 7.64(dt, J=22.5, 7.4 Hz, 2H), 7.54(t, J=7.8 Hz, 2H), 7.47(t, J=7.8 Hz, 2H), 4.75(s, 2H)187.9, 138.8, 135.7, 134.4, 134.2, 129.3, 129.2, 128.9, 128.6, 63.43q7.96(dd, J=8.4, 1.1 Hz, 2H), 7.83—7.78(m, 2H), 7.65—7.59(m, 1H), 7.51—7.46(m, 2H), 7.01—6.96(m, 2H), 4.71(s, 2H), 3.88(s, 3H)187.8, 163.7, 135.4, 133.9, 130.5, 129.8, 128.98, 128.5, 114.1, 63.6, 55.63r8.00—7.87(m, 4H), 7.63(t, J=6.8 Hz, 1H), 7.49(q, J=6.7 Hz, 2H), 7.21(t, J=7.7 Hz, 2H), 4.75(s, 2H)187.7, 165.5(d, J=256 Hz), 135.4, 134.3, 134.3, 131.7(d, J=10 Hz), 129.0, 128.7, 116.3(d, J=23 Hz), 63.33s7.94(dt, J=8.5, 1.5 Hz, 2H), 7.86—7.81(m, 2H), 7.67—7.61(m, 1H), 7.55—7.47(m, 4H), 4.75(s, 2H)187.9, 141.2, 137.1, 135.6, 134.5, 130.2, 129.5, 129.2, 128.9, 63.33t7.95(d, J=7.4 Hz, 2H), 7.75(d, J=8.6 Hz, 2H), 7.68(d, J=8.5 Hz, 2H), 7.63(t, J=7.4 Hz, 1H), 7.48(t, J=7.8 Hz, 2H), 4.75(s, 2H)187.9, 137.8, 135.6, 134.5, 132.5, 130.2, 129.7, 129.2, 128.9, 63.3
Continued

Compd.1H NMR(500 MHz), δ13C NMR(125 MHz), δ3u8.06(d, J=8.2 Hz, 2H), 7.92(dd, J=8.3, 1.1 Hz, 2H), 7.81(d, J=8.3 Hz, 2H), 7.67—7.61(m, 1H), 7.49(t, J=7.9 Hz, 2H), 4.80(s, 2H)187.5, 141.8, 135.7, 135.3(d,J=15.7 Hz), 134.4, 129.2, 129.0, 128.8, 126.9(q, J=3 Hz), 123.1(q, J=272 Hz), 62.93v8.08—8.02(m, 1H), 7.97—7.91(m, 2H), 7.64—7.55(m, 3H), 7.51—7.41(m, 3H), 5.06(s, 2H)187.6, 136.2, 135.5, 134.9, 134.3, 132.5, 131.8, 131.6, 128.9, 128.7, 127.3, 60.93w8.48(s, 1H), 8.01—7.91(m, 5H), 7.87(dd, J=8.6, 1.9 Hz, 1H), 7.73—7.65(m, 1H), 7.65—7.55(m, 2H), 7.45(t, J=7.8 Hz, 2H), 4.81(s, 2H)187.9, 135.5, 135.4, 135.3, 134.1, 131.8, 130.4, 129.4, 129.3, 129.1, 128.6,128.0, 127.8, 127.5, 122.7, 63.6
以三甲基-1-苯乙烯基硅醚和各种取代苯磺酰肼作为起始底物, 碘(I2)为催化剂, 叔丁基过氧化氢(TBHP)为氧化剂, 其反应式如Scheme 1所示.
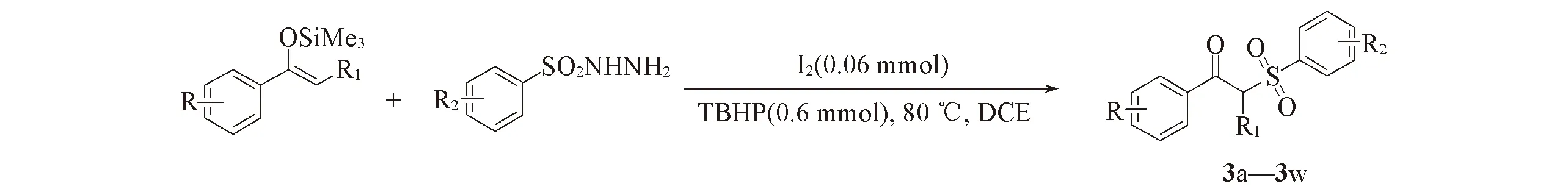
Scheme 1 Synthesis of compounds 3a—3w with I2 as catalyst and TBHP as oxidant R=CH3, F, Cl, Br, CF3, NO2, naphthyl, thienyl, furyl; R1=H, CH3; R2=H, CH3, CH3O, F, Cl, CF3, naphthyl.
以三甲基-1-苯乙烯基硅醚(1a)与对甲基苯磺酰肼(2a)作为模板反应进行条件筛选(表3). 加入20%KI作为催化剂, 0.45 mmol 叔丁基过氧化氢(TBHP)作为氧化剂, 在乙腈(CH3CN)中于80 ℃反应, 以25%的收率得到了目标产物α-磺酰基酮(3a). 对I2, NaI和TBAI等碘催化剂进行了筛选, 实验结果表明, 碘单质具有最佳的催化效果(表3中Entries 1~4). 对甲基苯磺酰肼(2a)的用量进行筛选发现, 当其用量增加到0.6 mmol时, 效果最好, 产物3a收率增加至55%(表3中Entries 5和6). 对各种不同极性的有机溶剂如四氢呋喃(THF)、 1,4-二氧六环、N,N-二甲基甲酰胺(DMF)、 1,2-二氯乙烷(DCE)和甲苯(toluene)分别进行筛选, 对比结果显示, 1,2-二氯乙烷(DCE)是最合适的反应介质, 产物3a的收率为66%(表3中Entries 7~11). 对不同类型的自由基引发剂进行了筛选. 结果表明, 以五氧化二碘(I2O5)为自由基引发剂[22], 以过硫酸钾(K2S2O8)或二叔丁基过氧化物(DTBP)为氧化剂时, 均未检测到目标产物; 而以过氧化苯甲酰叔丁酯(TBPB)为引发剂时, 以44%的收率获得产物3a(表3中Entries 12~15). 上述结果表明, 叔丁基过氧化氢(TBHP)是一种更合适的自由基氧化剂. 无论是增加叔丁基过氧化氢(TBHP)用量至0.9 mmol或者在惰性氛围下进行反应, 都不能进一步提高反应收率, 表明氧气的存在对该反应无影响(表2中Entries 16和17).
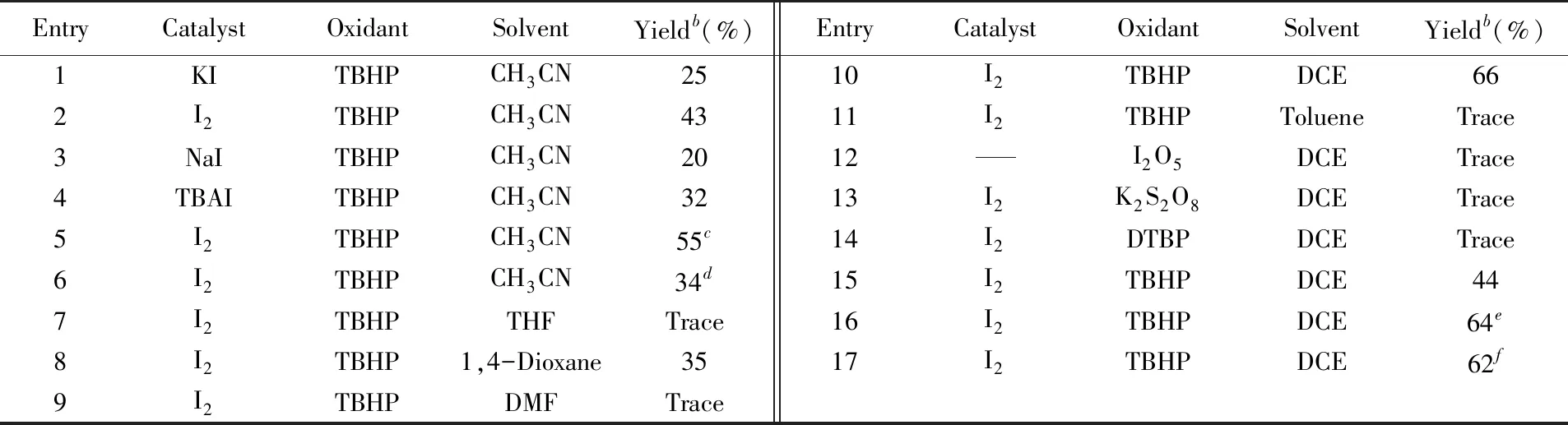
Table 3 Optimization of reaction conditionsa
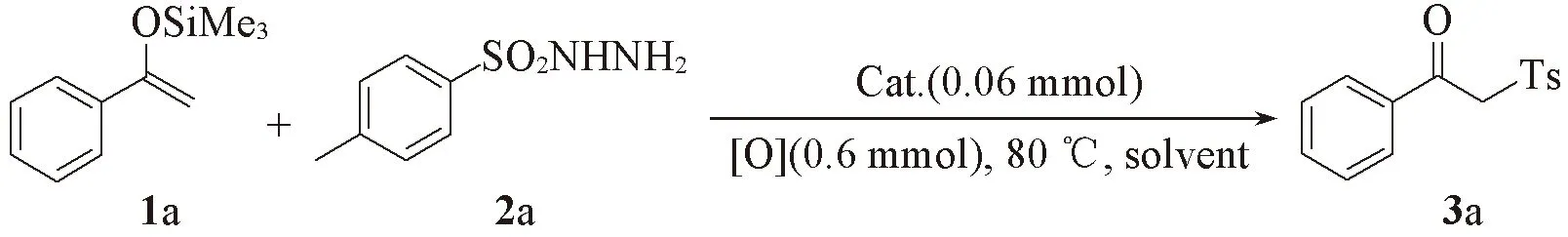
2.2 底物的拓展
在确定的最佳反应条件下, 考察了不同取代的烯醇硅醚结构对反应的影响. 由Scheme 2可见, 在优化条件下, 含有烷基(化合物3b,3h,3j)、 卤素(化合物3c~3e,3i)、 三氟甲基(化合物3f)和硝基(化合物3g)等不同类型取代基的烯醇硅醚均可顺利与对甲基苯磺酰肼发生磺酰化反应得到目标产物, 产率大多为中等到良好. 在芳环对位取代时, 吸电子基团表现出更高的反应活性; 而在间位和邻位取代时, 供电子基团活性明显高于吸电子基团, 其中邻氯取代的烯醇硅醚未检测到目标产物, 可能发生脱卤反应[16]. 此外, 萘、 杂原子和苯丙酮衍生的烯醇硅醚也能顺利发生反应, 以中等收率获得终产物3l~3o.
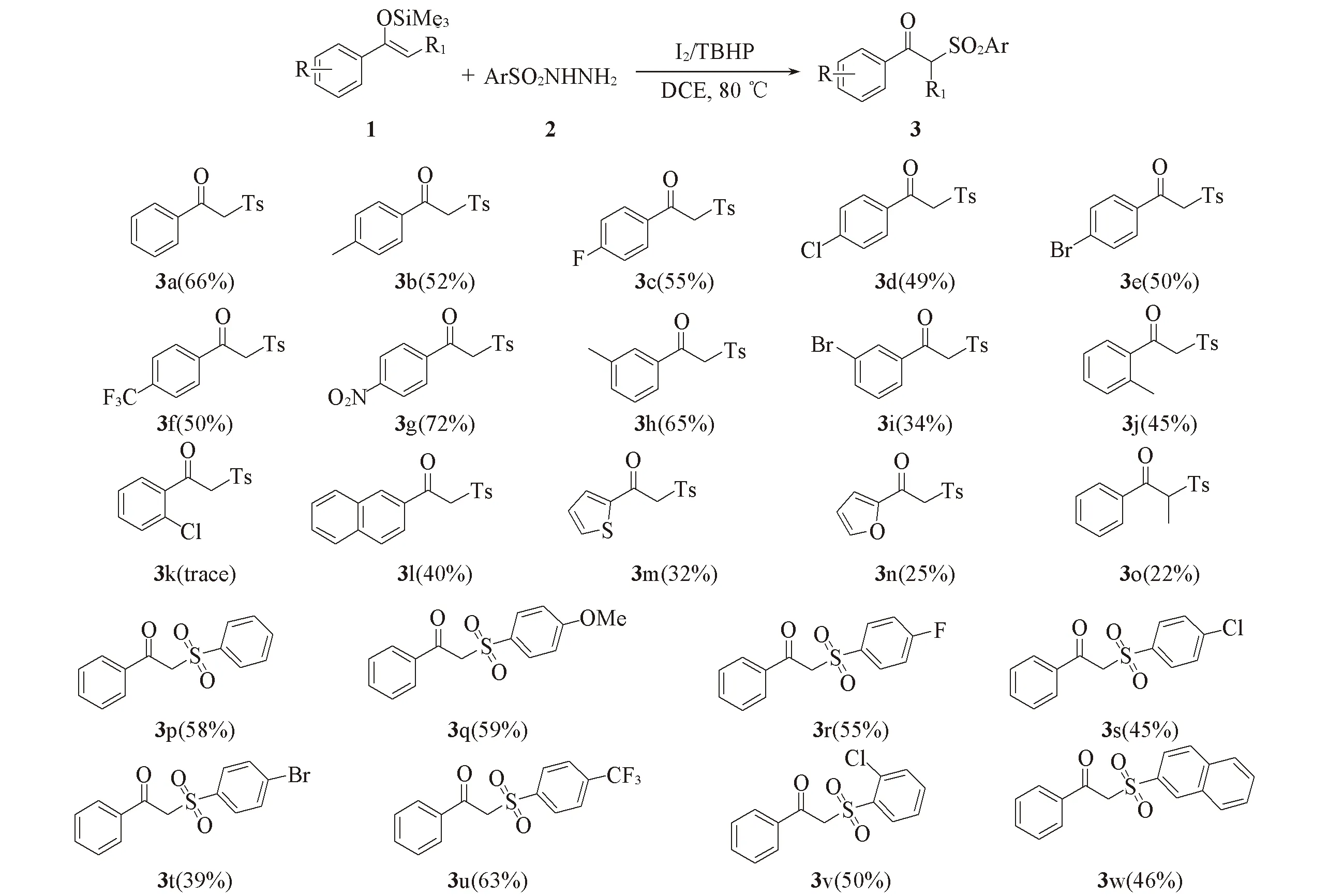
Scheme 2 Substrate scope of enoxysilanes and sulfonylhydrazides Reaction conditions: 0.3 mmol of compound 1, 0.6 mmol of compound 2, 0.06 mmol of I2, 0.6 mmol of TBHP and 2.0 mL of DCE at 80 ℃ for 8 h; data of isolated yield is based on compound 1.
对不同的磺酰肼衍生物参与的合成反应进行了研究. 结果表明, 无论芳环上的取代基是供电子基团(化合物3p,3q)还是吸电子基团(化合物3r~3v), 均能顺利得到目标产物, 收率中等. 实验还发现, 萘基衍生的磺酰肼也适用于此体系, 以46%收率分离到终产物3w.

Scheme 3 Preliminary mechanistic study
为了研究可能的反应机理, 在最佳反应条件下进行了自由基抑制实验. 由Scheme 3可见, 当在反应体系中加入0.6 mmol自由基抑制剂TEMPO(2,2,6,6-tetramethylpiperidine-1-oxyl)或BHT(2,6-di-tertbutyl-4-methylphenol)时, 反应被抑制, 未检测到目标产物, 说明反应可能按照自由基机理进行.
根据上述实验结果和文献[24~27]报道, 提出如下自由基反应历程(见Scheme 4): 首先在碘单质作用下, 叔丁基过氧化氢(TBHP)分解为叔丁基氧自由基或叔丁基过氧自由基; 随后逐步攫取磺酰肼中氮原子上的质子, 发生脱氮气反应生成活泼的磺酰基自由基; 进一步对烯醇硅醚中的碳碳双键发生自由基加成反应生成活泼的中间体(Ⅰ), 中间体Ⅰ发生氧化反应生成碳正离子(Ⅱ), 最后脱去Me3SiI得到最终产物.
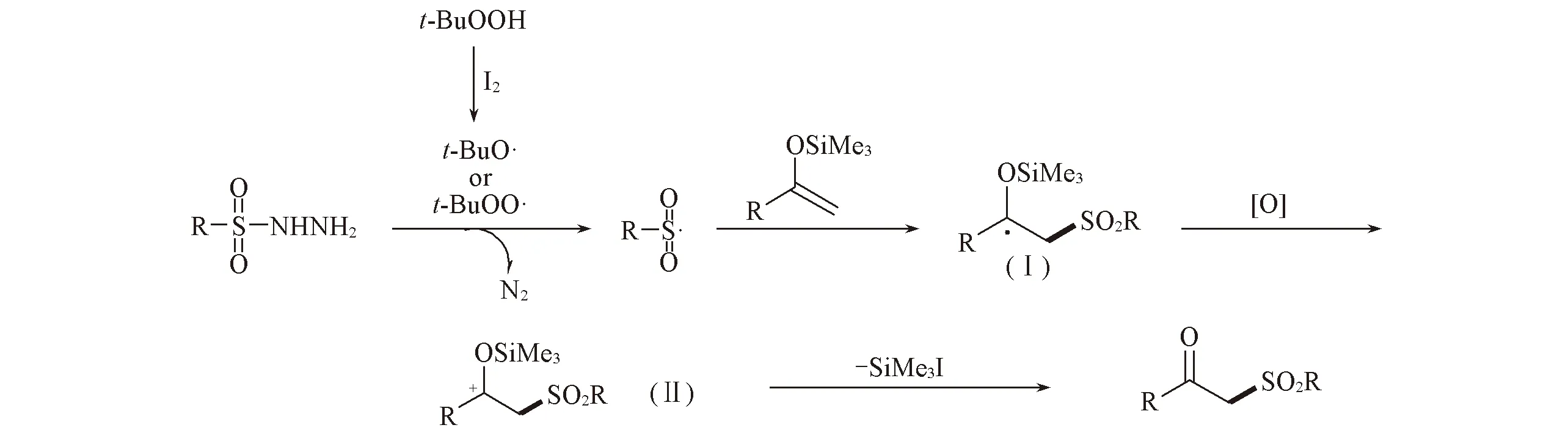
Scheme 4 Proposed preliminary mechanisms
3 结 论
建立了一种无金属条件下用烯醇硅醚和磺酰肼发生自由基偶联反应合成α-磺酰基酮的方法. 该反应条件简单, 官能团兼容性好, 以中等到良好的收率获得一系列α-磺酰基酮化合物. 该反应利用廉价易得的碘为催化剂且副产物为分子氮气, 绿色环保.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20190424.
