无机-有机杂化化合物[(H2DABCO)CuCl4]·H2O的合成及开关型介电性质
2020-01-15秦刘磊关小琴郑晓媛张子钰刘尊奇
秦刘磊, 刘 洋, 关小琴, 郑晓媛, 张子钰, 刘尊奇
(新疆农业大学化学工程学院, 乌鲁木齐 830052)
无机-有机杂化化合物具有多样的空间结构、 优良的物理性质和良好的固态电性能, 如铁电和介电特性[1~10], 因此在信息储存、 信号处理、 电子器件和可逆介电设备等方面具有广泛应用前景[11~15]. 含N杂环化合物具有丰富的配位模式和强配位能力, 可与过渡金属离子配位得到具有铁电和相变性质的功能材料[16~20]. 利用过渡金属离子与有机含N配体进行分子组装是设计合成新型无机-有机杂化功能材料的重要方向[21~25]. 通过引入无序基元(易发生无序的含氮有机小分子)来合成无机-有机杂化型化合物, 在集成电路器件应用和晶体学理论研究等方面有重要意义[26~30].
Xiong等[31]合成了一种结构新颖的铁电相变化合物[(Cu-HDABCO)(H2O)Cl3](DABCO=1,4-二氮杂二环[2.2.2]辛烷), 该化合物在235 K时发生了从顺电相(Pnam)到铁电相(Pna21)的转变. 研究机理显示, 有机分子DABCO从低温到室温的有序-无序化运动导致化合物正负中心不重合, 产生了偶极矩, 这是铁电相产生的主要诱因. 该材料为合成分子转子型铁电体及设计多功能电子器件提供了新的思路. 在此基础上, 我们以极易发生无序的DABCO分子、 二水合氯化铜、 盐酸为原料合成了一种新型的无机-有机杂化型介电化合物[(H2DABCO)CuCl4]·H2O(1). 利用单晶X射线衍射测定化合物1的结构, 通过红外光谱(IR)、 元素分析、 X射线粉末衍射(XRD)、 热重分析(TG)和变温-变频介电常数测试对其组成及介电性质进行了表征.
1 实验部分
1.1 试剂与仪器
1,4-二氮杂二环[2.2.2]辛烷(DABCO, 日本TCI公司)、 CuCl2·2H2O、 盐酸(质量分数36.5%)和甲醇(天津市致远化学试剂有限公司). 所用试剂均为分析纯.
FTIR 8700型红外光谱仪(日本岛津公司); Bruker SMART APEX Ⅱ型单晶X射线衍射仪(德国Bruker公司); Q50型热重分析仪(美国TA公司); TH2828A型介电性能测试仪(常州同惠公司); AXS D8 ADVANCE型X射线粉末衍射仪(德国Bruker公司); Vario El Cube型元素分析仪器(德国Elementar公司).
1.2 化合物1的合成

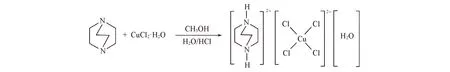
Scheme 1 Synthesis of compound 1
1.3 化合物1的晶体结构测定
选取尺寸为0.13 mm×0.12 mm×0.11 mm的晶体, 置于Bruker SMART APEX Ⅱ型单晶X射线衍射仪上, 采用石墨单色化的MoKα辐射源(λ=0.071073 nm), 分别在低温(100 K) 和室温(294 K)下收集衍射数据. 晶体结构采用直接法解析, 非氢原子使用SHELXL-97晶体解析软件进行各向异性修正, 结构内的氢原子位置通过几何构型确定. 表1列出了化合物1的晶体学参数.
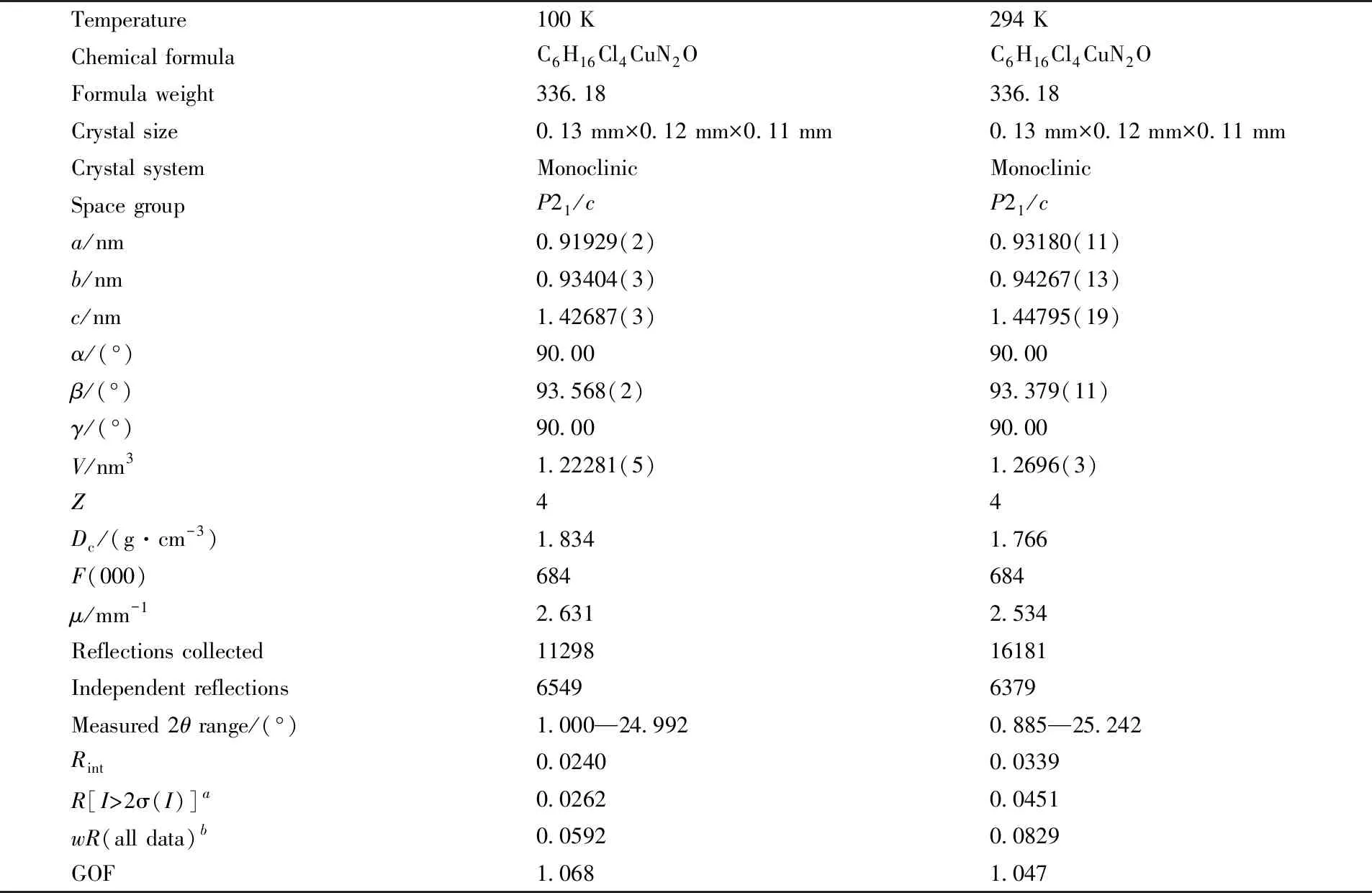
Table 1 Single crystal X-ray data of compound 1
a.R=∑(|Fo|-|Fc|)/∑|Fo|;b.wR=[∑w(|Fo|2-|Fc|2)2/∑w(Fo2)]1/2.
2 结果与讨论
2.1 化合物1的晶体结构
变温单晶X射线衍射测试结果表明, 在低温(100 K)和室温(294 K)下化合物1均结晶于中心对称的P21/c空间群, 属单斜晶系. 低温(100 K)下的晶胞参数:a=0.91929(2) nm,b=0.93404(3) nm,c=1.42687(3) nm,α=90.00°,β=93.568(2)°,γ=90.00°,V=1.22281(5) nm3. 室温(294 K)下的晶胞参数:a=0.93180(11) nm,b=0.94267(13) nm,c=1.44795(19) nm,α=90.00°,β=93.379(11)°,γ=90.00°,V=1.2696(3) nm3. 由以上数据可以看出, 随着温度变化, 化合物1的空间群虽然没有改变, 但是晶胞参数(表1)发生了变化, 说明化合物1在一定温度范围内存在同结构相变. 化合物1的不对称单元包括1个双边质子化的[H2DABCO]2+阳离子, 1个四面体型[CuCl4]2-阴离子和1个游离态水分子. 由图1可见, 铜离子与4个氯离子形成一个扭曲的四面体结构, 低温时四面体中Cu—Cl键长范围为0.2231 ~0.2285 nm, 平均键长0.2252 nm, Cl—Cu—Cl键角范围在95.38°~101.14°, 平均键角为98.73°(表2); 室温时Cu—Cl键长范围为0.2239~0.2294 nm, 平均键长为0.2260 nm, Cl—Cu—Cl键角范围为95.46°~100.94°, 平均键角为98.82°(表3). 通过键长和键角数据可以看出, 低温到室温四面体型[CuCl4]2-阴离子产生了伸缩变形.

Fig.1 Molecular structures of compound 1 at low temperature(A) and room temperature(B)

Table 2 Selected bond lengths(nm) and bond angles(°) of compound 1 at 100 K
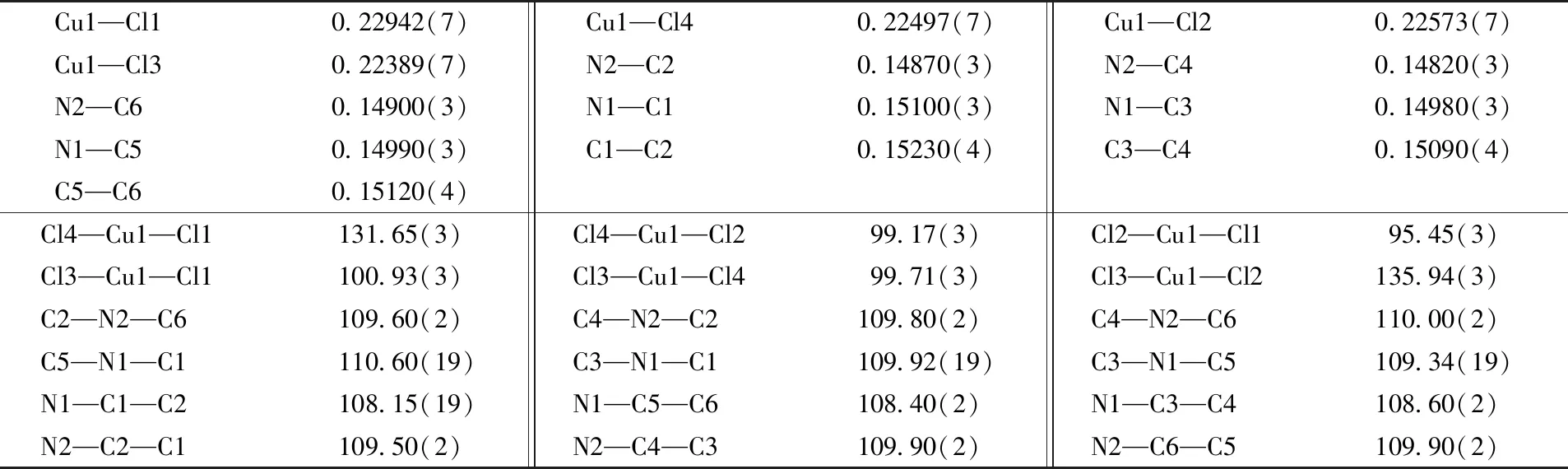
Table 3 Selected bond lengths(nm) and bond angles(°) of compound 1 at 294 K
如图2所示, 化合物1在b轴方向, 2个相邻的[H2DABCO]2+阳离子共用氧原子, 与O1通过氢键相连形成2个N2—H…O1氢键, 低温时氢键长度分别为0.3051 nm, 0.2753 nm[图2(A)], 其平均键长为0.2902 nm, H…O1的平均距离为0.2146 nm(表4); 室温时2个N2—H…O1氢键长度分别为0.3132, 0.2776 nm[图2(B)], 其平均键长为0.2954 nm, H…O1的平均距离为0.2194 nm(表5). 水分子的O1原子与四面体结构[CuCl4]2-上的Cl1形成O1—H…Cl1氢键, 低温和室温下的键长分别为0.3152和 0.3187 nm. 2个相邻的水分子形成O1—H…O1氢键, 低温和室温下的键长分别为0.3020和0.3053 nm. 通过氢键键长分析可知, 化合物1在混合溶液内通过不同形式的氢键自组装形成晶体. 在由低温升至室温的过程中, 水分子和[H2DABCO]2+阳离子形成的氢键键长变化明显, 而2个水分子之间的氢键键长变化较弱, 因此在一定程度上也影响晶体晶胞参数的变化.
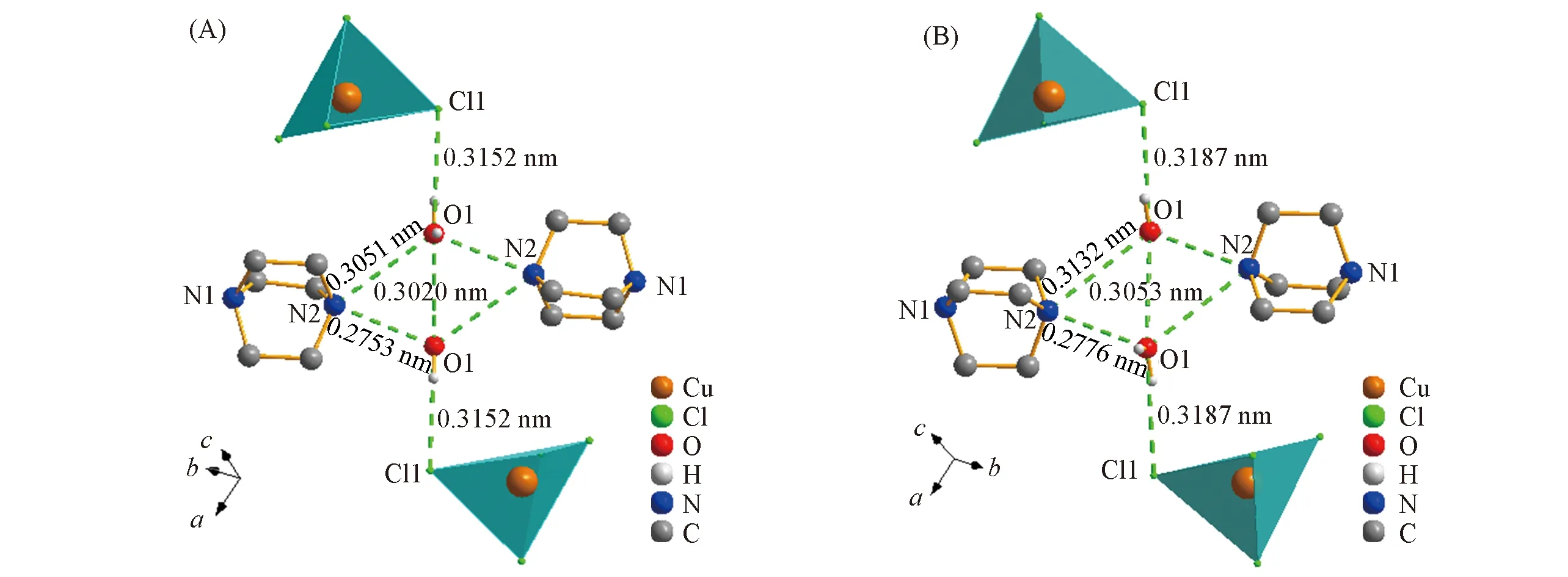
Fig.2 Hydrogen-bond structure of compound 1 at low temperature(A) and room temperature(B)

Table 4 Partial hydrogen bond data of compound 1 at 100 K
Symmetry codes:i.x,y,z;j. -x,y+1/2, -z+1/2;k. -x, -y, -z.

Table 5 Partial hydrogen bond data of compound1 at 294 K
Symmetry codes:i.x,y,z;j. -x,y+1/2, -z+1/2;k. -x, -y, -z.
进一步分析结构显示, 化合物1通过[H2DABCO]2+阳离子上的N2与水分子O1形成N2—H2…O1氢键, O1与四面体[CuCl4]2-上的Cl1, Cl2, Cl4形成O1—H1D…Cl1, O1—H1C…Cl2, O1—H1C…Cl4氢键, N1与Cl1, Cl2形成N1—H1…Cl1, N1—H1…Cl2氢键. 通过这6个氢键的相互作用在bc平面上形成二维网状结构(图3). 相邻的4个[CuCl4]2-阴离子以4个铜离子为顶点在空间内形成近似矩形的空穴. 在bc平面内随着温度的改变, 低温下形成尺寸为0.7150 nm×0.9340 nm的矩形空穴, 室温下形成尺寸为0.7255 nm×0.9428 nm的矩形空穴(图3). 在不同温度下相邻铜离子的距离发生明显的改变, 显示其结构中呈现明显的伸缩振动变化. 同时[H2DABCO]2+阳离子和游离的水分子可通过N—H…O, O—H…Cl氢键相连, 镶嵌在矩形空穴内. 随着矩形空间的伸缩振动, 氢键距离也随之变化, 引起相应的结构及电性能改变.
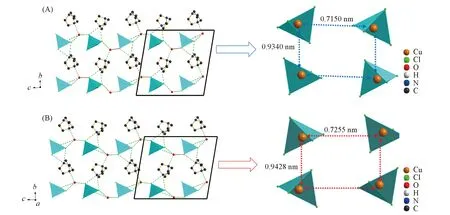
Fig.3 Arrangement diagram of compound 1 in the same direction at low temperature(A) and room temperature(B)
2.2 化合物1的红外光谱
通过KBr压片法, 在4000~400 cm-1的范围内对二水合氯化铜、 1,4-二氮杂二环[2.2.2]辛烷和化合物1进行红外光谱测试, 测试结果如图4所示. 化合物1的各振动峰归属如下: 3475 cm-1处为H2O的—O—H基团伸缩振动峰, 3419和1611 cm-1处为—N+—H基团伸缩振动峰, 1054 cm-1处为—C—N—基团伸缩振动峰, 3063和646 cm-1处分别为O—H…Cl氢键的伸缩振动和弯曲振动峰.
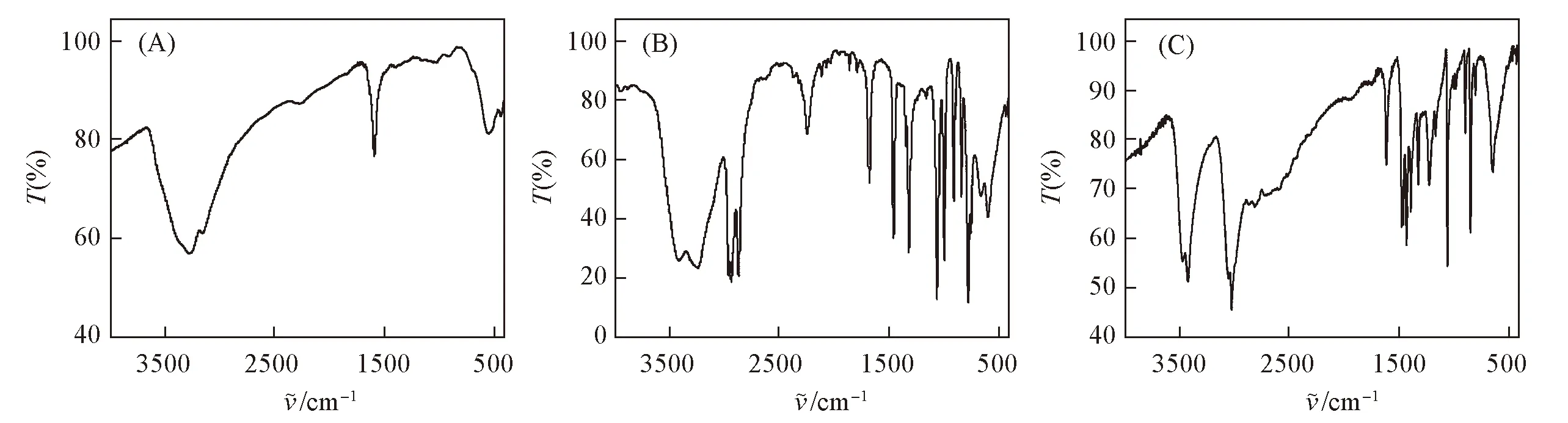
Fig.4 IR spectra of Copper(Ⅱ)chloride dihydrate(A), 1,4-diazabicyclo[2.2.2] octane(B) and compound 1(C)
2.3 化合物1的XRD和热重分析
通过室温溶液蒸发法获得相关晶体, 其纯度及晶体单一性将会影响到该类化合物的热性能及电性能. 通过粉末X射线衍射仪对30 mg化合物1进行XRD测试, 图5谱线a为化合物1在室温(294 K)下测试XRD谱, 图5谱线b为根据室温下的单晶结构模拟的XRD数据. 可以看出测试谱与模拟谱的峰位置基本一致, 表明化合物1为单一纯相, 且所测试单晶结构数据真实可靠.
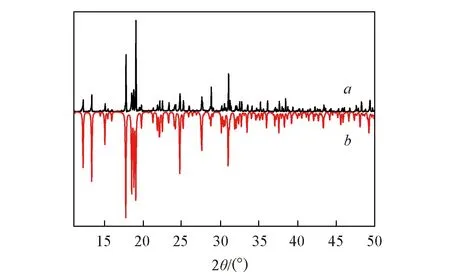
Fig.5 XRD pattern collected from powder of compound 1(a) and XRD pattern simulated from single crystal of compound 1(b)
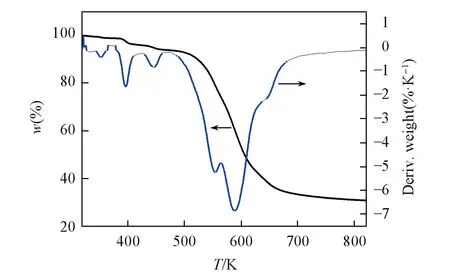
Fig.6 TG-DTA curves for compound 1
在氮气保护下, 于温度范围300~810 K内, 以10 K/min的升温速度对化合物1进行TG和DTA测试. 如图6所示, 化合物1在320 K附近开始失重, 同时DTA曲线出现吸热峰, 说明化合物1中存在溶剂分子(水分子). 化合物1的质量损失可以分为3个阶段: 第一阶段从320 K到470 K, 在此过程中TG曲线明显下降, DTA曲线在352, 395, 445 K处连续出现3个小的的吸热峰, 是由化合物1结构中与相邻的[H2DABCO]2+阳离子和四面体型[CuCl4]2-阴离子形成氢键的水分子的失去所致, 该阶段失重率为5.99%, 与化合物1中的游离水分子理论失重率5.35%相吻合; 第二阶段从480 K到590 K, 在此过程中DTA曲线在554 K出现1个明显的吸热峰, 失重率为34.64%, 这与化合物1中[H2DABCO]2+阳离子理论失重率33.37%基本相同; 第三阶段从600 K到750 K, 为四面体型[CuCl4]2-阴离子分解过程, 同时DTA曲线在588和651 K处出现2个吸热峰. 当温度高于800 K时, 化合物1不再继续分解.

Fig.7 Anisotropic dielectric constants of compound 1 along a-(A), b-(B), c-axes(C) from 100 K to 260 K at 5 kHz—1 MHz up heating and variation of hydrogen bond distance in ac-plane(D)
2.4 化合物1的介电性质
前面的研究结果显示随着温度升高, 该晶体的晶胞参数、 构筑模块空穴以及氢键都随之改变或伸缩, 这将导致晶体微观原子及分子的移动, 从而伴随某些物理性质的异常. 选取大小合适的晶体, 通过单晶X射线衍射仪确定晶体的a,b,c3个轴向, 沿3个晶体轴分别通过银胶将晶体与铜丝相连接形成电容器, 对3个轴向进行变温-变频介电常数测试. 图7(A)~(C)为化合物1的a轴、b轴和c轴方向在温度为100~260 K, 频率为5 kHz~1 MHz范围内的升温介电常数曲线图. 由图7(A)和(C)可见, 化合物1在a轴和c轴方向于180 K附近出现了明显的阶梯状介电异常峰, 而在b轴方向于205 K左右出现明显介电异常峰, 从3个轴向的介电常数变化可以判断该晶体为各向异性晶体材料. 化合物1从100 K到170 K的升温过程中, 各频率范围内介电常数都没有观察到明显的变化, 均保持稳定, 但随着温度超过170 K, 在180 K附近介电常数发生响应, 180~240 K出现阶梯状异常峰, 240 K以后介电常数数值又迅速升高. 结果显示化合物1在变温过程中由低温相的低介电态转换为室温的高介电态, 其介电常数变温曲线存在明显的高低两种状态, 呈现阶梯状开关型变换模式, 表明化合物1为介电开关型材料. 通过晶体结构分析推测明显的介电异常来自于bc平面内铜离子所形成的的空穴伸缩变化及氢键参数改变[图7(D)].
3 结 论
以DABCO、 二水合氯化铜和盐酸为原料, 在甲醇和水的混合溶剂中以摩尔比1∶1∶1蒸发结晶获得了新颖的无机-有机杂化型介电化合物[(H2DABCO)CuCl4]·H2O(1). 通过单晶X射线衍射确认化合物1为单斜晶系, 空间群为P21/c, 晶胞参数在变温过程中发生明显变化, 说明为同结构相变. 在bc平面上, 通过N—H…O, O—H…Cl等氢键相互作用, 形成二维网状结构. 在该平面内铜离子空穴间距离的伸缩变化引起了化合物1在a,c轴方向于180 K附近出现介电常数阶梯状异常峰, 在b轴方向于205 K左右出现介电异常, 介电测试数据在3个晶轴方向呈现显著各向异性. 化合物1是一种新颖的介电开关型可调控晶体材料, 可为超分子器件和可调性开关的设计提供参考.
