梨孢镰刀菌对麦芽挥发性风味物质的影响
2020-01-15耿宇凤刘泷泽徐献兵
董 亮 耿宇凤 * 刘泷泽 陈 炎 柴 多 徐献兵 秦 磊
(1 大连工业大学食品学院 辽宁大连 116034
2 国家海洋食品工程技术研究中心 辽宁大连 116034)
麦芽是大麦成熟种子发芽干燥后的产品,是啤酒生产过程中的中间产品,其风味构成直接影响啤酒的风味[1]。研究表明,制麦过程中外源微生物尤其是镰刀菌属微生物对成品麦芽的理化品质及风味均有显著影响[2-3]。Justé等[2]认为制麦过程由2个复杂的代谢系统组成,一是大麦种子发芽生长的代谢作用;另一个是制麦过程中微生物对绿麦芽的侵染代谢作用。制麦过程外源微生物对麦芽的影响具有双面性,从总体上来看负面影响大于正面影响。正面影响为微生物可以分泌一定量的水解酶,包括淀粉酶、蛋白酶以及纤维素酶等。其中,β-葡聚糖酶的活力占总酶活的50%以上。同时,微生物还可以产生一定量的植物生长激素,如赤霉素等[4]。制麦过程中外源微生物对麦芽质量的负面影响主要有以下几点:使谷物在贮藏过程中产生霉变;产生真菌毒素[5];产生细菌多糖,使糖化后的麦汁过滤困难;诱发发酵过程酵母提前絮凝[6];造成啤酒产生喷涌现象[7]。
为探讨镰刀菌属微生物对麦芽风味的影响,在前期研究中本课题组综合评价了禾古镰刀菌对麦芽挥发性化合物的影响,发现微生物对制麦过程麦芽嗅感风味的影响方式主要体现在以下两点:一是其可能带入源自微生物菌体自身的新的嗅感风味物质;二是其可能改变麦芽原有嗅感风味物质的含量,或者二者兼而有之[8]。为进一步评价镰刀菌属微生物对麦芽风味的影响,本文选择有大量文献报道的、对麦芽质量有重大影响的梨孢镰刀菌作为考察对象,分析其自身的嗅感风味物质构成,探讨其在制麦过程中对麦芽嗅感风味的影响及其对麦芽风味物质含量组成的影响。
1 材料与方法
1.1 材料与试剂
加麦:Metacalfe,由中粮麦芽大连有限公司馈赠。
梨孢镰刀菌(Fusarium poae),从大麦表面分离并由实验室保藏。
气相色谱标准品:乙醛、异丁醛、异戊醛、2-甲基丁醛、正己醛、糠醛、正庚醛、正辛醛、反辛烯醛、壬醛、异丁醇、环戊醇、异戊醇、正戊醇、正己醇、2,3-丁二酮、2,3-戊二酮、2-庚酮、正庚酮、甲基庚烯酮、乙酸、己酸、正庚酸、乙酸乙酯、苯甲醛、2-戊基呋喃、苯乙醛,以上标准品均为色谱纯级;无水乙醚及无水Na2SO4为分析纯级,以上试剂均购自大连北疆化学仪器有限公司。
1.2 仪器与设备
固相微萃取装置、DVB-CAR-PDMS(涂层厚度50/30μm)萃取头,美国Supelco公司;Agilent 7890A-5975C气质联用色谱仪,美国安捷伦公司;HH-8型水浴锅,国华电器有限公司;FA1004A型分析天平,上海精天科贸有限公司。
1.3 试验方法
1.3.1 培养基的配制
1.3.1.1 PDA培养基(g/100mL) 马铃薯 20,葡萄糖2,琼脂粉2。
1.3.1.2 肉汤培养基(g/100mL) 牛肉膏0.5,蛋白胨1,氯化钠0.5。
1.3.2 梨孢镰刀菌的培养及破碎 采用PDA培养基固体培养。将梨孢镰刀菌以划线法接种于平皿中。接种后28℃下培养,培养至3 d和5 d时分别收集各自菌体。收集菌体时使用三角耙轻轻地将培养基上的菌体刮下,收集菌体于-4℃冰箱保存备用。
菌体破碎采用液氮研磨法。将收集的菌丝体倒入研钵内加入一定量的液氮,在低温下研磨3次,收集菌体,置于-4℃冰箱保存备用。
1.3.3 制麦工艺 称取大麦200 g,用自来水清洗去除表面污垢,再用3%的次氯酸钠浸泡10min去除大麦表面微生物,后用无菌水反复清洗,直至大麦无异味为止。浸麦阶段采用浸4断8工艺(共48 h)。浸麦阶段试验组加入含有萌发好的梨孢镰刀菌孢子液200mL,对照组加入200mL无菌水,充分混匀。发芽阶段16℃下培养144 h,湿度控制为90%。发芽期间,每12 h翻一次麦,对照组喷洒无菌水,试验组喷洒孢子液以保持发芽大麦表面湿润。每培养24 h取样40 g,取样后置于-20℃冰箱中保存。
1.3.4 菌体及菌体内溶物嗅感物质的定性分析1.3.4.1 SPEM预处理 精确称量收集后的菌体或菌体破碎物3.0 g装入20mL萃取瓶中,用聚四氟乙烯衬里的硅橡胶垫密封,然后加入20%NaCl 2 mL混合均匀后,置于(18±1)℃恒温水浴锅平衡30min,插入装有纤维头的手动SPME进样器进行采样吸附60min,采样完毕立即进入气相色谱仪,在250℃解吸5min进行GC-MS分析[9]。
1.3.4.2 嗅感物质的GC-MS检测分析
1)色谱条件:30m×0.25mm×0.25μm HP-5MS弹性石英毛细管柱;载气He气,流速2mL/min;进样口以及检测器温度250℃;程序升温起始温度40℃,保持5min,以2℃/min升至50℃,后以5℃/min升至250℃。
2)质谱条件:EI源电子轰击能量70 eV;离子源温度230℃;扫描间隔0.25 s;四极杆150℃;扫描范围40~400 u。
3)化合物的定性:化合物结构采用计算机Nist 08谱库检索、色谱保留指数、人工解析比对鉴定[10]。
1.3.5 制麦过程嗅感物质的定性分析
1.3.5.1 SPME预处理 试验条件同1.3.4.1。
1.3.5.2 嗅感物质的GC-MS检测分析 试验条件同1.3.4.2。
1.3.6 制麦过程嗅感物质的定量分析 采用外标法对各化合物进行定量分析[11],具体方法参考文献[12]。
2 结果与分析
2.1 梨孢镰刀菌菌体风味的测定
为了更好地反映出挥发性物质的来源,将梨孢镰刀菌不同培养时期的菌体进行破碎,比较菌体内外挥发物的区别。挥发性成分的总离子流色谱图见图1。
2.2 梨孢镰刀菌对麦芽风味影响方式
由表1可知,整个培养期内、在菌体及菌体内部共检测出43种挥发性物质,其中前期检测出35种挥发物,稳定期检测出21种挥发物,这些挥发物主要由9碳及其以下碳链的醇、酮以及芳香族类物质所构成,同时还有一些有机酸类和烯烃类化合物。比较不同培养阶段的挥发物质组成可以看出,大部分的醛、酮以及有机酸类挥发物产生于菌体培养早期,而培养后期菌体则释放出一些烯烃类物质,如:3-乙基-2-甲基-1,3-己二烯;而一些菌体特征挥发物的含量则明显高于培养早期,如:异戊醇、1-辛烯-3-醇、3-辛酮等。
从培养后期的菌体破碎结果来看,在菌体破碎物中可以检测到绝大部分挥发性物质,说明在培养晚期、菌体挥发物主要来源于胞内,此时菌体细胞代谢缓慢,代谢物多为分子组成复杂的次生代谢产物。

图1 梨孢镰刀菌菌体挥发性物质的总离子流色谱图Fig.1 Total ion current chromatogram in the analysis of volatiles of Fusarium poae
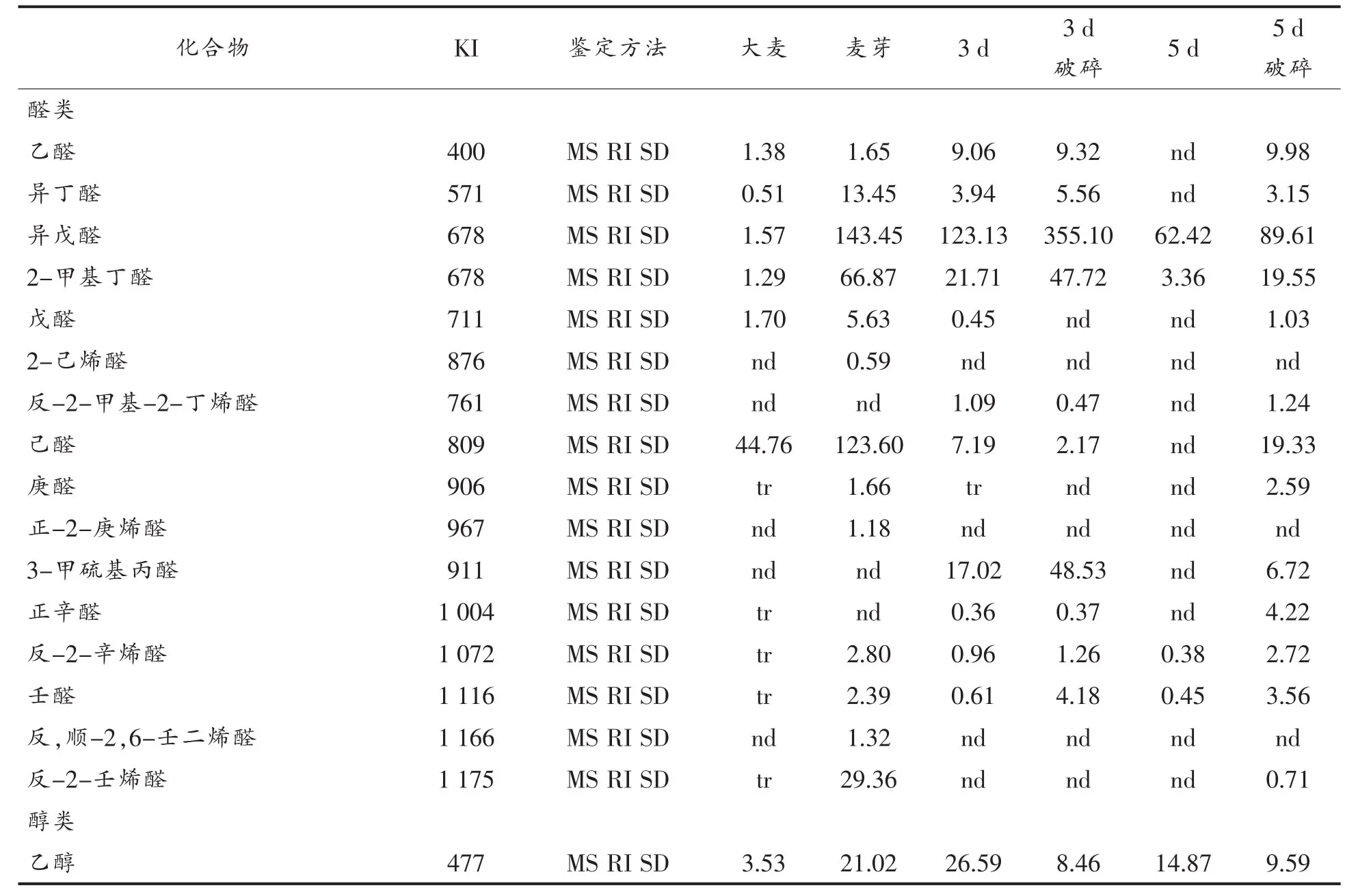
表1 原料大麦、成品麦芽与梨孢镰刀菌菌体挥发性物质鉴定结果Table1 Analysis of volatile compounds emitted from raw material barley,finished and Fusarium poae

(续表1)
比较不同培养阶段的菌体及破碎后菌体内溶物挥发物的组成发现,破碎后,2-甲基丁醛、异戊醛、3-甲硫基-丙醛、壬醛、苯甲醛、苯乙醛及甲硫基环己烷等挥发物的含量均明显高于破碎前,说明这些物质主要来源于菌体内部。而破碎后,乙醇、异丁醇、异戊醇、1-辛烯-3-醇和3-辛酮等挥发物的含量则明显低于破碎前,说明这些物质主要来自于菌体外部。菌体破碎前、后,其它挥发物的含量变化不大。正戊醇、正己醇和苯乙醇只在培养后期未破碎的菌体中检出,反-2-壬烯醛、3,5-辛二烯-2-酮及乙基苯只在培养后期破碎的菌体中检出,并且这些挥发物的含量都相对较低。
上述结果表明,从数量上看梨孢镰刀菌的挥发物中占原料大麦所检出挥发物的60%以上,占麦芽挥发物总量的87.5%,基本覆盖大部分大麦品种所鉴定出的挥发物成分。从而得知梨孢镰刀菌对麦芽风味的影响方式是改变麦芽原有嗅感风味物质的含量,而不是带入源自梨孢镰刀菌体自身的新的嗅感风味物质。
2.3 制麦过程中梨孢镰刀菌对麦芽风味含量的影响
制麦过程中梨孢镰刀菌对麦芽醛类、醇类、酮类、有机酸类以及其它类嗅感物质含量均有影响,然而,对醛类嗅感物质的影响最大,故本文只对梨孢镰刀菌对制麦过程中醛类嗅感物质含量的影响作分析,含量变化见图2。
由图2可以看出:在制麦结束时,浸染梨孢镰刀菌绿麦芽中的大部分醛类挥发物的含量均低于正常制麦条件下绿麦芽中醛类物质的含量。因此,在制麦过程中梨孢镰刀菌抑制了醛类挥发物质的生成。虽然在发芽开始时及在发芽过程中,梨孢镰刀菌对麦芽中醛类嗅感风味物质的影响并无规律,但在发芽结束时与对照组(正常制麦条件)麦芽中醛类含量相比较,可以看出梨孢镰刀菌对绿麦芽中醛类物质的生成有抑制作用。
由图2a所示,发芽结束时,对照组乙醛含量为2 321μg/100g DW,而此时侵染梨孢镰刀菌试验组的乙醛含量仅为1 162μg/100g DW,相对于对照组乙醛含量下降了50%。由图2b可知,在制麦过程中,侵染梨孢镰刀菌对绿麦芽中异丁醛生成的抑制作用较大,发芽结束时其含量为41.3mg/100g DW,相对于对照组异丁醛含量下降了50.6%。
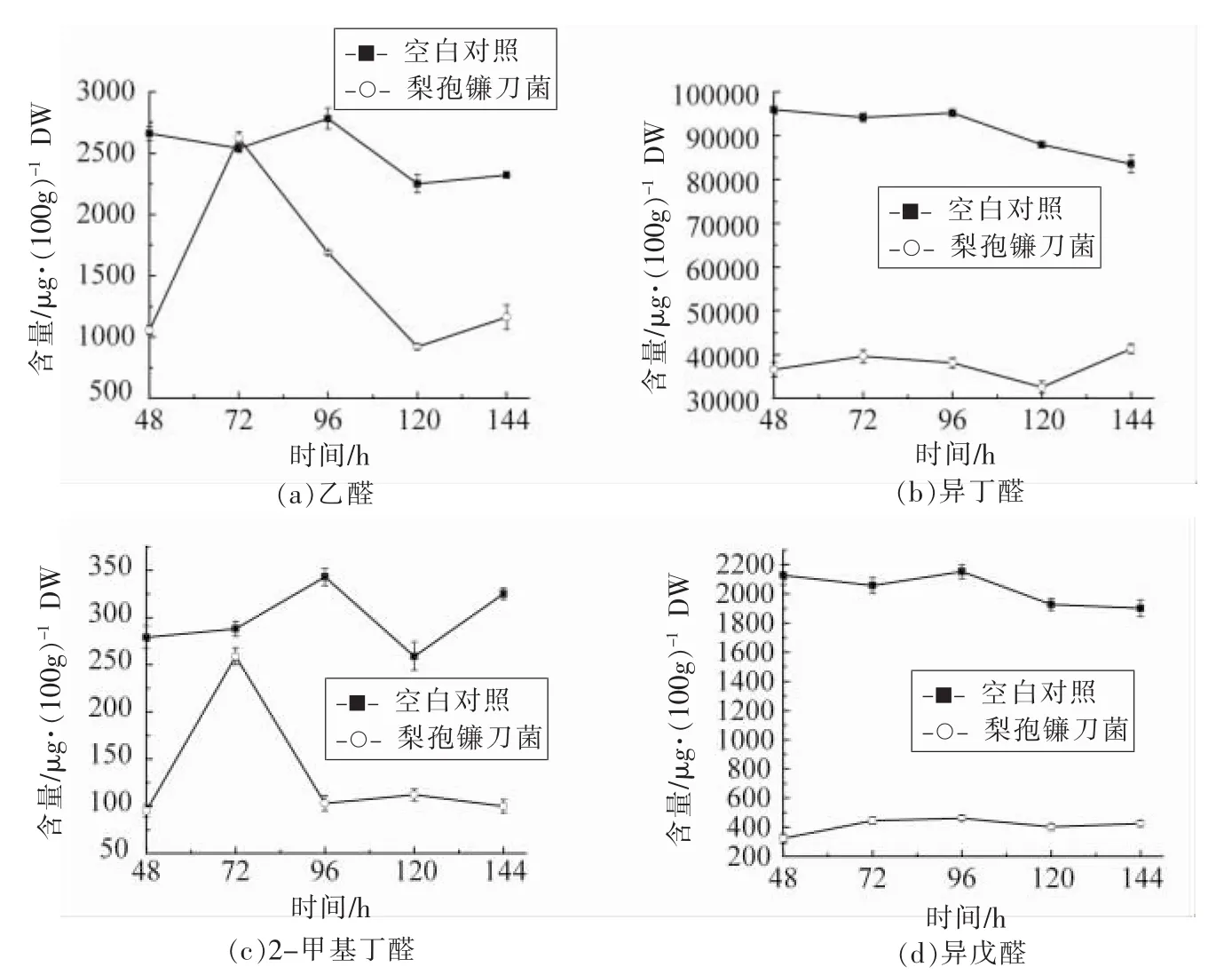

图2 制麦过程中梨孢镰刀菌对醛类嗅感物质的影响Fig.2 Effects of Fusarium poae aldehydes during malting process
从图2c,2d可以看出,梨孢镰刀菌对2-甲基丁醛和异戊醛含量的影响同样较大。至发芽结束时,正常发芽条件下绿麦芽中2-甲基丁醛和异戊醛的含量分别为325μg/100g DW和1902μg/100g DW;浸染梨孢镰刀菌的绿麦芽中2-甲基丁醛的含量为100μg/100g DW。发芽结束时,浸染梨孢镰刀菌的绿麦芽中异戊醛的含量为427μg/100g DW,仅为正常发芽下异戊醛含量的22.4%。
正己醛是麦芽风味的重要组成物质[12]。由图2e所示,至发芽结束时,正常发芽条件下,麦芽中正己醛的含量为2 148μg/100g DW,而梨孢镰刀菌侵染组正己醛含量为1 079μg/100g DW。
从图2f可知,在发芽过程中,梨孢镰刀菌对正辛醛的生成表现为一定的抑制作用。虽然在发芽前期,侵染梨孢镰刀菌的绿麦芽正辛醛的含量高于正常发芽对照组,但在发芽过程后期,它对正辛醛的生成有很大的抑制作用。至发芽结束时,试验组的正辛醛含量为220μg/100g DW,正常发芽对照组为562μg/100g DW。在发芽结束时,梨孢镰刀菌组的正辛醛含量仅为正常发芽时的39.1%。
如图2g所示,在发芽过程中,梨孢镰刀菌试验组反-2-辛烯醛的含量波动较大。从图2h可以看出,梨孢镰刀菌对壬醛的生成也表现出抑制作用。至发芽结束时,正常发芽组绿麦芽中的壬醛含量为92μg/100g DW,侵染梨孢镰刀菌的壬醛含量为61μg/100g DW。侵染组壬醛的含量为对照组的60%左右。
综上,造成上述现象的原因是在制麦后期,梨饱镰刀菌大量的繁殖消耗了麦层中大量的氧气,使绿麦芽处于缺氧状态下进行厌氧呼吸,产生了大量的有机酸,从而导致其生理代谢降低,抑制了醛类风味代谢物的产生。
3 结论
本文应用固相微萃取-气质联用技术(SPEM/GC-MS)分析鉴定了梨孢镰刀菌在不同培养时期自身所产生的嗅感物质的构成,并测定了被梨孢镰刀菌浸染后麦芽风味物质的含量。结果表明:梨孢镰刀菌对麦芽风味的影响方式是改变麦芽原有嗅感风味物质的含量,而不是带入源自梨孢镰刀菌体自身的新的嗅感风味物质。其自身产生的挥发性物质可以基本覆盖大部分大麦品种所能够鉴定出的挥发性成分,对麦芽风味的形成和积累均产生一定影响。
