斑点叉尾鮰致病菌株的分离鉴定与药敏特性
2020-01-14姚俊杰商宝娣李小义张效平
陶 莎, 姚俊杰, 商宝娣, 李小义, 张效平*
(1.贵州大学 渔业资源与环境研究中心, 贵州 贵阳 550025; 2.贵州省农业科学院 水产研究所, 贵州 贵阳 550025)
斑点叉尾鮰(Ietaluruspunetatus)是一种大型淡水鱼类,原产于北美洲,属脊索动物门(Chordata)硬骨鱼纲(Osteichthyes)鲶形目(Siluriformes)鮰科(Ictaluridae),其具有生长快、食性杂、抗病力强和肉质上乘等优点,是我国重要的水产经济鱼类之一[1]。由于养殖集约化程度的不断提高,使得斑点叉尾鮰的细菌病、病毒病及寄生虫病的发生越来越频繁,由细菌引起的疾病则是其中危害最严重的一类。目前,已从患不同病的斑点叉尾鮰中分离到嗜麦芽寡养单胞菌(Stenotrophomonasmaltophilia)[2]、嗜水气单胞菌(Aeromonashydrophila)[3-4]、鲁氏耶尔森氏菌(YersiniaRuckeri)[5]、中间气单胞菌(Aeromonasmedia)[6]和海豚链球菌(Streptococcusiniae)[7]等病原菌。2019年3月,贵州省锦屏县某养殖场养殖斑点叉尾鮰发生强传染性病害,导致大量斑点叉尾鮰死亡。为此,从发病病鱼中分离出1株高致病性的致病菌Q1,通过细菌生化微量鉴定管鉴定、16S rDNA序列测定和系统发育分析方法对该菌进行分类鉴定,并测定其对45种常用抗菌药物的敏感性,以期为生产上由该菌引起的斑点叉尾鮰病害防治提供科学依据。
1材料与方法
1.1材料
1.1.1试验鱼体长为15~20 cm的自然发病斑点叉尾鮰,采自贵州省锦屏县某养殖场;人工回归感染试验所用的15~20 cm健康斑点叉尾鮰,采自贵州省遵义市绥阳县风华镇鱼子孔养殖基地。
1.1.2试剂LB培养基、水解酪蛋白琼脂板(MH)、LB营养肉汤、细菌生化微量鉴定管和药敏纸片,购自杭州微生物试剂有限公司;细菌基因组DNA提取试剂盒,上海生物工程有限公司;PCR相关制品,TaKaRa Bio公司。
1.2方法
1.2.1发病症状观察现场观察病鱼的摄食情况和行为特点等,将病鱼放入白色的搪瓷盘中,检查病鱼体表病变、腹部肿大和肛门肿胀等情况;解剖后观察其肝、肾和肠等器官的病变反应。
1.2.2病原菌的分离与纯化选取患有典型病状的斑点叉尾鮰,用75 %酒精擦拭病鱼全身,在无菌条件下解剖,取其肝脏和肾脏的病灶组织,划线接种于LB培养基上,28℃恒温培养箱中培养24 h后,选取在培养基上数量较多、形态颜色一致的单菌落进行划线纯化培养,28℃恒温培养箱中培养24 h后,观察记录菌落的大小、形态及颜色等形态特征;参照文献[8]的方法,对Q1菌株进行革兰氏染色等24项生理特性的检测;挑取纯化后的单菌落置于营养肉汤中,28℃摇床培养18 h后,加入50%甘油混匀,-80℃保存备用。
1.2.3回归感染试验无菌条件下,取保存于-80℃的Q1菌株划线接种于LB平板上,28℃培养24 h后,用无菌PBS缓冲液将LB平板上的菌落冲洗于无菌EP管中,反复冲洗3次后,按麦氏比浊法将菌液浓度配制成1×109cfu/mL,并进行10倍梯度稀释,分别得到浓度为1×108cfu/mL、1×107cfu/mL、1×106cfu/mL和1×105cfu/mL的菌液;健康斑点叉尾鮰暂养1周后随机按每组30尾分成6个组,每组为1个处理,设1个对照(CK),共计6个处理:处理1,0.5 mL 1×109cfu/mL;处理2,0.5 mL 1×108cfu/mL;处理3,0.5 mL 1×107cfu/mL;处理4,0.5 mL 1×106cfu/mL;处理5,0.5 mL 1×105cfu/mL;CK,0.5 mL 0.65%灭菌PBS溶液;各处理均采用腹腔注射法,3次重复。试验水温为15~18℃;连续观察7 d,记录死亡情况,并计算1周后的死亡率与半数致死浓度(LD50)。同时取人工感染濒死斑点叉尾鮰肝脏和肾脏病灶进行细菌的再分离培养与鉴定。
1.2.4分子鉴定及序列分析Q1菌株接种于营养肉汤中,28℃摇床培养18 h,11 000 r/min离心1 min收集菌体,按细菌基因组DNA提取试剂盒说明提取细菌总DNA,作为PCR的模板DNA;试验引物为细菌16S rDNA通用引物:27F: 5′-AGAGTTTGATC(C/A)TGGCTCAG-3′,1492R: 5′-GGTTACCTTGTTACGACTT-3′;PCR反应扩增体系总体积50 μL,包括去离子水(ddH2O)37.5 μL,10× buffer 5 μL,dNTP 4 μL,Ex Taq 0.5 μL,上下游引物各1 μL(20 μg/L),模板DNA 1 μL(浓度80 μg/L);PCR扩增条件:94℃预变性5 min;94℃变性45 s,55℃退火45 s,72℃延伸90 s,35个循环;最后再于72℃延伸10 min。
采用1.2%琼脂糖凝胶电泳检测PCR产物的目的条带,而后送样进行PCR产物测序,得出结果利用SeqMan和Bio Edit等进行分析,并与GenBank收录的其他细菌的16S rDNA基因序列进行相似性对比,利用MEGA 6.0计算各序列间的相对遗传距离,并通过邻接法(Neighbor joining,NJ)构建系统发育树,系统树各分支的置信度由Bootstrap 1000循环检验给出。
1.2.5抗菌药物敏感试验Q1菌株接种于营养肉汤中,28℃摇床培养18 h后,吸取500 μL菌液,均匀涂于MH培养基中,待菌液吸收后,无菌条件下,采用纸片扩散法(K-B法),将45种药敏纸片均匀贴于培养基中,每种抗菌药物3次重复,相同形状的灭菌滤纸片作为对照(CK),置于28℃恒温培养箱中培养24 h后测量抑菌圈直径。
1.3数据处理
采用Excel 2010和SPSS 13.0对数据进行处理与分析。
2结果与分析
2.1病鱼症状
患病鱼游动缓慢,离群或靠边独游,体表呈褪色斑,直至发生溃疡;食欲减退,甚至丧失;鳍条边缘发白,基部、下颌和腹部等部位充血或出血;肛门红肿、外凸,严重时有脱肛现象;解剖可见淡黄色或含血腹水;胃肠道无食物,肠道发生异常蠕动或痉挛,部分鱼后肠出现1~2个肠套叠;肝脏肿大变色,胆囊扩张,部分鱼鳔充血或出血。
2.2菌株形态及生理生化特征
Q1菌株经28℃恒温培养24 h后呈不透明的微隆起,淡黄色圆形,边缘整齐,表面光滑,直径0.8~1.2 mm;经革兰氏染色显示为革兰氏阴性菌,短杆状。从表1看出,Q1菌株甲基红为阳性、V-P试验和硫化氢为阴性,均与鲁氏耶尔森氏菌一致;赖氨酸Q1菌株为阳性,鲁氏耶尔森氏菌阳性反应超过24 h;果糖和蜜二糖Q1菌株为阳性,鲁氏耶尔森氏菌为阴性;其余项目Q1菌株的特征与鲁氏耶尔森氏菌一致。
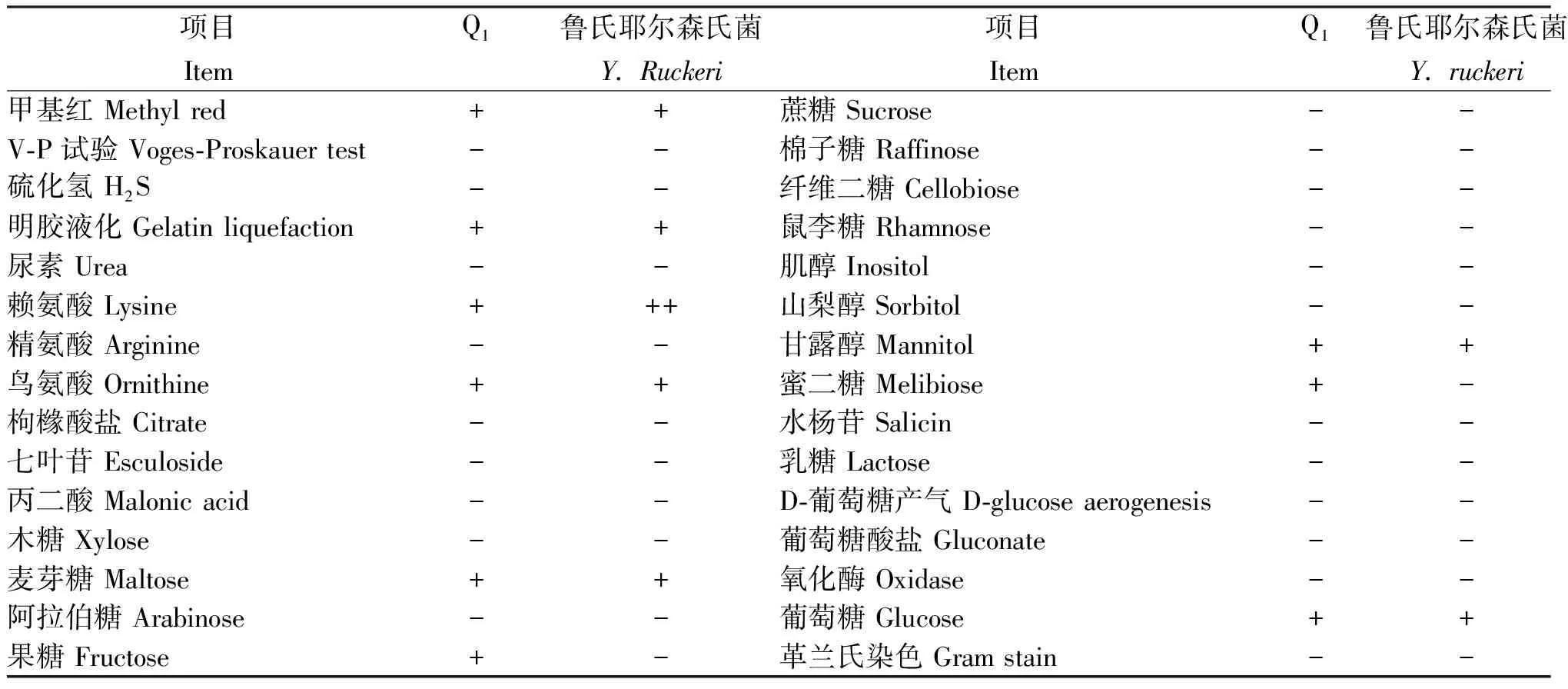
表1 Q1菌株与鲁氏耶尔森氏标准菌株的生理生化特征
注:+表示阳性,-表示阴性,++表示阳性反应超过24 h。
Note:+, Positive; -, Negative; ++, The time of positive reaction exceeds 24 h.
2.3回归感染试验
经人工回归感染的斑点叉尾鮰观察发现,濒死鱼游动缓慢,单独离群,体表有出血点,解剖腹腔有少许腹水,肠道与胃中充满液体(图1a、b),有肠套叠和肠结节等症状(图1c、e),肾脏肿大(图1d、f),部分鱼肠道和鳔出现充血或出血症状(图1g),与自然发病的斑点叉尾鮰病变相似。从人工感染死亡鱼的肝脏和肾脏组织分离到与Q1菌株形态、生理生化特性、16S rDNA序列分析一致的细菌,表明Q1菌株是2019年3月贵州省锦屏县某养殖场养殖斑点叉尾鮰发生的强传染性病害的病原菌。
从表2看出,健康斑点叉尾鮰在接种Q1菌株感染不同时间后的死亡数变化。1~2 d:随着接种Q1菌株浓度的降低,斑点叉尾鮰的死亡数呈下降趋势,1 d时处理1死亡21尾,处理4死亡2尾,处理5和CK无死亡;2 d时处理1死亡6尾,处理4死亡1尾,处理5和CK无死亡;3~4 d:处理1~4斑点叉尾鮰的死亡数无规律性,处理5和CK无死亡;5~7 d:所有处理斑点叉尾鮰均未死亡。1周时死亡率,处理1死亡率最高,为100%;处理2其次,为70%;处理5和CK为0;菌株Q1对斑点叉尾鮰的半数致死浓度为1.05×107cfu/mL。
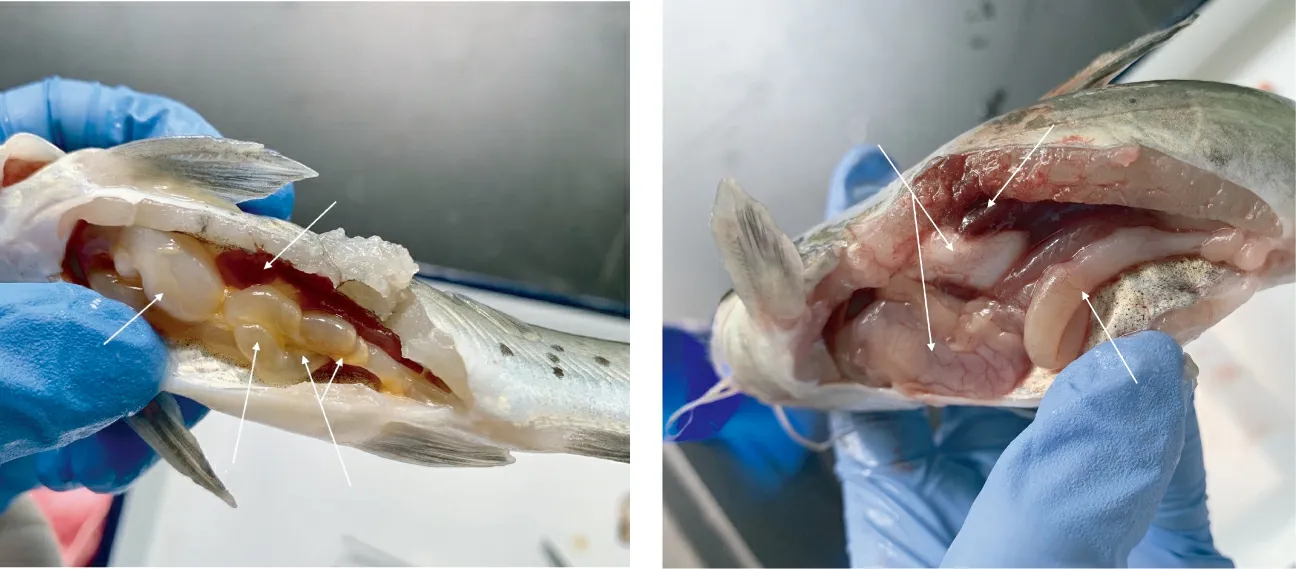
注:a、b为胃与肠道中充满液体,c为肠套叠,d为鱼鳔充血,e为肠道结节;a~d病鱼感染时菌液浓度为1×107cfu/mL,e~g病鱼感染时菌液浓度为1×109cfu/mL。
Note:a and b, fluid-filled stomach and intestinal; c, indigitation; d, bloodshot bladder; e, intestinal nodules; a-d, the fish infected with Q1strain with 1×107cfu/mL; e-g, the fish infected with Q1strain with 1×109cfu/mL.
图1回归感染斑点叉尾鮰的症状
Fig.1 Symptoms ofI.punetatusinfected with Q1strain

表2Q1菌株对斑点叉尾鮰感染试验
2.4PCR扩增与序列分析
从图2看出,Q1菌株的16S rDNA序列区通过PCR扩增,产物经1.2 %琼脂糖凝胶电泳,得到1条长度约1 400 bp的目的产物;与GenBank中已有的16S rDNA序列进行同源性对比显示,Q1菌株的16S rDNA序列与已有的鲁氏耶尔森氏菌同源性达99%以上,通过MEGA6.0邻接法建立的系统发育树(图3)显示,Q1菌株与鲁氏耶尔森氏菌(MK396587.1、AB681666.1、HQ222844.1、FJ908709.1)聚为一支,置信度为86,确定致病菌Q1为鲁氏耶尔森氏菌,其GenBank登录号为MN709091。

M:DL-2000 Marker;1.Q1菌株。
M:DL-2000 Marker;1.Q1strain.
图2Q1菌株的16S rDNA区 PCR扩增结果
Fig.2 PCR amplified results of 16S rDNA of Q1strain
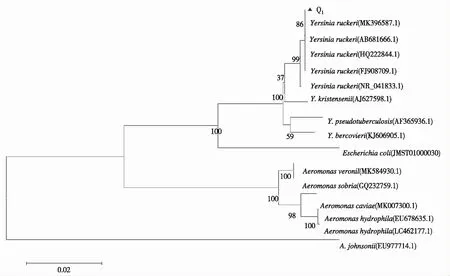
图3Q1菌株的16S rDNA基因序列构建的系统发育树
Fig.3 Phylogenetic dendrogram of Q1strain based on 16S rDNA gene sequence
2.5药物敏感性
从表3可知,Q1菌株对庆大霉素、链霉素和大观霉素等17种药物为高度敏感,对阿奇霉素、头孢克肟和新生霉素等6种抗菌药物为中度敏感;对克拉霉素、红霉素和麦迪霉素等等22种抗菌药物耐药。且Q1菌株对选用的氨基糖苷类、四环素类和喹诺酮类3种类型的抗菌药物全部敏感,因此,此次贵州省锦屏县某养殖场养殖斑点叉尾鮰发生的强传染性病害可优先选用氨基糖苷类、四环素类和喹诺酮类抗菌药物进行治疗。
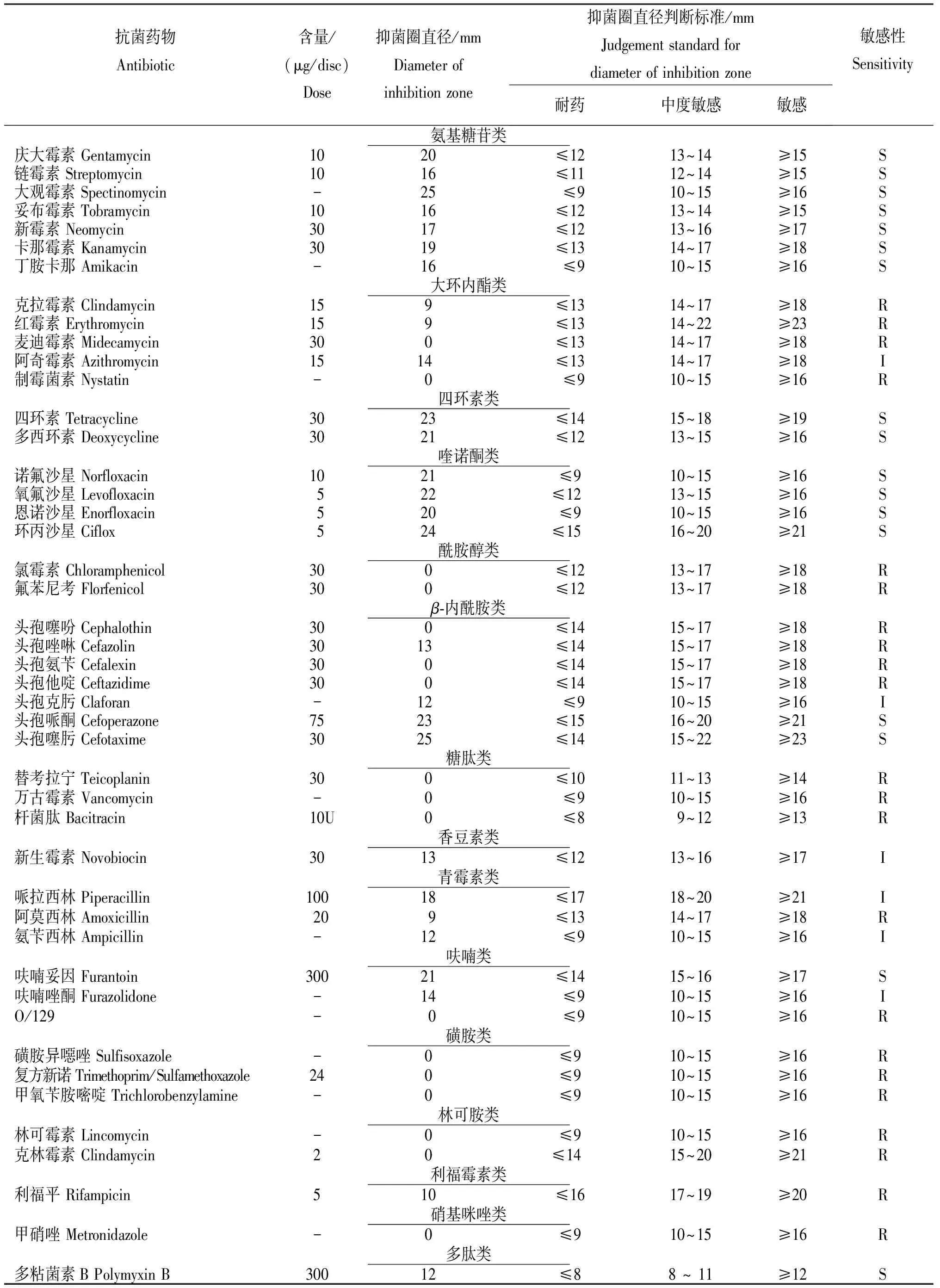
表3 Q1菌株对不同药物的敏感性
注:R为耐药;I为中度敏成;S为敏。
Note:R indicates resistance to antibiotic agent;I indicates medium sensitivity to antibiotic agent;S indicates sensitivity to antibiotic agent.
3结论与讨论
鲁氏耶尔森氏菌(Yersiniaruckeri)为肠杆菌科(Eenterobacteriaceae)耶尔森氏菌属(Yersinia)兼性厌氧革兰氏阴性菌。自20世纪 50年代,鲁氏耶尔森氏菌在美国人工养殖的虹鳟中首次发现[9],大量研究表明,鲁氏耶尔森氏菌对鱼类具有广泛的致病性。我国已发现的易感品种包括斑点叉尾鮰[5]、鲟、金鱼、鳗、罗非鱼[10]、虹鳟[11]和鲢鳙[12]等,其感染的宿主范围不断扩大。感染鲁氏耶尔森氏菌不同种病鱼之间存在一些相同症状,如,嘴部出血、肠道肿胀发炎、内脏器官充血或出血、泄殖腔充血外凸等[5-7,9-11]。研究结果表明,患病斑点叉尾鮰也存在类似表征;但不同种鱼之间由鲁氏耶尔森氏菌引起的症状也存在差异,如,河北患病的施氏鲟其心脏呈花斑状[10],解剖由鲁氏耶尔森氏菌致病的斑点叉尾鮰发现,胃内充满大量浓稠的白色粘液[5]。该研究中,解剖由鲁氏耶尔森氏菌致病的斑点叉尾鮰发现,肠道发生异常蠕动和痉挛,部分鱼后肠出现1~2个肠套叠的现象,鱼鳔充血或出血等异于其他患病鱼的症状,由同种细菌引起的病鱼不同症状可能与鱼类不同种属、不同水域及鱼类自身的特性有关。
研究结果表明,同一批经人工回复感染后的斑点叉尾鮰可能存在不同的发病症状,有内脏不充血,肠道与胃内充满液体,出现肠套叠,肾脏轻微红肿等症状;有肠道和鱼鳔等器官充血明显,肾脏严重红肿等症状。这可能是由于回复感染时所使用的菌液浓度不同以及鱼体自身免疫系统的差异引起的。
通过生理生化特性鉴定和分子遗传学鉴定2种方法对斑点叉尾鮰的病原菌进行鉴定,避免了因1种方法试验误差等造成鉴定结果不准确[13]。研究结果表明,在生理生化指标中,分离到的Q1菌株在赖氨酸、果糖和蜜二糖3个指标上与鲁氏耶尔森氏菌标准菌株存在差异,其余指标均与标准株一致;并且分离株的16S rDNA序列与鲁氏耶尔森氏菌同源性达99%以上。因此,结合2种鉴定方法结果,确定该菌为鲁氏耶尔森氏菌。
研究结果表明,Q1菌株对45种常见抗菌药物的敏感性结果与其他学者的研究略有所不同。如,范方玲等[5]在斑点叉尾鮰病鱼中发现,鲁氏耶尔森氏菌对氯霉素敏感,对庆大霉素、妥布霉素、新霉素和多粘菌素B耐药;而Q1菌株对氯霉素耐药,对庆大霉素、妥布霉素、新霉素和多粘菌素B敏感;连浩淼[11]在虹鳟病鱼中发现,鲁氏耶尔森氏菌对复方新诺明敏感,Q1菌株对其耐药;杨昆明等[13]在西伯利亚鲟病鱼中发现,鲁氏耶尔森氏菌对氟苯尼考和头孢他啶敏感,Q1菌株对其耐药等。产生药敏特性差异的原因可能是因为宿主种类、水域、药敏片剂量、养殖模式和地区用药习惯等有关。这也得到提醒,在防治细菌性疾病时,首先要通过药敏试验,准确筛选出有效抗菌药物是防治该病的关键。Q1菌株对庆大霉素、链霉素和大观霉素等17种药物高度敏感,且对选用的氨基糖苷类、四环素类和喹诺酮类3种类型的抗菌药物全部敏感,所以在药物选择上可优先选用氨基糖苷类、四环素类和喹诺酮类抗菌药物进行治疗。研究结果为贵州地区养殖斑点叉尾鮰感染鲁氏耶尔森氏菌的防治提供了科学依据,并且通过不同种类有效抗菌药物的交替使用,还可延缓致病菌耐药性的产生。
