基质水活度对冠突散囊菌生物转化茶叶成分的影响
2020-01-14刘斌杰严蒸蒸吴志超黄鹭强杨民和
刘斌杰, 严蒸蒸, 谭 咏, 吴志超, 黄鹭强, 杨民和
(福建师范大学 生命科学学院, 福建福州 350107)
“发花”是茯砖茶加工过程中特有的工序,其实质是以冠突散囊菌(Eurotiumcristatum)为主的多种散囊菌属真菌以茶叶为基质的固态发酵过程。发花过程中,真菌在茶叶中旺盛生长,呈现黄色或金黄色菌丝体,俗称“金花菌”[1-2]。包装后的茶叶产品储放于干燥的库房中陈化至少半年以上,促进“金花菌”的大量发生,并以“金花菌”的数量和旺盛程度作为茯砖茶发酵成功与否和质量好坏的标准[3]。适合的发花条件下,真菌利用茶叶作为有机质充分生长,产生和分泌水解酶转化茶叶成分,产生丰富的转化产物,与菌体成分混合共同形成茯砖茶特有的品质和风味,表现有益的生理功能[3-5]。
水活度(Water activity, aw)是指在一定的温度和压力下基质(Substrate)蒸汽压和纯水蒸汽压的比值,用于衡量培养基质中可以被微生物利用的水分含量或自由水[6-7]。水活度这一概念在食品和饲料行业中使用较为常见,在一些纤维质材料如书籍、文物和标本的保藏方面也有着广泛的应用[8]。在实验室研究中,常用甘油、NaCl和蔗糖作为溶质来调节培养基的水活度[ 6, 8-9],以考察微生物对不同水活度(或干燥程度)的反应。一般来说,溶质的浓度越高,渗透压越大,配制成的培养基水活度越低,可利用水分越少。
大量的研究表明,基质水活度或环境干燥程度是影响微生物生长、代谢和繁殖的重要生态因素[10]。如基质水活度能明显影响真菌的生长[6-7, 10]、基因表达[11]、蛋白(或水解酶)分泌[5, 11]和毒素产生[9],因而影响真菌对环境中有机质和能量的利用,决定其生态竞争能力。散囊菌属的真菌大都是嗜高渗透压的微生物,在低水活度的基质中才能正常生长[5, 10]。环境条件如温度、渗透压和水活度是限制冠突散囊菌菌丝生长、分生孢子发芽和无性孢子、有性孢子分化的重要因素[1, 10-11],但冠突散囊菌如何适应茶叶这类特殊基质和茶叶加工过程中的高温而发展成优势真菌,目前还不清楚。为了解基质水活度对冠突散囊菌生长和茶叶成分转化作用的影响,笔者等以甘油调节培养基的水活度,以绿茶粉为主要成分设计简化的培养条件,研究不同水活度条件下冠突散囊菌菌株(FZ-2)对茶叶主要成分代谢的影响;并采用顶空固相微萃取技术(HS-SPME)和气相色谱-质谱(GC-MS)分析相结合,分析水活度对真菌发酵后茶叶香气成分的影响,以期为茯砖茶加工生产和质量提升提供理论依据。
1材料与方法
1.1试验材料
菌株:冠突散囊菌(FZ-2),分离自茯砖茶(湖南益阳茶厂,2008年5月9日生产)。供试菌株生长于DG18培养基[8]斜面上,于4℃冰箱保存在福建师范大学生命科学学院微生物实验室。
仪器:PawKit便携式水活度仪(美国Decagon公司),恒温培养箱(上海一恒公司),高压灭菌锅(日本HIRAYAMA有限公司),STARTER2100 pH计(美国奥豪斯有限公司),微萃取装置(50/30 μmDVB/CAR/PDMS,美国supelco公司)。
试剂:蛋白胨、无水葡萄糖、KH2PO4、无水MgSO4,西陇科学有限公司;琼脂(金燕海洋生物有限公司),甘油(飞扬化工有限公司),绿茶粉(安徽省亳州市淳兴堂药业有限公司,2017年6月10日生产)。
1.2方法
1.2.1培养基的配制
1) 改良DG18培养基。在DG18培养基的基础上去除氯硝胺。培养基配方为:蛋白胨5.0 g/L,无水葡萄糖10.0 g/L,KH2PO41.0 g/L, 无水MgSO40.5 g/L,琼脂20 g/L,甘油180.0 g/L。
2) 液体发酵培养基。在改良DG18培养基的基础上去除琼脂和葡萄糖,甘油作为唯一的碳源,添加不同比例的甘油(不添加甘油的培养基以添加葡萄糖为碳源)。采用PawKit便携式水活度仪检测水分活度(aw),调节培养基的aw分别为0.99、0.95和0.83。配制完成后,每个三角瓶分装量为100 mL,配制好的培养基于115℃高压灭菌30 min。
3) 绿茶粉-甘油培养液。称取5 g绿茶粉用1 000 mL沸水溶解,经过滤后,添加不同浓度的甘油,调节培养基的水活度分别为0.99、0.95和0.83,配制完成后,每个三角瓶分装量为100 mL,灭菌。
1.2.2试验设计菌株FZ-2培养于DG18培养基,于28℃恒温培养5~7 d后收集分生孢子。配制浓度为5.0×107~6.0×107个孢子/mL的孢子悬浮液。将菌株FZ-2的孢子悬浮液分别以1%的比例接种于不同水活度的绿茶粉-甘油培养液中进行发酵,每处理设置3个重复,置于摇床28℃、200 r/min下培养10 d后过滤去除菌丝体,取发酵液测定总可溶性糖、氨基酸和茶多酚的含量。
1.2.3生物量的测定取液体发酵培养基中培养5 d后的培养液用布氏漏斗过滤,收集菌体,并用预冷的蒸馏水冲洗菌体3遍,洗去附着于菌体上的甘油。在烘箱内充分干燥菌体至恒重,测量其干重即为菌体生物量,每个样品测3次取平均值。
1.2.4理化指标的测定pH采用STARTER2100 pH计分别测定液体发酵培养前和培养5 d后不同样品的pH,每个样品测3次,取平均值。可溶性糖含量采用蒽酮比色法进行检测[12]。游离氨基酸总量参照GB/T 8314—2013中的方法进行检测[13]。茶多酚含量参照GB/T 21733—2008中的方法进行检测[14]。
1.2.5香气成分的测定对水活度为0.99未经发酵的绿茶粉-甘油培养液和水活度分别为0.99、095和0.83的绿茶粉-甘油培养液进行香气成分的测定。
1) 顶空固相微萃取。参照王丽丽等[15]的方法,采用微萃取装置(50/30 μm DVB/CAR/PDMS)进行萃取。萃取头的老化温度为230℃,老化时间为50 min。萃取条件:萃取温度为80℃,萃取时间为50 min,解析3 min。取2 mL样品于20 mL顶空瓶中,加入2 g氯化钠,然后加入10 mL沸水使其充分溶解,再于80℃下用提前预热后的磁力搅拌器搅拌15 min后,将老化处理后的DVB/CAR/PDMS固相微萃取头插入顶空瓶,萃取50 min,随后取出萃取头,插入气相色谱仪的进样口,进行GC-MS检测。
2) GC-MS检测。色谱条件:色谱柱为HP-Innowax(60.0 mx0.25 mmx0.25 μm)。升温程序:50℃保持5 min,以5℃/min升温至150℃,保持10 min;再以5℃/min升温至230℃,保持10 min;载气(He)流速为1 mL/min;进样量1 μL,不分流。
质谱条件:电子轰击离子源,电子能量70 eV,传输线温度250℃,离子源温度230℃,母离子m/z 285,激活电压1.5 V,采集模式为全扫描。
香气物质成分的定性采用NEST谱库进行检索比对,通过化学工作站CAS号查询得到相关化合物信息,选择相似指数大于70的化合物定性为一种香气物质。采用峰面积归一化进行定量分析,某一组分的峰面积除以总峰面积得到各个香气物质的相对含量。
1.3数据分析
采用SPSS22.0进行单因素方差(ANOVA)分析来比较不同处理间的差异显著性,Duncan进行多重比较(P<0.05为差异显著;P<0.01为差异极显著)。采用origin 8.0进行图像处理。
2结果与分析
2.1基质水活度对冠突散囊菌生物量的影响
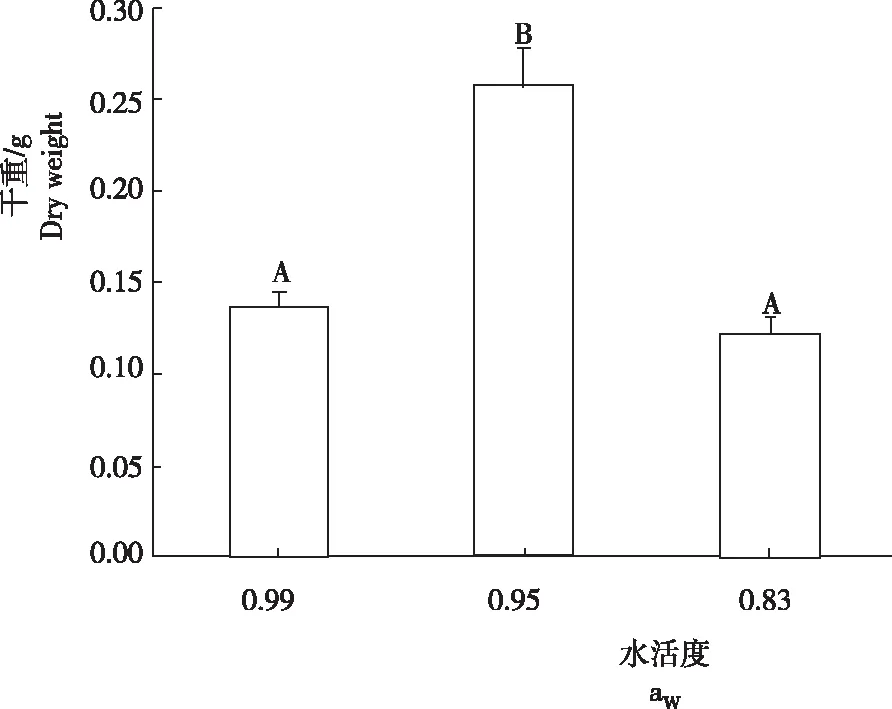
在水活度分别为0.99、0.95和0.83的液体培养条件下,冠突散囊菌生长良好。培养完成后测得各处理的干重分别为0.135 g、0.258 g和0.121 g(图1)。水活度为0.99和0.85时,菌株生物量差异不显著,而与水活度为0.95时的生物量差异极显著。
2.2基质水活度对pH的影响
从图2看出,3个不同水活度条件下,冠突散囊菌悬液接种后的初始(0 d)pH分别为5.42、5.48和5.46,差异不显著。摇瓶培养5 d后,水活度0.99、0.95和0.83条件下的pH分别为5.20、4.61和5.01。水活度为0.99和0.83时,发酵前后pH差异不显著,而水活度为0.95时发酵前后的pH差异极显著。
注:不同大写字母表示不同处理间差异极显著(P<0.01),下同。
Note: Different capital letters indicate significance of difference between different treatments atP<0.01 level. The same below.
图 1不同水活度条件下冠突散囊菌的生物量
Fig.1 Biomass ofE.cristatumunder different water activity
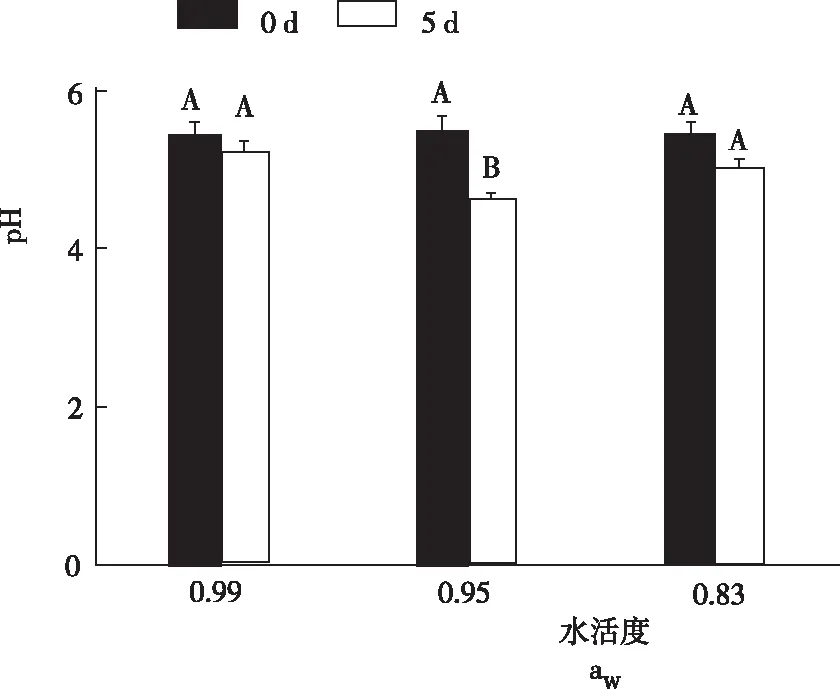
图2不同水活度条件下发酵培养基的pH
Fig.2 pH value of fermentation medium under different water activity
2.3基质水活度对发酵液可溶性糖含量的影响
从图3可知,不同水活度条件下菌株发酵10 d后,水活度为0.95和0.83的培养液中可溶性糖含量分别为30.224 μg/mL和32.751 μg/mL,二者之间差异不显著。水活度为0.99的培养液中,菌株发酵10 d后可溶性糖含量较低。随着水活度的下降,发酵液中可溶性糖的含量上升明显。
2.4基质水活度对发酵液中游离氨基酸含量的影响
经冠突散囊菌发酵后,在水活度为0.95和0.83的条件下,氨基酸含量分别为0.075 mg/mL和0.070 mg/mL,两者之间差异不显著(图4)。水活度为0.99的培养液中,发酵后游离氨基酸含量较低,为0.057 mg/mL。
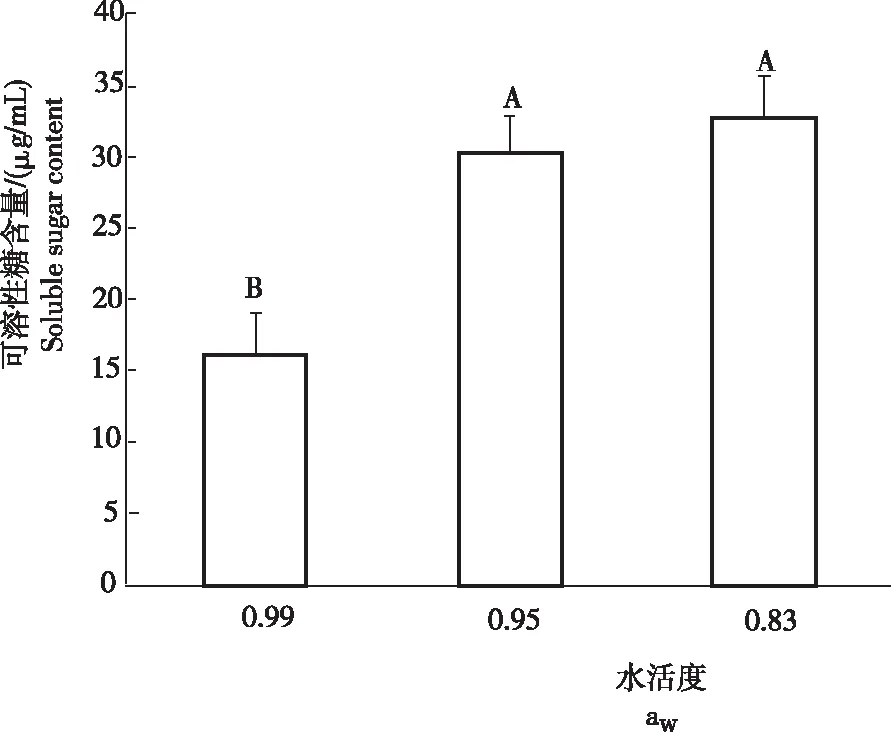
图3不同水活度条件下冠突散囊菌发酵后的可溶性糖含量
Fig.3 Soluble sugar content of fermentedE.cristatumunder different water activity
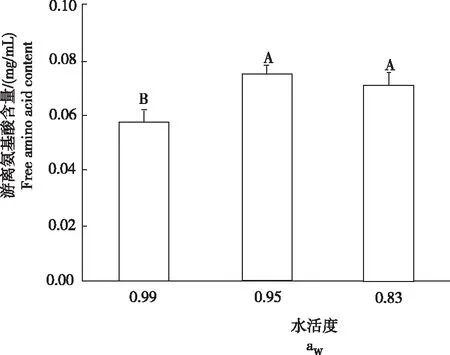
图4不同水活度条件下冠突散囊菌发酵后的游离氨基酸含量
Fig.4 Free amino acid content of fermentedE.cristatumunder different water activity
2.5基质水活度对发酵液中茶多酚含量的影响
从图5看出,经冠突散囊菌发酵10 d后,培养基水活度为0.99时,茶多酚含量为15.95 mg/100mL。随着培养基水活度的进一步下降,菌株发酵后培养液中茶多酚含量呈上升趋势。不同水活度发酵液中的茶多酚含量差异极显著。当培养基水活度下降至0.83时,茶多酚含量最高,为46.87 mg/100mL。
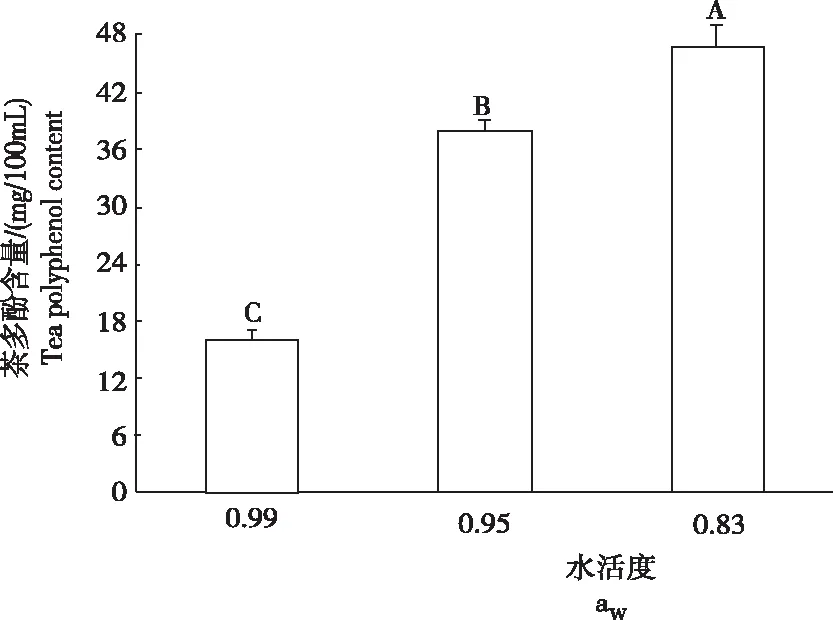
图5不同水活度条件下冠突散囊菌发酵后的茶多酚含量
Fig.5 Tea polyphenol content of fermentedE.cristatumunder different water activity
2.6基质水活度对香气成分的影响
根据质谱数据、相对保留时间,水活度为0.99未发酵和水活度0.99~0.83发酵10 d的香气成分中共鉴定到56个化合物(表1)。其中,醇类物质14种,酮类物质14种,脂类2种,醛类11种,其他类型化合物共15种。将冠突散囊菌接种于不同水活度的培养基中进行摇瓶发酵10 d后,在水活度为0.99条件下,共检测到23个化合物,其中醇类物质8种,酮类物质6种,脂类物质1种,醛类物质1种。在水活度为0.95条件下,共检测到17个化合物,其中,醇类物质6种,酮类物质5种,醛类物质1种,没有检测到脂类物质。在水活度为0.83条件下,共检测到15个化合物,其中,醇类化合物3种,酮类化合物4种,脂类化合物1种,醛类化合物1种。总体上,随着培养基水活度的下降,检出的化合物总数和各类物质相对含量均呈下降趋势。
在水活度为0.99时,与未发酵的相比,真菌发酵导致酮类和醛类化合物数量的明显下降,醇类物质数量上升。特别是蘑菇醇(1-辛烯-3-醇)、芳樟醇、三甲基-5-乙烯基四氢化-2-呋喃甲醇相对含量明显上升;蘑菇醇相对含量由5.627%上升到34.331 7%,含量增加6.1倍。同时,真菌发酵产生了芳樟醇、香茅醇、2-庚醇和二氢-β-紫罗兰醇等醇类化合物。真菌发酵也导致吲哚、苯乙腈、2,4-二叔丁基苯酚和间苯二酚等酚类化合物的降解。
真菌发酵条件下,随着培养基水活度的下降,茶叶香气成分中醇类物质和酮类物质的种类和数量均下降。特别是醇类物质如蘑菇醇、芳樟醇、2-乙基己醇、2-庚醇和2-庚醇,在低水活度条件下均明显下降以致未检测到。低水活度条件下新检测到(±)-6-甲基-5-庚烯基-2-醇、对异丙基苯甲醇、橙花醇和一些酮类化合物,如乙酰丙酮、茉莉酮、二氢-α-紫罗兰酮和DL-3-甲基环戊酮。低水活度促进咖啡因的降解,有利于苯乙烯、2, 4-二叔丁基苯酚、乙基苯和萘的产生。
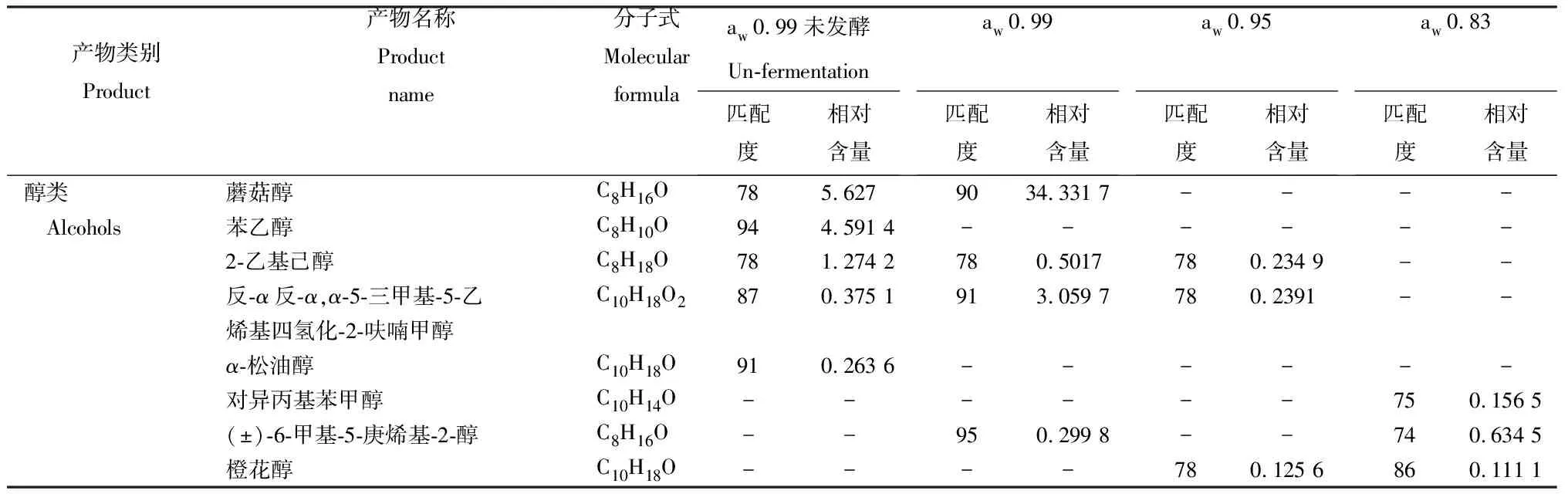
表1不同水活度条件下冠突散囊菌发酵后的主要香气成分及相对含量
续表1
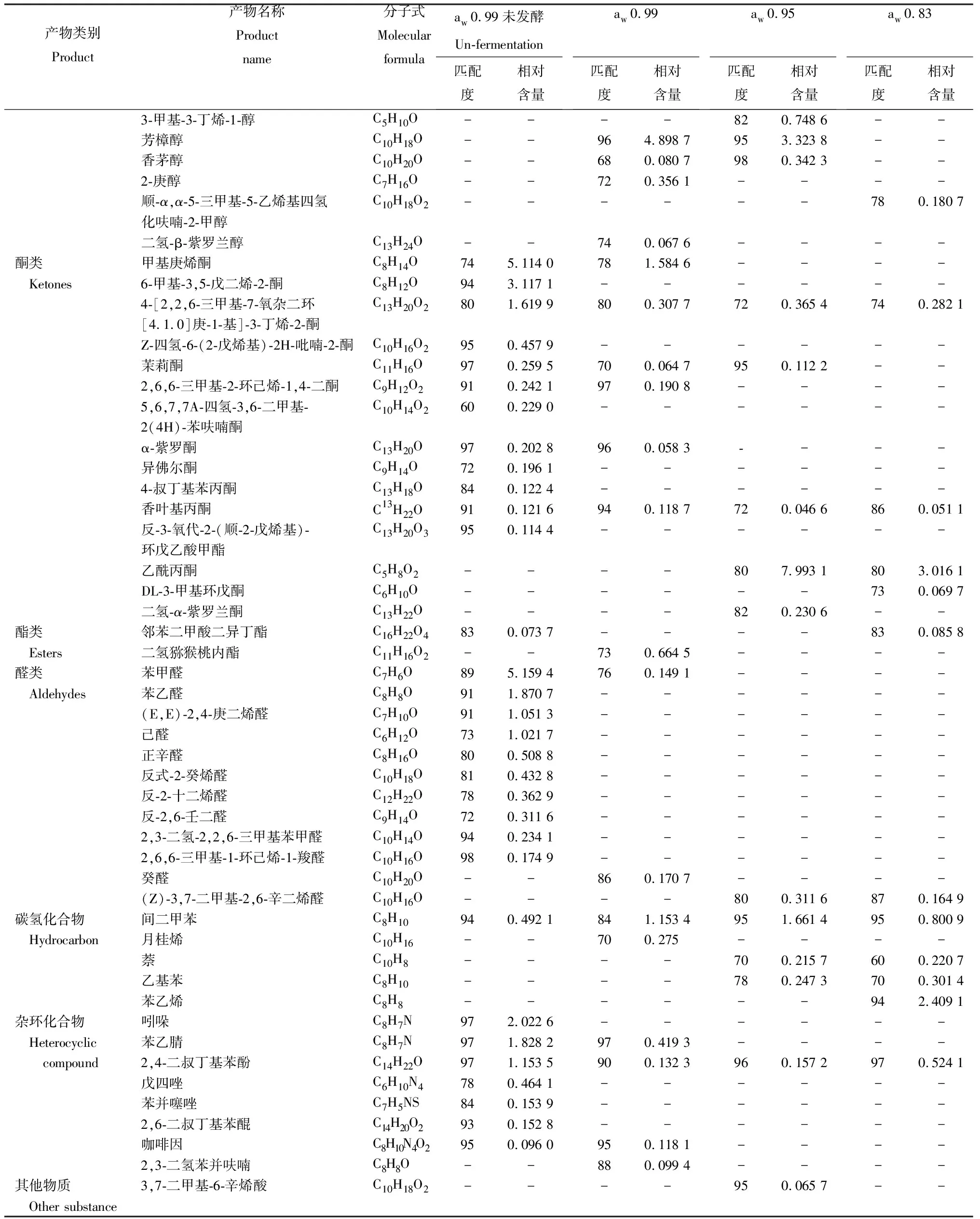
产物类别Product产物名称Product name分子式Molecularformulaaw 0.99未发酵Un-fermentation匹配度相对含量aw 0.99匹配度相对含量aw 0.95匹配度相对含量aw 0.83匹配度相对含量3-甲基-3-丁烯-1-醇C5H10O----820.748 6--芳樟醇C10H18O--964.898 7953.323 8--香茅醇C10H20O--680.080 7980.342 3--2-庚醇C7H16O--720.356 1----顺-α,α-5-三甲基-5-乙烯基四氢C10H18O2------780.180 7化呋喃-2-甲醇二氢-β-紫罗兰醇C13H24O--740.067 6----酮类 甲基庚烯酮C8H14O745.114 0781.584 6---- Ketones6-甲基-3,5-戊二烯-2-酮C8H12O943.117 1------4-[2,2,6-三甲基-7-氧杂二环C13H20O2801.619 9800.307 7720.365 4 740.282 1[4.1.0]庚-1-基]-3-丁烯-2-酮Z-四氢-6-(2-戊烯基)-2H-吡喃-2-酮C10H16O2950.457 9------茉莉酮C11H16O970.259 5700.064 7950.112 2--2,6,6-三甲基-2-环己烯-1,4-二酮C9H12O2910.242 1970.190 8----5,6,7,7A-四氢-3,6-二甲基-C10H14O2600.229 0------2(4H)-苯呋喃酮α-紫罗酮C13H20O970.202 8960.058 3----异佛尔酮C9H14O720.196 1------4-叔丁基苯丙酮C13H18O840.122 4------香叶基丙酮C13H22O910.121 6940.118 7720.046 6860.051 1反-3-氧代-2-(顺-2-戊烯基)-C13H20O3950.114 4------环戊乙酸甲酯乙酰丙酮C5H8O2----807.993 1803.016 1DL-3-甲基环戊酮C6H10O------730.069 7二氢-α-紫罗兰酮C13H22O----820.230 6--酯类 邻苯二甲酸二异丁酯C16H22O4830.073 7----830.085 8 Esters二氢猕猴桃内酯C11H16O2--730.664 5----醛类 苯甲醛C7H6O895.159 4760.149 1---- Aldehydes苯乙醛C8H8O911.870 7------(E,E)-2,4-庚二烯醛C7H10O911.051 3------己醛C6H12O731.021 7------正辛醛C8H16O800.508 8------反式-2-癸烯醛C10H18O810.432 8------反-2-十二烯醛C12H22O780.362 9------反-2,6-壬二醛C9H14O720.311 6------2,3-二氢-2,2,6-三甲基苯甲醛C10H14O940.234 1------2,6,6-三甲基-1-环己烯-1-羧醛C10H16O980.174 9------癸醛C10H20O--860.170 7----(Z)-3,7-二甲基-2,6-辛二烯醛C10H16O----800.311 6870.164 9碳氢化合物 间二甲苯C8H10940.492 1841.153 4951.661 4950.800 9 Hydrocarbon月桂烯C10H16--700.275----萘C10H8----700.215 7600.220 7乙基苯C8H10----780.247 3700.301 4苯乙烯C8H8------942.409 1杂环化合物 吲哚C8H7N972.022 6------ Heterocyclic 苯乙腈C8H7N971.828 2970.419 3---- compound2,4-二叔丁基苯酚C14H22O971.153 5900.132 3960.157 2970.524 1戊四唑C6H10N4780.464 1------苯并噻唑C7H5NS840.153 9------2,6-二叔丁基苯醌C14H20O2930.152 8------咖啡因C8H10N4O2950.096 0950.118 1----2,3-二氢苯并呋喃C8H8O--880.099 4----其他物质 3,7-二甲基-6-辛烯酸C10H18O2----950.065 7-- Other substance
注:—未检测到的物质。
Note: —means the undetected substance.
3结论与讨论
在绿茶粉-甘油培养基的液态发酵条件下,培养基的营养成分主要是绿茶粉(aw0.99),或是绿茶粉和甘油(aw0.95和aw0.83)。培养基的碳素营养主要来自于茶粉中所含有的纤维素、多糖、茶多酚和添加的甘油,而氮源营养主要来自于茶粉中的茶多酚、氨基酸和生物碱等。冠突散囊菌(FZ-2)可以在甘油为唯一碳源营养的培养中正常生长[10]。在只添加绿茶粉的液体培养基中,冠突散囊菌同样可以良好地生长。
培养基水活度显著地影响冠突散囊菌的生长,培养基水活度为0.95时,其菌丝体生长最佳,生物量最大,为0.258 g。散囊菌属的真菌均是嗜干燥和嗜高渗透压的微生物,能够抵抗干燥的空气和适应各种低水活度的生长环境。冠突散囊菌的不同菌株在水活度为0.77的培养基中能正常生长,在水活度为0.95时生长速度最快[10],与本研究的试验结果一致。在茯砖茶加工的“渥堆”阶段,环境中大量的微生物参与其中;但后期的“发花”过程中,只有以冠突散囊菌为主的散囊菌菌株形成优势菌[1, 3]。这可能与“发花”阶段茶胚逐渐干燥,茶叶中游离水份减少,比较适合于散囊菌的生长有关。此外,不同水活度条件下,真菌发酵后对茶汤的pH没有明显的影响。李适等[16]发现冠突散囊菌发酵后有机酸含量略有下降,但不会造成茶汤滋味的酸化。
总体上,随着基质水活度的降低(aw0.95~0.83),干燥程度的上升,有利于冠突散囊菌发酵后茶汤中可溶性糖、氨基酸和茶多酚含量的维持和提升。特别是可溶性糖含量,在低水活度情况下提升显著。茶多酚、氨基酸、茶多糖和咖啡碱等化合物是茶叶主要的品质成分,在泡茶过程中,这些物质的混合决定茶汤滋味。在以绿茶粉为培养基主要成分时,菌株冠突散囊菌利用这些物质作为碳、氮营养而生长,导致茶多酚和生物碱的含量下降,从而降低茶汤的苦涩味,使茶汤滋味变得甘厚醇和。茶叶在微生物发酵后,茶多酚、氨基酸、茶多糖等主要滋味成分含量下降,已经得到大量的试验数据支持[4, 17-19]。黑茶陈化时间的延长和茶叶的持续干燥,可能更加不利于腐败微生物的生长,但对散囊菌影响不大[10],这一状态对维持黑茶的主要品质成分可能是有益的。本试验检测的仅仅是可溶性糖、氨基酸和茶多酚的含量,各类化合物在菌株发酵后的具体组分和数量变化,需要采用其他的分析手段作更为精细的分析。
在水活度为0.99时,与未发酵相比,冠突散囊菌发酵后茶叶醇类香气成分如蘑菇醇、芳樟醇、香茅醇、三甲基-5-乙烯基四氢化-2-呋喃甲醇和二氢-β-紫罗兰醇相对含量上升。这一结果与沈程文等[20-22]在不同试验条件下的研究结论一致,表明冠突散囊菌发酵导致茶叶香气物质的成分和含量变化是一种普遍的现象。茯砖茶香气成分的研究大多选择固态发酵条件和成品茶,已检测到的主要香气物质包括芳樟醇及其氧化物、水杨酸甲酯、α-紫罗酮、β-紫罗酮、橙花叔醇、香叶基丙酮、香叶醇和甲氧基类化合物等[2, 20-21, 23];但大多数没有检测到蘑菇醇,或蘑菇醇虽是香气的基本成分但不是主要成分[24-25]。蘑菇醇是真菌(包括一些美味的食用菌)的主要挥发性香气成分[26],近年来发现其有重要的生理功能[27]。在试验设置的液体发酵条件下,蘑菇醇成为主要的香气物质,这可能与发酵原料、发酵条件和香气提取方法有关。与当前普遍采用的茶叶固态发酵(如渥堆、发花)相比,茶汤的液态发酵可以在大型发酵罐中的控制条件下进行,液体发酵的优势可以为茶饮料的发展创造条件。香气是茶叶和茶饮料的重要品质成分[4, 24],微生物发酵后蘑菇醇、芳樟醇、2-庚醇和香茅醇等香气物质的产生或增加,对提升茶饮料的品质和市场价值是有益的。
随着基质水活度的下降,冠突散囊菌发酵后,茶叶香气化合物总数和各类物质相对含量均呈下降趋势;同时在不同水活度条件下,也产生了一些新的化合物。如培养基水活度从0.99下降至0.95时,虽然蘑菇醇、芳樟醇、2-乙基己醇和三甲基-5-乙烯基四氢化-2-呋喃甲醇等成分的含量下降明显,但也产生了橙花醇、3-甲基-3-丁烯-1-醇和二氢-α-紫罗兰酮等成分。另外,水活度也影响真菌发酵后茶汤中的咖啡因含量,低水活度条件下,茶汤中咖啡因的含量逐渐下降。试验结果表明,通过调节发酵液(培养基)的水活度,可以调控真菌发酵后茶汤的香气成分和含量。
冠突散囊菌是我国特有茶类-黑茶,尤其是茯砖茶产品中的优势微生物,并作为对人体有益的微生物而成为茶叶产品的一部分[1, 3, 28]。利用冠突散囊菌的不同菌株作为人工发酵菌剂生产不同的产品,在我国已有大量的研究[29-31]。冠突散囊菌适应于干燥和高渗透压的环境,在一定的低水活度和干燥条件下生长更好,更能发挥其对茶叶成分的生物转化效能。研究结果对促进冠突散囊菌的应用和茶叶深加工的发展有积极的意义。
