裸鼠乳腺癌模型评价拉帕替尼固体分散体的药效*
2020-01-14胡献跃戴关海王晨霞
胡献跃,戴关海,王晨霞
(1. 金华职业技术学院,浙江 金华 321017; 2. 浙江省中医药研究院,浙江 杭州 310007)
晚期及转移性乳腺癌常与表皮生长因子受体(EGFR)族[包括EGFR,人表皮生长因子受体2(HER2),HER3,HER4]酪氨酸激酶的过度表达和激活有关。若乳腺癌患者HER2 过度表达时,疾病进展和死亡风险则显著升高[1-2]。甲苯磺酸拉帕替尼是EGFR 和HER2 双重抑制剂[3],用于晚期或转移性乳腺癌的治疗[4-6]。但由于其在水中不溶,生物利用度只有10% ~20%[7]。固体分散技术将药物以分子、微晶、无定形态分散在适宜载体中,可提高药物(尤其是难溶性药物)的表观溶解度和溶出速率,从而提高药效[8]。本研究中以Soluplus® 为载体、ploxama188为增塑剂,通过药载比的调节,制备不同表观溶解度的固体分散体,并利用裸鼠乳腺癌模型、HER2 和EGFR蛋白表达水平测定,评价甲苯磺酸拉帕替尼固体分散体对移植瘤的抑制效果。现报道如下。
1 材料与方法
1.1 仪器与材料
仪器:Centrifuge 5810R 型离心机(Eppendorf,德国艾本德股份公司);3111 型CO2水套培养箱(美国热电公司);无菌超净台HR40-Ⅱ-A2 型(青岛海尔特种电器有限公司);Agilent 高效液相色谱仪(包括1260 四元泵,1260DAD 检测器,1260 自动进样器,美国安捷伦科技公司);NIS-Elements D 3.2 型图像分析仪(日本尼康株式会社);卡尺及其他材料。
瘤株:人乳腺癌细胞株MDA-MB-231,由浙江省中医药研究院肿瘤所提供,液氮保存。
动物:BALB/c-nu 雌性裸小鼠,SPF 级,体质量19 ~22 g,由北京维通利华实验动物技术有限公司提供,动物许可证号为SCXK(京)2016-0006,动物合格证号为11400700303981,饲养条件为室温25 ℃,相对湿度70%,自由进食与饮水。实验动物使用许可证为SYXK(浙2014-0003)。
药物与试剂:甲苯磺酸拉帕替尼固体分散体[自制,批号为180502(1 ∶0.5 ∶0.5),180509(1 ∶1 ∶1),180512(1 ∶2 ∶1)];TYKERB® 片(GSK,批号为17045073,规格为每片250 mg);EGFR 一抗(批号为18986-1-AP);HER2 一抗(批号为18299-1-AP),均由Proteintech公司提供;DMEM 高糖培养基(1X,批号为1801030303),RPMI.1640 培养液(1X,批号为1711140506),PBS 缓冲液(1X,批号为1804110105),均由吉诺生物医药技术有限公司提供。
1.2 方法
1.2.1 固体分散体制备
以Soluplus® 为载体、ploxama188 为增塑剂,采用溶剂挥发法制备固体分散体[9],分别制备高水溶性固体分散体[Lapatinib ditosylat-Soluplus® -泊洛沙姆188(1 ∶2 ∶1)],中水溶性固体分散体[Lapatinib ditosylat-Soluplus® -泊洛沙姆188(1 ∶1 ∶1)]和低水溶性固体分散体[Lapatinib ditosylat-Soluplus® -泊洛沙姆188(1 ∶0.5 ∶0.5)]。
1.2.2 表观溶解度测定
色谱条件:色谱柱为Agilent C18柱(250 mm×4.6 mm,5 μm);流动相为乙酸铵溶液(pH 调至4)-乙腈(1 ∶1);流速为1.0 mL/min;柱温为40 ℃;测定波长为260 nm。
测定方法:取甲苯磺酸拉帕替尼原料、TYKERB®片和固体分散体适量(约含拉帕替尼10 mg),置25 mL容量瓶中,加水适量,超声溶解20 min,加水定容,溶液在搅拌下置(25±1.0)℃平衡2 h,经0.45 μm 滤膜过滤,取续滤液,采用高效液相色谱法测定。
1.2.3 动物模型构建及分组
取雌性BALB/c-nu 裸鼠2 只,右腋皮下接种MDA-MB-231 细胞悬液(5×107/mL),每只0.2 mL,常规饲养50 d 后,脱颈处死,剥离皮下肿块,剪成2 ~3 mm的碎块,种植于50 只裸鼠乳腺脂肪垫下,缝合切口,术后继续无菌饲养。当肿瘤长到100 mm3左右时,开始分组、称重、给药[10]。按随机法分为5 组[高水溶性组(A1组)、中 水 溶 性 组(A2组)、低 水 溶 性 组(A3组)、TYKERB® 对照组(B 组)和模型组(C 组)],每组10 只。给药组实验时取各药载比固体分散体和TYKERB® 粉末适量,加水配制为含拉帕替尼6.44 g/L 的混悬液,超声处理20 min,给小鼠灌胃体积为25 mL/kg,相当于灌胃拉帕替尼161.0 mg/kg;C 组灌水25 mL/kg。各组动物每日灌胃1 次,共6 周。
1.2.4 移植瘤体积测定和抑制效果检查
小鼠每周称重,并测量肿瘤最大长径(a)和横径(b),肿瘤体积(mm3)=(肿瘤长径×肿瘤短径2)/2。分别计算相对肿瘤体积和相对肿瘤增殖率(T/C,%),同时观察腋窝是否能触及肿大淋巴结,皮肤有无溃烂,裸鼠的活动状态及生长情况有无异常。实验结束时剥离实体瘤称重,计算抑瘤率[11]。
抑瘤率(%)= [(模型组平均瘤重-给药组平均瘤重)/模型组平均瘤重] ×100%
取原位肿瘤和肿大淋巴结进行HE 染色病理检查。
1.2.5 移植瘤中EGFR 和HER2 蛋白表达
采用免疫组化法测定各组移植瘤中EGFR 和HER2 蛋白表达量,肿瘤组织用10%中性福尔马林固定24 h 后,石蜡包埋、切片、脱蜡及复水、微波抗原修复、阻断内源性过氧化物酶、5%BSA 封闭、EGFR 和HER2 一抗孵育、二抗孵育、滴加SABC,DAB 显色、复染细胞核及脱水封片。结果采用NIS-Elements D 3.2 型图像分析仪分析,每张切片随机取5 个视野,阳性细胞为黄褐色颗粒着色,用平均光密度值表示EGFR 和HER2 的蛋白表达量[12]。
1.3 统计学处理
采用SPSS 20.0 统计学软件处理。计量资料用表示,组间比较采用单因素方差分析,并行正态分布检验和方差齐性检验。P <0.05 为差异有统计学意义。
2 结果
2.1 建模成功
实验中各组裸鼠的活动状态及生长情况无明显异常,部分裸鼠腋窝淋巴结出现肿大,未见皮肤溃烂现象。裸鼠剥离实体瘤镜下观察结果见图1。实体瘤质地较软,部分肿瘤中心有乳酪状坏死,乳腺结构受到破坏;肿瘤实体细胞丰富,缺少腺管状结构;肿瘤细胞排列不规则,增生活跃,可见细胞核分裂现象;癌巢周围可见淋巴细胞、浆细胞等细胞浸润。可见,病理符合乳腺癌组织病理特征,裸鼠造模可靠。

图1 MDA-MB-231 裸鼠移植瘤病理学检查结果(HE 染色,×400)
2.2 表观溶解度
测定结果表明,TYKERB® 与原料表观溶解度基本一致。固体分散体中载体Soluplus® 和增塑剂ploxama188 均为非离子型表面活性剂,具有胶束增溶作用,同时2 种高分子材料对药物的过饱和溶液具有很强的抑晶作用,维持拉帕替尼较高的过饱浓度,制备的固体分散体表观溶解度为TYKERB® 的6.2 ~16.3 倍。
表1 各组小鼠移植瘤生长体积变化比较(± s,mm3,n=10)
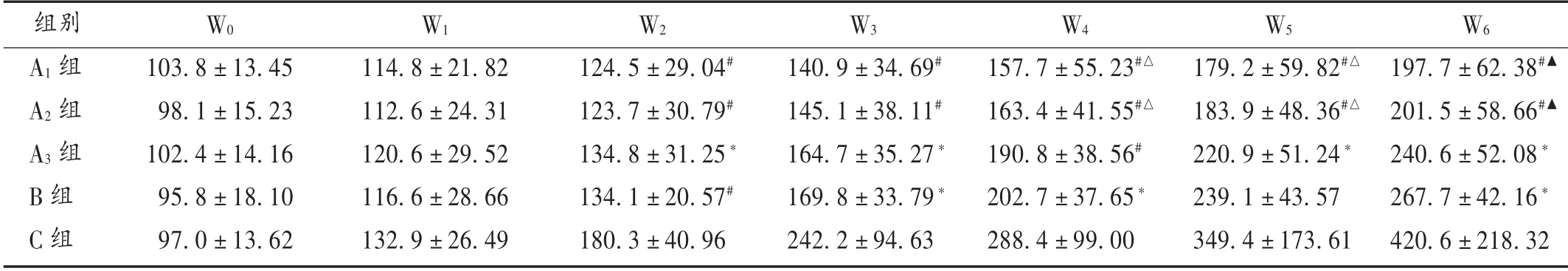
表1 各组小鼠移植瘤生长体积变化比较(± s,mm3,n=10)
注:与C 组比较,*P <0.05,#P <0.01;与B 照组比较,△P <0.05,▲P <0.01。表3 和表4 同。
组别A1 组A2 组A3 组B 组C 组W0 103.8±13.45 98.1±15.23 102.4±14.16 95.8±18.10 97.0±13.62 W1 114.8±21.82 112.6±24.31 120.6±29.52 116.6±28.66 132.9±26.49 W2 124.5±29.04#123.7±30.79#134.8±31.25*134.1±20.57#180.3±40.96 W3 140.9±34.69#145.1±38.11#164.7±35.27*169.8±33.79*242.2±94.63 W4 157.7±55.23#△163.4±41.55#△190.8±38.56#202.7±37.65*288.4±99.00 W5 179.2±59.82#△183.9±48.36#△220.9±51.24*239.1±43.57 349.4±173.61 W6 197.7±62.38#▲201.5±58.66#▲240.6±52.08*267.7±42.16*420.6±218.32
2.3 移植瘤体积变化
各组移植瘤体积变化见表1。第1 周,各组肿瘤体积增长无明显差异。给药2 周后,C 组小鼠肿瘤体积快速增长;与C 组比较,A1组和A2组抑瘤作用显著(P <0.01),A3组与B 组移植瘤增长也较C 组缓慢(P <0.05)。与B 组比较,A1组和A2组在第4 周后也显示更强的抑瘤作用(P <0.01)。
2.4 抑瘤效果
各组相对肿瘤增殖率结果见表2。可见,随着甲苯磺酸拉帕替尼表观溶解度的增加,对移植瘤的抑制效果更显著。各组抑瘤率结果见表3。可见,各固体分散体组较C 组比较均有显著差异(P <0.01),其中A1组和A2组与B 组比较,差异显著(P <0.05)。
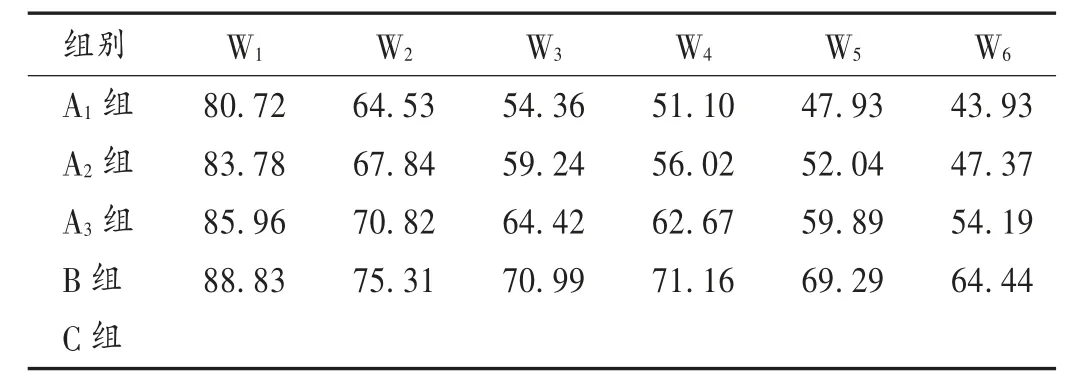
表2 各组相对肿瘤增殖率(%)
表3 拉帕替尼对MDA-MB-231 裸鼠移植瘤生长的影响(± s,n=10)

表3 拉帕替尼对MDA-MB-231 裸鼠移植瘤生长的影响(± s,n=10)
组别数量(只) 体质量(g)瘤重(g)A1 组A2 组A3 组B 组C 组开始10 10 10 10 10结束10 10 10 10 10开始19.2±0.94 19.3±0.81 19.2±0.73 19.3±0.65 19.3±0.72结束18.8±2.05 18.8±1.15 18.9±1.12 18.8±1.09 19.6±0.82 0.332±0.110#△0.334±0.090#△0.357±0.088#0.442±0.093*0.659±0.233抑瘤率(%)49.6 49.3 45.8 32.9
2.5 EGFR 和HER2 蛋白表达
由图2 和图3 可知,各实验组和B 组对EGFR 和HER2 蛋白在肿瘤组织中表达的程度与C 组比较均明显减弱(P <0.05)。A1组和A2组对目标蛋白的抑制作用明显优于B 组(P <0.05)。详见表4。

图2 MDA-MB-231 裸鼠移植瘤中EGFR 表达量(×40)
3 讨论
甲苯磺酸拉帕替尼属BCS Ⅳ类药物,不溶于水,临床需要大剂量给药(1 250 mg/d)才能达到治疗效果。增加难溶性药物溶解度和溶出速率方法很多,如环糊精包裹、微乳、纳米混悬液、表面活性剂增溶、纳米脂质体、固体分散体、纳米晶等[13]。药物表观溶解度的增加,并不都能促进药物的透皮吸收,原因是在增加药物表观溶解度的同时导致药物渗透性下降[14]。而固体分散技术通过维持药物的过饱和状态来增加其溶解度,较少出现药物渗透性降低的情况[15]。
本研究中通过采用溶剂挥发法制备甲苯磺酸拉帕替尼固体分散体,使其表观溶解度较阳性对照药分别提高16.3 倍(1 ∶2 ∶1)、13.5 倍(1 ∶1 ∶1)、6.2 倍(1 ∶0.5 ∶0.5),再利用裸鼠乳腺癌模型评价其抑瘤作用。

图3 MDA-MB-231 裸鼠移植瘤中HER2 表达量(×40)
表4 移植瘤中EGFR 和HER2 表达程度(± s,%,n=10)
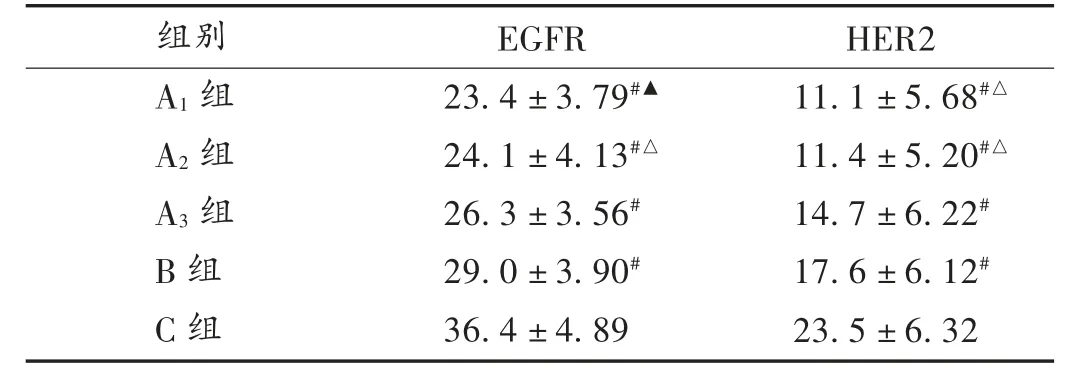
表4 移植瘤中EGFR 和HER2 表达程度(± s,%,n=10)
组别A1 组A2 组A3 组B 组C 组EGFR 23.4±3.79#▲24.1±4.13#△26.3±3.56#29.0±3.90#36.4±4.89 HER2 11.1±5.68#△11.4±5.20#△14.7±6.22#17.6±6.12#23.5±6.32
乳腺癌的发展常与EGFR 和HER2 过表达相关[2],甲苯磺酸拉帕替尼通过氢键可逆地结合到EGFR 和HER2 酪氨酸激酶ATP 结合位点上,阻止ArIP 结合到酪氨酸激酶区,抑制酪氨酸激酶的自磷酸化和激活,从而抑制肿瘤细胞增殖和凋亡[16]。本研究中比较了各组对EGFR 和HER2 的抑制效果,从分子水平分析了固体分散体技术的增效作用。高水溶性组和中水溶性组中EGFR 和HER2 的表达量分别为模型组的64.29% ~66.21%和47.23% ~48.51%,均显著优于TYKERB® 阳性对照组的79.67% 和74.89% (P <0.05)。与各组移植瘤的体积和瘤重变化结果吻合。这可能源于甲苯磺酸拉帕替尼表观溶解度的提升,扩大了细胞膜渗透浓度梯度,促进了甲苯磺酸拉帕替尼的跨膜转运吸收。
