4株鸭坦布苏病毒的毒力、E基因序列和抗原差异性
2020-01-14杨志远段会娟王小蕾刘立新赵际成潘洁刘月焕林健
杨志远,段会娟,王小蕾,刘立新,赵际成,潘洁,刘月焕,林健
4株鸭坦布苏病毒的毒力、E基因序列和抗原差异性
杨志远,段会娟,王小蕾,刘立新,赵际成,潘洁,刘月焕,林健
(北京市农林科学院畜牧兽医研究所,北京 100097)
【】比较鸭坦布苏病毒(duck tembusu virus, DTMUV)分离株的毒力、分析E蛋白基因序列、研究抗原差异性,为鸭坦布苏病防控提供依据。【】将DTMUV-HB(2011)、DTMUV-AH(2014)、DTMUV-GX1(2012)、DTMUV-GX2(2015) 4株病毒接种10日龄易感鸭胚进行增殖,并利用6日龄SPF鸡胚测定ELD50。根据测定的病毒含量,将分离毒株稀释为100ELD50/0.5mL,人工感染40只180日龄健康北京鸭,进行临床症状观察、病毒分离、大体剖检,分析分离毒株的毒力有无差异。提取8株DTMUV分离病毒株的RNA,通过RT-PCR扩增E基因,分析比较不同地区的DTMUV的E基因核苷酸和氨基酸序列相似性,构建进化树。利用实验室建立的鸭坦布苏病毒血凝抑制试验分别测定4株病毒阳性血清对4株病毒的HI效价。同时采用固定病毒稀释血清法,利用C6/36细胞测定4株病毒阳性血清对4株DTMUV的血清中和效价。通过交叉血凝抑制试验和血清交叉中和试验比较4株病毒的抗原差异性(R值)。【】(1)各毒株的病毒含量范围在104.7—105.3ELD50/0.1mL。人工感染鸭试验,攻毒后3 d鸭采食量和产蛋量均显著下降,各组病毒分离阳性率均在85%以上,剖检病变主要表现为卵泡变形、出血。(2)分离株序列分析结果表明,核苷酸序列相似性为95.7%—100%,推导氨基酸序列相似性在98.2%以上。遗传进化分析表明共同构成了一个进化分支。(3)4株病毒及其阳性血清进行血凝抑制交叉试验,计算的抗原性差异R值在0.79—1.12之间;进行细胞中和交叉试验,计算的R值在0.79—1.20之间。【】分离的4株DTMUV在毒力、E蛋白基因和抗原性上未见显著差异。
鸭坦布苏病毒;毒力;E基因;抗原性
0 引言
【研究意义】鸭坦布苏病毒(duck tembusu virus, DTMUV)属于黄病毒科黄病毒属,2010年春季开始在浙江、江苏、山东、河北和北京等地区暴发,以鸭产蛋量下降为主要临床特征[1-3]。疫病暴发初期,研究人员根据临床症状和主要病理变化,曾将该病命名为鸭出血性卵巢炎[4]、类减蛋综合征[5]和鸭病毒性脑炎[6],2011年首届“水禽疫病防控研讨会”将该病统一命名为“鸭坦布苏病毒病”[7]。北京鸭、樱桃谷鸭、金定鸭、麻鸭、康贝尔鸭和鹅等禽类均可发病[8],目前已成为养鸭生产中的一种地方流行性疫病,几乎每年都会给养鸭业造成明显的经济损失。开展鸭坦布苏病毒的流行情况调查和遗传变异分析,可为该病的有效防控提供科学依据。【前人研究进展】Tembusu病毒首次于1968年在马来西亚Sarawak地区的蚊子体内分离到[9],随后分别于1982和1992年在泰国北部日本脑炎流行地区的蚊子体内发现[10-11]。2000年,有研究报道一种与Tembusu病毒核酸的同源性为92%的Sitiawan病毒,感染鸡后能够引起鸡生长发育受阻[12]。引起我国鸭群发病的坦布苏病毒与Bagaza病毒的核酸高度同源[13]。万春和等在鸭坦布苏病毒病灭活疫苗、活疫苗和活载体疫苗研制方面做了大量的研究工作,试验结果均表明疫苗有效[14-21]。在使用疫苗的选择压力下,鸭坦布苏病毒的遗传变异情况如何,目前已有多名研究人员对流行的鸭坦布苏病毒株主要进行了E基因的序列分析[22-26],因为囊膜蛋白(E蛋白)是黄病毒最大的结构蛋白和主要的包膜蛋白,是宿主抗感染免疫的重要保护性抗原[27]。结果表明,各分离株之间没有显著性差异,但没有直接数据表明抗原性有无差异。【本研究切入点】自2010年鸭坦布苏病毒病暴发以来,虽然曾一度呈现零星散发,但从2012年起该病在我国主要养鸭地区再次大面积流行[28]。该病流行期间,病毒的生物学特性、基因序列和抗原性是否发生变异,尚未见有系统的研究报道。为了回答这些问题,我们利用2010至2016年间分离自山东、河北、广西、安徽、河南等不同地区的DTMUV开展了毒力、E蛋白基因和抗原差异性的比较研究,为DTMUV分子流行病学的研究提供参考信息,为该病的防控和疫苗的研制奠定理论基础。【拟解决的关键问题】鸭坦布苏病毒的毒力是否发生了变化,抗原性是否改变。
1 材料与方法
本试验于2015年2月至2017年8月在北京市农林科学院畜牧兽医研究所完成。
1.1 试验材料
1.1.1 毒株 DTMUV-SD株(2010)、DTMUV-HB株(2011)、DTMUV-GX1株(2012)、DTMUV-BJ株(2013)、DTMUV-AH株(2014)、DTMUV-GX2株(2015)、DTMUV-HN株(2015)、DTMUV-AX株(2016)由北京市农林科学院畜牧兽医研究所动物疫病研究室分离鉴定、保存。
1.1.2 实验动物 180日龄健康DTMUV抗体阴性北京鸭和10日龄易感鸭胚,购自北京南口北京鸭育种中心,试验鸭及种鸭群未经DTMUV疫苗免疫且无DTMUV疫病流行史;SPF鸡胚购自北京梅里亚维通实验动物有限公司。
1.1.3 细胞 C6/36细胞,123代,购自中国典型培养物保藏中心(武汉大学),北京市农林科学院畜牧兽医研究所动物疫病研究室增殖扩繁。
1.1.4 试剂 0.5%乳汉液、0.33%鹅红细胞悬液等,均由北京市农林科学院畜牧兽医研究所动物疫病研究室配制;MEM培养基,购自Hyclone公司;胎牛血清(FBS),购自Life Technology公司;TaKaRa MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0、TaKaRa RNA PCR Kit (AMV) Ver.3.0、均购自Takara公司。
1.2 试验方法
1.2.1 病毒的增殖及鸡胚半数致死量(ELD50)的测定 将DTMUV-HB、DTMUV-AH、DTMUV-GX1、DTMUV-GX2 4株病毒用无菌0.5%乳汉液1﹕200倍稀释。将稀释的毒种经尿囊腔途径接种10日龄易感鸭胚,每胚0.1 mL,置36—37℃孵育,收获尿囊液。-70℃保存备用。4株病毒尿囊液分别用无菌0.5%乳汉液作10倍系列稀释至10-6,每个稀释度经卵黄囊接种6日龄SPF鸡胚5枚,每胚0.1 mL,置36—37℃孵育,观察和记录接种后24—168 h死亡鸡胚,采用Kärber法计算ELD50。
1.2.2 人工感染鸭试验及病毒阳性血清的制备 共40只180日龄健康北京鸭,经检测DTMUV抗体呈阴性,随机分成5组,每组8只,1组健康对照,肌肉注射PBS 0.5 mL/只,其余4组各用1株试验用毒株进行人工感染,胸部肌肉接种病毒液0.5 mL/只(含100个ELD50),观察临床症状;攻毒后2 d采血分离血清,按照文献[29]进行病毒分离;攻毒后8 d每组随机取5只进行剖检,观察病理变化。剩余试验鸭在攻毒后14 d,使用相同剂量和相同毒株再次接种加强免疫,接种后15 d采血,分离血清,分别制备成相应毒株的阳性血清,-30℃保存备用。
1.2.3 分离毒株E基因分析 利用TaKaRa MiniBESTViral RNA/DNA Extraction Kit Ver.5.0提取7株分离病毒株尿囊液病毒RNA,参照GenBank已发布DTMUV的E基因序列设计一对引物,引物序列为DTMUV-EF:5′-ttcagctgtctggggatgc-3′,DTMUV-ER:5′-cggcattgacatttactgcc-3′,由生工生物工程(上海)股份有限公司合成。通过TaKaRa RNA PCR Kit (AMV) Ver.3.0进行RT-PCR扩增,目的片段大小为1 506 bp,PCR产物送测序后应用DNAstar ( Version 5. 07) 分析软件比较不同时间不同地区的鸭坦布苏病毒E蛋白的核苷酸和氨基酸序列相似性,并绘制系统发育进化树。
1.2.4 分离毒株交叉血凝抑制试验 参照文献[30],将DTMUV-HB、DTMUV-AH、DTMUV-GX1、DTMUV- GX2 4株病毒接种C6/36细胞后,获得了对0.33%鹅红细胞的血凝特性,利用实验室建立的鸭坦布苏病毒血凝抑制试验操作方法,分别测定了4株病毒阳性血清对4株病毒的HI效价。
1.2.5 分离毒株细胞交叉中和试验 将C6/36细胞接种96孔微量细胞培养板,利用C6/36细胞进行DTMUV-HB、DTMUV-AH、DTMUV-GX1、DTMUV- GX2 4株病毒株的TCID50测定,将毒种用MEM培养基作10倍系列稀释,取10-1、10-2、10-3、10-4、10-5稀释度,每个稀释度分别接种5孔,每孔100 μL,置28.5℃作用2 h,然后弃去上清液,加入含2%胎牛血清的MEM培养液100 μL,28.5℃培养120 h。每孔取25 μL上清液测定对0.33%鹅红细胞的血凝性,以75%以上的凝集判为HA阳性。记录接种孔中HA阳性的孔数,采用Reed-Muench法计算。根据4株病毒的病毒含量,采用固定病毒稀释血清法,将4种免疫阳性血清56℃灭活30 min,作2-1—2-6稀释,分别与等量的含200个TCID50的4株病毒液进行交叉混合,37℃作用1 h后,接种于96孔C6/36单层细胞培养板,每孔100 μL,每个稀释度接种5孔,28℃作用2 h,弃去,加入含2%胎牛血清的维持液100 μL。同时设置含100个TCID50、1个TCID50和0.1个TCID50的病毒对照,空白细胞对照,血清对照,继续培养120 h,测定每孔对0.33%鹅红细胞的血凝性,以75%以上的凝集判为HA阳性,按照Reed-Muench公式计算血清中和效价。
如果R=1,表明2株间抗原相同;如果0.67≤R≤1.5,表明2株间抗原性无明显差异;如果0.5≤R<0.67,表明2毒株间抗原性有小的差异;如果R<0.5,表明2毒株间抗原性有明显差异;R值越小,抗原性差异越大。
2 结果
2.1 病毒增殖与ELD50的测定
DTMUV-HB、DTMUV-AH、DTMUV-GX1、DTMUV-GX2 4株病毒株接种鸭胚后均在48—72 h内死亡,死亡鸭胚发育矮小,收获的尿囊液透明清亮。4株分离毒株测定的病毒含量分别为104.9、104.7、104.9和105.3ELD50/0.1mL。
2.2 DTMUV分离株对北京鸭的毒力
DTMUV-HB、DTMUV-AH、DTMUV-GX1、DTMUV-GX2 4株病毒以相同攻毒剂量(含100个ELD50)人工感染试验鸭3 d后,攻毒鸭临床上均出现采食量下降、一过性精神沉郁、体重减轻、拉绿色稀便等症状,健康对照鸭精神状态良好,未见明显异常。攻毒后2 d,4株病毒攻毒鸭的病毒分离阳性率均在85%以上,健康对照鸭未分离到病毒,结果见表1。攻毒后8 d,剖检攻毒鸭均出现明显的卵巢或输卵管萎缩、出血、变形等病变,健康对照鸭未见明显异常。除剖检鸭外,剩余试验鸭均存活。结果表明,4株试验用DTMUV对北京鸭的毒力没有明显差异。

表1 DTMUV人工感染北京鸭试验
“A”表示病毒分离结果阳性鸭数,“B”表示检测鸭数,“/”表示未做
“A” The number of ducks that were positive in virus isolation; “B” The number of ducks in the group; “/” Not done
2.3 DTMUV分离株E基因分析
提取DTMUV-SD、DTMUV-HB、DTMUV-GX1、DTMUV-BJ、DTMUV-AH、DTMUV-GX2、DTMUV- HN、DTMUV-AX等8株病毒核酸,并进行RT-PCR扩增,PCR产物经凝胶电泳均看到约1 500 bp大小的目的片段,结果如图1。送Takara测序与国内其他DTMUV比较后发现,核苷酸序列相似性为95.7%—100%,推导氨基酸序列相似性在98.2%以上。遗传进化分析表明,7株DTMUV与近几年登录在GenBank的鸭坦布苏病毒在系统进化上共同构成了一个进化分支,图2表明目前在我国鸭群中流行的DTMUV的E基因未出现明显的遗传变异。

M: DL2000 Marker; 1: DTMUV-SD; 2: DTMUV-HB; 3: DTMUV-GX1; 4: DTMUV-BJ; 5: DTMUV-AH; 6: DTMUV-GX2; 7: DTMUV-HN; 8: DTMUV-AX; 9: Negative control
2.4 DTMUV分离毒株交叉血凝抑制试验
分别测定4种病毒株阳性血清对4株DTMUV抗原的交叉HI效价,每种病毒阳性血清有3份,取几何平均值,结果见表2。按照抗原相关系数R值的计算方法计算4毒株间的抗原性差异,详见表3。4毒株间的HI抗原性差异R值在0.79—1.12之间,表明没有明显的抗原性差异。
2.5 DTMUV分离毒株细胞交叉中和试验
2.5.1 TCID50测定结果 DTMUV-HB、DTMUV-AH、DTMUV-GX1、DTMUV-GX2 4株病毒的TCID50测定结果分别为10-3.8/0.1mL、10-3.8/0.1mL、10-3.8/0.1mL、10-4.5/0.1mL。
2.5.2 细胞交叉中和试验 不同毒株与阳性血清作用1 h后,接种细胞,培养168 h,观察记录细胞病变(通过测定HA效价进行最终判定),计算阳性血清对不同毒株的中和效价,结果见表4和图3。每种病毒阳性血清有3份,取几何平均值,按照抗原相关系数R值的计算方法计算4毒株间的抗原性差异,详见表3。结果表明,R值在0.79—1.20之间,4毒株间的没有明显的抗原差异性,与血凝抑制试验结果一致。

图2 DTMUV分离株E基因进化树

表2 4株DTMUV的HI交叉试验
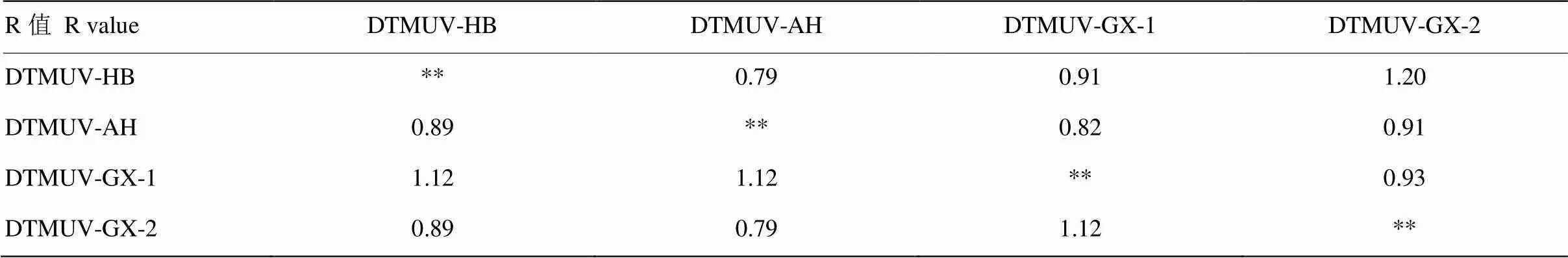
表3 4株DTMUV的抗原差异性R值
左下方为HI试验抗原性差异比较,右上方为细胞中和试验抗原性差异比较
Comparison of antigenic difference with cross hemagglutination inhibition in lower triangle, comparison of antigenic difference with cross neutralization in upper triangle
3 讨论
鸭坦布苏病毒病2010年在我国江浙一带开始流行,随后迅速扩散到我国主要的鸭养殖地区,目前已发展为地方流行性常在疫病。该病流行期间,DTMUV是否发生了变异?毒力有无增强?抗原性是否发生变化?现有的疫苗是否能对目前的“流行毒株”产生保护?这些是国内各养鸭企业、养鸭场包括疫苗生产企业最为关心的问题。我们利用2010—2016年间不同地区分离到的DTMUV毒株从病毒毒力、E蛋白基因序列和抗原差异性上进行了系统的比较和研究,为初步回答上述问题提供了数据支撑和理论依据。

图3 4株DTMUV阳性血清中和效价
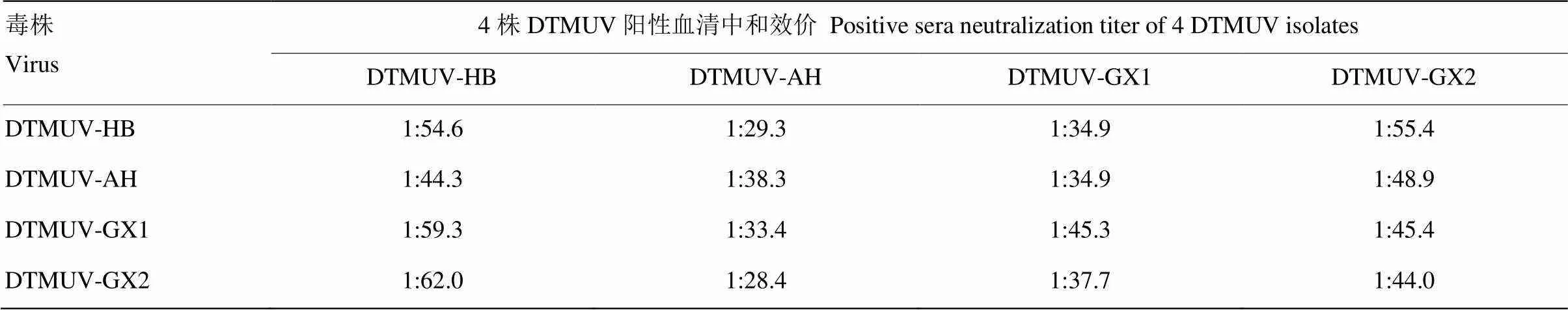
表4 4株DTMUV的细胞交叉中和试验
本研究选用的毒株均为从发病鸭场分离得到,时间跨度从2010—2016年,分布地点有河北、河南、安徽和广西等地。从ELD50和对鸭的人工感染试验来看,病毒含量范围在104.7—105.3ELD50/0.1mL,人工感染鸭的病毒分离阳性率均在85%以上,4株DTMUV对易感动物的毒力没有明显差异,与课题组前期的研究结果一致[29, 32-33]。多名研究人员也进行了动物回归试验,所得的试验结果与本文基本一致。于可响[34]对2010年到2012年分离的6株病毒进行了ELD50的测定,范围在105.0—105.5ELD50/0.2mL。2015年范萍萍[35]利用安徽铜陵分离株进行了动物回归试验,同样也是在攻毒后第3天采食量、产蛋量开始下降,剖检鸭卵巢萎缩、脾脏肿胀、胰脏出血等病变。
目前多篇关于鸭坦布苏病毒株基因序列分析的研究表明,不同地区、不同时间的分离株基因组并无显著性差异,尚未发生较大变异。万春和等[36]发现不同来源(鸡源、鸭源、鹅源、鸽源和蚊源)坦布苏病毒E基因同源性均较高,未发现该病毒在不同家禽之间有明显宿主特异性。张帅[37]2010—2012年通过对包括其实验室分离的ZJ-407、YY5、ZJ-06在内的35株DTMUV基因序列进行比对分析,发现不同来源的各株病毒之间核酸和氨基酸的同源性分别为97.0%—100%和97.4%— 100%,不同来源的鸭坦布苏病毒之间E蛋白基因未发生明显改变。这与本文对于实验室分离毒株E基因的分析结果一致。
R值判定是用于两种抗原物质相似程度的有效方法,可用于不同物种蛋白抗原相似性的分析。本文通过不同抗原与各自的抗体进行交叉反应,采用R值分析方法,经数学处理扣除试验误差,定量给出试验用毒株抗原的相似程度。从交叉血凝抑制试验、细胞交叉中和试验2个方面对分离的4株DTMUV抗原性作比较分析,其R值范围分别为0.79—1.12和0.79—1.20,抗原比值均大于0.67,根据抗原相关性判定标准可初步判断试验用DTMUV没有明显的抗原性差异。该结论与本研究进行的对试验动物毒力、E基因序列比对及同源性分析结论相符。YU[28]等利用2010—2012年分离的病毒株进行了血清交叉中和试验,结果表明分离毒株为同一血清型。与本文的研究结果一致。
关于鸭坦布苏病毒抗体的检测方法有ELISA[38-39]、乳胶凝集试验[40]、中和试验等,尚未见有HI抗体测定方法的报道。本研究利用实验室建立的HI试验方法对血清中的HI抗体和中和抗体的相关性同时做了比较,从试验结果来看具有良好的相关性,相比ELISA方法和中和试验法,HI抗体检测法具有可靠、简单、用时短和不需要特殊设备等优点,可用于该病的诊断和疫苗效力检验的替代检验方法。
4 结论
目前,DTMUV还没有发现其他血清型,本文试验研究所用的4株DTMUV在毒力、E基因序列和抗原性上没有明显的差异,提示我们目前国内流行的毒株还未产生较大的变异。应坚持进行流行病学调查和疫情监控,监测该病毒的变异趋势。但目前来说,不论是利用发病早期分离的毒株制备的疫苗,还是经过弱化的弱毒苗,或是基因工程疫苗,都可以有效控制鸭坦布苏病毒病的发生和流行,是预防和控制本病最经济有效的办法。
[1] CAO Z, ZHANG C, LIU Y, LIU Y, YE W, HAN J, MA G, ZHANG D, XU F, GAO X, TANG Y, SHI S, WAN C, ZHANG C, HE B, YANG M, LU X, HUANG Y, DIAO Y, MA X, ZHANG D. Tembusu virus in ducks, china., 2011, 17(10): 1873-1875.
[2] SU J, LI S, HU X, YU X, WANG Y, LIU P, LU X, ZHANG G, HU X, LIU D, LI X, SU W, LU H, MOK N S, WANG P, WANG M, TIAN K, GAO G F. Duck egg-drop syndrome caused by BYD virus, a new Tembusu-related flavivirus., 2011, 6(3):e18106.
[3] YAN P, ZHAO Y, ZHANG X, XU D, DAI X, TENG Q, YAN L, ZHOU J, JI X, ZHANG S, LIU G, ZHOU Y, KAWAOKA Y, TONG G, LI Z. An infectious disease of ducks caused by a newly emerged Tembusu virus strain in mainland China., 2011, 417(1): 1-8.
[4] 曹贞贞, 张存, 黄瑜, 刁有祥, 叶伟成, 刘月焕, 韩婧文, 马国明, 张冬冬, 许丰, 王丹, 姜甜甜, 袁媛, 谢小雨, 高绪慧, 唐熠, 施少华, 万春和, 张晨, 何玢, 杨梦婕, 陆新浩, 张冰, 张国中, 马学军, 张大丙. 鸭出血性卵巢炎的初步研究. 中国兽医杂志, 2010, 46(12): 3-6.
CAO Z Z, ZHANG C, HUANG Y, DIAO Y X, YE W C, LIU Y H, HAN J W, MA G M, ZHANG D D, XU F, WANG D, JIANG T T, YUAN Y, XIE X Y, GAO X H, TANG Y, SHI S H, WAN C H, ZHANG C, HE B, YANG M J, LU X H, ZHANG B, ZHANG G Z, MA X J, ZHANG D B. Preliminary studies on duck hemorrhagic ovaritis., 2010, 46(12):3-6.(in Chinese)
[5] 廖敏, 牟小东, 耿阳, 边葶苈, 陆新浩, 陈秋英, 任祖伊, 丁铲, 周继勇. 鸭传染性产蛋减少症(暂定名)的病原分离初报. 中国动物传染病学报, 2011,19(1):22-26.
LIAO M, MOU X D, GENG Y, BIAN T L, LU X H, CHEN Q Y, REN Z Y, DING C, ZHOU J Y. The primary study on virus isolation of duck infectious egg fallings., 2011, 19(1):22-26.(in Chinese)
[6] 李玉峰, 马秀丽, 于可响, 王友令, 高巍, 黄兵, 徐怀英, 吴静, 王生雨, 王莉莉, 秦卓明. 一种从鸭新分离的黄病毒研究初报. 畜牧兽医学报, 2011(6):885-891.
LI Y F, MA X L, YU K X, WANG Y L, GAO W, HUANG B, XU H Y, WU J, WANG S Y, WANG L L, QIN Z M. A brief report of flaviviruses newly isolated from duck., 2011(6):885-891.(in Chinese)
[7] 朱丽萍, 颜世敢. 鸭坦布苏病毒研究进展. 中国预防兽医学报, 2012, 34(1):79-82.
ZHU L P, YAN S G. Progress of duck Tembusu Virus., 2012, 34(1):79-82.(in Chinese)
[8] 张大丙. 鸭出血性卵巢炎的研究进展. 中国家禽, 2011, 33(14): 37-38.
ZHANG D B. Research progress of Duck hemorrhagic ovaritis., 2011, 33(14):37-38.(in Chinese)
[9] PLATT G S, WAY H J, BOWEN E T, SIMPSON D I, HILL M N, KAMATH S, BENDELL P J, HEATHCOTE O H. Arbovirus infections in Sarawak, October 1968-February 1970 Tembusu and Sindbis virus isolations from mosquitoes., 1975, 69(1):65-71.
[10] LEAKE C J, USSERY M A, NISALAK A, HOKE C H, ANDRE R G, BURKE D S. Virus isolations from mosquitoes collected during the 1982 Japanese encephalitis epidemic in northern Thailand., 1986, 80(5):831-837.
[11] PANDEY B D, KARABATSOS N, CROPP B, TAGAKI M, TSUDA Y, ICHINOSE A, IGARASHI A. Identification of a flavivirus isolated from mosquitos in Chiang Mai Thailand., 1999, 30(1):161-165.
[12] KONO Y, TSUKAMOTO K, ABD H M, DARUS A, LIAN T C, SAM L S, YOK C N, Di KB, LIM K T, YAMAGUCHI S, NARITA M. Encephalitis and retarded growth of chicks caused by Sitiawan virus, a new isolate belonging to the genus Flavivirus., 2000, 63(1/2):94-101.
[13] YUN T, ZHANG D, MA X, CAO Z, CHEN L, NI Z, YE W, YU B, HUA J, ZHANG Y, ZHANG C. Complete genome sequence of a novel flavivirus, duck tembusu virus, isolated from ducks and geese in china., 2012, 86(6):3406-3407.
[14] 万春和, 施少华, 傅光华, 梁昭平, 王斌, 程龙飞, 李敏, 陈红梅, 林芳, 林建生, 王鑫, 许芬芬, 黄瑜. 鸭黄病毒油乳剂灭活疫苗研制及免疫效果测定. 养禽与禽病防治, 2011(10): 20-22.
WAN C H, SHI S H, FU G H, LIANG Z P, WANG B, CHENG L F, LI M, CHEN H M, LIN F, LIN J S, WANG X, XU F F, HUANG Y. Immune effectiveness of the oil-emulsion inactivated vaccine against duck Tembusu virus., 2011(10):20-22.(in Chinese)
[15] 李振华, 李小康, 郭香玲, 张春杰, 刘凤军, 王臣. 鸭坦布苏病毒灭活油乳苗的制备及免疫效力测定. 中国预防兽医学报, 2013, 35(5):388-391.
LI Z H, LI X K, GUO X L, ZHANG C J, LIU F J, WANG C. Immune effectiveness of the oil-emulsion inactivated vaccine against duck Tembusu virus., 2013, 35(5):388-391.(in Chinese)
[16] CHEN P, LIU J, JIANG Y, ZHAO Y, LI Q, WU L, HE X, CHEN H. The vaccine efficacy of recombinant duck enteritis virus expressing secreted E with or without PrM proteins of duck tembusu virus., 2014, 32(41):5271-5277.
[17] LI G, GAO X, XIAO Y, LIU S, SHAN P, LI X, YING S, ZHANG Y, LEI Y, WU X. Development of a live attenuated vaccine candidate against duck Tembusu viral disease., 2014, 450–451(1): 233-242.
[18] SUN L, LI Y, YUE Z, HAN Z, YANG X, KONG X, LIU S. Adaptation and attenuation of duck Tembusu virus strain Du/CH/ LSD/110128 following serial passage in chicken embryos., 2014, 21(8):1046-1053.
[19] ZOU Z, LIU Z, JIN M. Efficient strategy to generate a vectored duck enteritis virus delivering envelope of duck Tembusu virus., 2014, 6(6):2428-2443.
[20] LIN J, LIU Y, WANG X, YANG B, HE P, YANG Z, DUAN H, XIE J, ZOU L, ZHAO J. Efficacy evaluation of an inactivated duck Tembusu virus vaccine., 2015, 59(2):244-248.
[21] MA T, LIU Y, CHENG J, LIU Y, FAN W, CHENG Z, NIU X, LIU J. Liposomes containing recombinant E protein vaccine against duck Tembusu virus in ducks., 2016, 34(19):2157-2163.
[22] 刘友生, 彭春香, 傅光华, 侯东军, 施少华, 万春和, 程龙飞, 陈红梅, 林建生, 林芳, 黄瑜. 2010~2011年中国部分地区禽坦布苏病毒感染调查及分子变异分析. 中国动物传染病学报, 2012(1): 47-53.
LIU Y S, PENG C X, FU G H, HOU D J, SHI S H, WAN C H, CHENG L F, CHEN H M, LIN J S, LIN F, HUANG Y. Detection and molecular analysis of avian Tembusu virus partial areas of China from 2010 to 2011., 2012(1): 47-53.(in Chinese)
[23] 傅光华, 黄瑜, 程龙飞, 万春和, 施少华, 傅秋玲, 陈红梅, 林建生, 林芳. 坦布苏病毒鸡源分离株全基因组及遗传变异分析. 中国兽医学报, 2014(9):1418-1422.
FU G H, HUANG Y, CHENG L F, WAN C H, SHI S H, FU Q L, CHEN H M, LIN J S, LIN F. Genome sequence and phylogenetic analysis of Tembusu viruses isolated from chicken., 2014(9):1418-1422.(in Chinese)
[24] 王钰, 王经满, 曹瑞兵. 鸭坦布苏病毒XZ-2012株的分离鉴定与基因变异分析. 南京农业大学学报, 2015(3):446-452.
WANG Y, WANG J M, CAO R B. Isolation and gene variation character of duck Tembusu virus strain XZ-2012., 2015(3):446-452.(in Chinese)
[25] 韦天超, 农海连, 潘超, 李秀凤, 蒋桂林, 程二财, 苑亚东, 磨美兰, 韦平. 鸭坦布苏病毒GX150829株的分离鉴定与E基因的序列分析. 中国家禽, 2016(7):19-22.
WEI T C, NONG H L, PAN C, LI X F, JIANG G L, CHENG E C, YUAN Y D, MO M L, WEI P. Isolation and identification of Duck Tembusu virus GX150829 strain and sequence analysis of E Gene., 2016(7):19-22.(in Chinese)
[26] 王楠楠, 姜安安, 王蓓, 王晓旭, 毕庄莉, 唐井玉, 刘光清, 王桂军. 鸭坦布苏病毒AH-F10株全基因组的分子克隆与序列分析. 中国兽医科学, 2014(1):50-54.
WANG N N, JIANG A A, WANG B, WANG X X, BI Z L, TANG J Y, LIU G Q, WANG G J. Molecular cloning and sequence analysis of the complete genome of duck Tembusu virus AH-F10 strain., 2014(1):50-54.(in Chinese)
[27] GOULD E A, MOSS S R, TURNER S L. Evolution and dispersal of encephalitic flaviviruses., 2004(18): 65-84.
[28] YU K, SHENG Z Z, HUANG B, MA X, LI Y, YUAN X, QIN Z, WANG D, CHAKRAVARTY S, LI F, SONG M, SUN H. Structural, antigenic, and evolutionary characterizations of the envelope protein of newly emerging Duck Tembusu Virus., 2013,8(8): e71319.
[29] 谢佳, 韩春华, 林健, 段会娟, 杨志远, 赵际成, 潘洁, 刘月焕. 鸭出血性卵巢炎病毒血症研究. 中国农业科学, 2014(23):4763-4768.
XIE J, HAN C H, LIN J, DUAN H J, YANG Z Y, ZHAO J C, PAN J, LIU Y H. Study on viremia of the ducks infected with DHOV-HB strain., 2014(23):4763-4768.(in Chinese)
[30] CLARKE D H, CASALS J. Techniques for hemagglutination and hemagglutination-inhibition with arthropod-borne viruses., 1958, 7(5):561-573.
[31] ARCHETTI I, HORSFALL F J. Persistent antigenic variation of influenza A viruses after incomplete neutralization in ovo with heterologous immune serum., 1950, 92(5):441-462.
[32] 林健, 杨志远, 何平有, 段会娟, 邹立宏, 杨保收, 赵际成, 潘洁, 王小蕾, 刘立新, 刘月焕. 鸭坦布苏病毒病卵巢病变标准的判定. 中国农业科学, 2016(14):2830-2836.
LIN J, YANG Z Y, HE P Y, DUAN H J, ZOU L H, YANG B S, ZHAO J C, PAN J, WANG X L, LIU L X, LIU Y H. Criterion of ovarian lesions of duck Tembusu virus disease., 2016(14):2830-2836.(in Chinese)
[33] 林健, 韩春华, 陈华林, 蒋桃珍, 梁武, 何平有, 杨保收, 王英, 韩婧雯, 刘东艳, 潘洁, 段会娟, 丁佩佩, 胡胜强, 刘月焕. 鸭出血性卵巢炎实验感染模型的建立. 中国农业科学, 2011(10): 2161-2167.
LIN J, HAN C H, CHEN H L, JIANG T Z, LIANG W, HE P Y, YANG B S, WANG Y, HAN J W, LIU D Y, PAN J, DUAN H J, DING P P, HU S Q, LIU Y H. Establishment of experimental infection model of duck hemorrhagic ovaritis., 2011(10):2161-2167.(in Chinese)
[34] 于可响. 鸭坦布苏病毒生物学特性、基因组特征、诊断方法以及感染性克隆的研究[D]. 扬州: 扬州大学, 2013.
YU K X. Study on biological characteristics, genome analysis, diagnosis methods and infectious clone for newly emerged duck Tembusu virus[D]. Yangzhou: Yangzhou University, 2013. (in Chinese)
[35] 范萍萍. 鸭坦布苏病毒铜陵株的分离与鉴定[D]. 合肥: 安徽农业大学, 2016.
FAN P P. Isolation and identification of duck Tembusu virus TongLing strain[D]. Hefei: Anhui Agricultural University, 2016.(in Chinese)
[36] 万春和, 施少华, 黄瑜. 禽坦布苏病毒包膜蛋白E的基因特征. 福建农业学报, 2014(8):715-719.
WAN C H, SHI S H, HUANG Y. Genetic feature of the envelop protein of avian Tembusu virus., 2014(8):715-719.(in Chinese)
[37] 张帅. 鸭坦布苏病毒的分子生物学快速诊断与E蛋白基因变异性分析[D]. 泰安: 山东农业大学, 2012.
ZHANG S. Rapid diagnosis of DTMUV based on molecular techniques and the variability analysis of DTMUV E gene[D]. Taian: Shandong Agricultural University, 2012. (in Chinese)
[38] 姬希文, 闫丽萍, 颜丕熙, 李国新, 张七斤, 李泽君. 鸭坦布苏病毒抗体间接ELISA检测方法的建立. 中国预防兽医学报, 2011, 33(8):630-634.
JI X W, YAN L P, YAN P X, LI G X, ZHANG Q J, LI Z J. Establishment of an indirect ELISA for detection of antibody against duck Tembusu virus., 2011, 33(8):630-634.(in Chinese)
[39] LI X, LI G, TENG Q, YU L, WU X, LI Z. Development of a blocking ELISA for detection of serum neutralizing antibodies against newly emerged duck Tembusu virus., 2012, 7(12):83.
[40] WANG Q, WEN Y, YIFAN H, WU Y, CAI Y, XU L, WANG C, LI A, WU B, CHEN J. Isolation and identification of duck tembusu virus strain lH and development of latex-agglutination diagnostic method for rapid detection of antibodies., 2014, 58(4):616-622.
Virulence, E Gene Sequence and Antigenic Difference of 4 Duck Tembusu Virus Isolations
YANG ZhiYuan, DUAN HuiJuan, WANG XiaoLei, LIU LiXin, ZHAO JiCheng, PAN Jie, LIU YueHuan, LIN Jian
(Institute of Animal Husbandry and Veterinary Medicine, Beijing Academy of Agricultural and ForestrySciences, Beijing 100097)
【】The research aimed to compare the virulence of Duck Tembusu Virus (DTMUV), and to analysis its envelope protein gene sequence analysis and antigenic difference. 【】Susceptible 10-day-old duck embryos were inoculated with four different DTMUV strains, including DTMUV-HB isolated in 2011, DTMUV-AH isolated in 2014, DTMUV-GX1 isolated in 2012 and DTMUV-GX2 isolated in 2015. The median embryo lethal dose (ELD50) of the four strains was measured with 6-day-old SPF chicken embryos. According to that, forty 180-day-old healthy Peking duck were challenged respectively with four strains which were diluted into 100 ELD50/0.5 ml. The clinical, virological, pathological features of different DTMUV strains infection in ducks were characterized. The viral RNA of eight DTMUV strains were extracted from the allantoic fluid, and then the E gene were amplified by RT-PCR and sequenced. Then the similarity analysis of nucleotide and amino acid sequence and phylogenetic analysis were carried out. The HI titers of 4 antisera against 4 DTMUV strains were determined with duck tembusu virus hemagglutination inhibition test. The neutralization titers of 4 antisera against 4 DTMUV strains were determined by neutralization assay using C6/36 cell lines. We analyzed the antigenic difference of 4 DTMUV strains by R value, which contained cross hemagglutination inhibition test and cell cross neutralization test. 【】(1) The median embryo lethal dose (ELD50) were 10-4.7-10-5.3/0.1ml. The artificial infection test suggested that, feed intake and egg production of the challenged group decreased significantly on 3 days post inoculation (dpi), and the virus positive isolation rate were more than 85% on 2 dpi. The gross lesions of the reproductive system were mainly deformed and hemorrhaged follicular by necropsying on 8 dpi. (2) The results of sequence analysis showed that nucleotide sequence similarity was 95.7% - 100%, and the similarity of amino acid sequence was 98.2%. Genetic evolutionary analysis illustrated that all the DTMUV isolates in this study gathered into the same clade. (3) The R value showed antigenic difference of cross hemagglutination inhibition test were 0.79-1.12, and that of cell cross neutralization test were 0.79-1.20. 【】There were no significant difference in virulence, E gene sequence and antigenicity of four DTMUV strains isolated in this study.
Duck Tembusu virus; virulence; envelope protein gene; antigenicity

10.3864/j.issn.0578-1752.2019.23.021
2019-04-23;
2019-06-28
国家重点研发计划项目(2016YFD05008006)、北京市农林科学院青年科研基金(QNJJ201516)
杨志远,E-mail:yangzy88@126.com。
林健,Tel:010-51503475;E-mail:dblinjian@sina.com
(责任编辑 林鉴非)
