苹果乙烯响应因子MdERF72对非生物胁迫的响应
2020-01-14王佳慧顾凯迪王楚堃由春香胡大刚郝玉金
王佳慧,顾凯迪,王楚堃,由春香,胡大刚,郝玉金
苹果乙烯响应因子对非生物胁迫的响应
王佳慧,顾凯迪,王楚堃,由春香,胡大刚,郝玉金
(山东农业大学园艺科学与工程学院/作物生物学国家重点实验室/农业部黄淮地区园艺作物生物学与种质创制重点实验室,山东泰安 271018)
【】乙烯响应因子(ethylene response factor,ERF)是植物特有的一类转录因子,参与植物根系形成、下胚轴伸长、果实成熟、器官衰老等生长发育过程,在调节植物生物和非生物胁迫反应及果实品质过程中发挥着至关重要的作用。克隆苹果乙烯响应因子,通过表达分析和转基因功能分析,研究其在抵御非生物胁迫过程中的功能,为探索在植物生长发育过程中的功能提供理论依据。以‘王林’苹果(×Borkh.)愈伤组织为试材,利用RT-PCR技术克隆,利用生物信息学方法分析其编码氨基酸序列组成、蛋白质理化性质、亲缘关系、空间结构等,并利用MEGA5.0构建系统进化树,与拟南芥ERF-B2亚家族进行蛋白序列同源性分析;利用实时荧光定量PCR技术探明其在苹果组织中的表达和果实发育时期的时空表达特征;同时利用实时荧光定量PCR技术检测‘嘎拉’苹果组培苗中对ACC、NaCl以及低温的响应;构建基因的过表达载体,通过农杆菌介导的遗传转化获得稳定遗传的过表达苹果愈伤组织;检测NaCl以及低温处理后,野生型和转基因苹果愈伤组织的鲜重、丙二醛含量、电导率、过氧化氢含量以及超氧阴离子含量的差异。位于苹果第13号染色体上,该基因存在1个ERF家族特有的AP2/ERF结构域。进化树分析结果显示,与拟南芥序列同源性较高,都属于ERFs家族的B2亚家族。氨基酸理化性质分析表明,编码253个氨基酸,预测其蛋白质分子量为27.61 kD,等电点(pI)为5.10。另外,亲疏水预测结果显示疏水部分大于亲水部分,表明其属于疏水性蛋白。磷酸化位点分析显示,只有苏氨酸磷酸化位点,表明该蛋白可能受到磷酸化作用的调控。启动子序列中含有与茉莉酸(JA)、生长素及干旱信号相关的顺式作用元件。是乙烯正调控转录因子,在苹果的各组织中均有表达,在果实和茎中表达量相对较高;并且在果实中随着果实的成熟,表达量逐渐升高。苹果组培苗中的表达明显受到高盐和低温的诱导。过量表达的苹果愈伤组织在高盐和低温胁迫处理下,生长势明显比野生型对照强,电导率,丙二醛、过氧化氢、超氧阴离子的含量都低于野生型,表明提高了对盐和低温胁迫的抗性。在响应高盐、低温胁迫过程中发挥着重要的正调控作用,过表达可以提高苹果愈伤组织对高盐和低温胁迫的抗性。
苹果;;乙烯响应因子;胁迫应答
0 引言
【研究意义】植物在生长发育过程中会遭受许多环境胁迫,如土壤盐渍化导致的盐胁迫和极端天气引发的温度胁迫等。盐胁迫是自然界普遍存在的非生物胁迫之一,盐碱化土壤中NaCl和MgCl2等可溶性盐的过量积累对植物造成离子胁迫,从而影响植物的正常生长发育过程[1]。低温胁迫是植物栽培中常常遇到的一种胁迫,它对植物的影响主要体现在酶活性、膜系统、细胞失水等,轻则导致作物产量下降,严重时会导致植株死亡。前人研究发现,ERF类转录因子具有调控高盐、低温等胁迫相关基因表达的功能[2]。因此,研究ERF类转录因子对改良植物对盐及温度胁迫的耐性,从而提高作物的抗逆性具有重要的理论意义。【前人研究进展】ERF转录因子是AP2/ERF家族中的一个亚家族,每个成员都含有1个由大约60个氨基酸组成的非常保守的DNA结合域。ERF转录因子在多种植物中广泛存在,拟南芥中发现124个ERF家族基因[3],水稻中有139个ERF家族基因[4]。近年来,在烟草[5]、玉米[6]、番茄[7]等植物中也分离出这类家族基因。关于ERF转录因子调控机理及抗逆胁迫功能的研究,在模式植物拟南芥、水稻、大豆等植物中已经有大量报道。研究证明ERFs家族基因受高盐、机械损伤、低氧、温度、氧化胁迫等非生物胁迫诱导。许多ERF转录因子在不同植物中异源表达能增强植株对非生物胁迫的抗性[8]。其中,DREB蛋白对非生物胁迫响应的研究较为透彻。过表达拟南芥中的提高了油菜的抗寒性[9],相反,拟南芥或的RNAi株系削弱了植物的耐寒力[10]。在番茄、烟草和水稻中异源表达拟南芥基因可以提高植物耐寒性[11-14]。玫瑰亚家族基因在拟南芥中被冷胁迫迅速诱导[15]。蒺藜苜蓿转入蒺藜状苜蓿和中国玫瑰中也分别提高了转基因植株对寒冷的耐受性[16]。在番茄中异位超表达烟草可以提高对低温胁迫的耐受能力,而反义表达的番茄植株则对低温耐受力降低[17]。在盐胁迫方面,植物ERF家族基因中甘蔗[18]、水稻和[19]、大麦[20]、甘薯和[21]等对盐胁迫均有响应。刘文奇等[22]研究发现,ERF类基因转入烟草中可以提高抗盐能力。【本研究切入点】目前,虽然在拟南芥及水稻等植物中鉴定了ERF家族部分成员的功能,例如在抵抗辣椒疫霉病、黄瓜花叶病[23]等生物胁迫和高盐、低温、干旱等非生物胁迫方面发挥着重要功能,但是,苹果中有关的相关报道较少。前期研究发现,小金海棠负调控苹果缺铁响应[24],但苹果中对非生物胁迫的响应尚未有研究。【拟解决的关键问题】本研究通过转基因技术获得过表达苹果愈伤组织,在对的表达量与高盐、低温等非生物胁迫之间的关联分析基础上,探究对非生物胁迫的响应,进一步了解的功能,为苹果砧木的遗传改良提供参考。
1 材料与方法
试验于2018年在山东农业大学作物生物学国家重点实验室进行。
1.1 植物材料与处理
2018年5月开始对树龄9年的实生‘嘎拉’的生长根、茎、叶片、花(初花期)和果实(花后60、90、120、150、180、210和230 d)进行取样。根主要取自当年生新生根,茎和叶取自于当年生春梢新梢及梢部叶片,花为初花期整个花序,为保证一致性,取样时所有材料均取自一棵树,并且3个不同样品作为重复。
‘嘎拉’苹果组培苗培养在固体培养基[30 g·L-1蔗糖+4.7 g·L-1MS+0.2 mg·L-1indole-3-acetic acid(IAA)+0.5 mg·L-16-Benzylaminopurine(6-BA)+8 g·L-1琼脂(pH 6.0)]上。用50 μmol·L-1乙烯合成前体1-氨基环丙烷羧酸(1-aminocyclopropanecarboxylic acid,ACC)、100 μmol·L-1NaCl和4℃低温分别处理生长状况良好的组培苗,分别于处理0、1、3、6、12和24 h取样,提取RNA并反转录后利用实时荧光定量PCR的方法检测的表达水平。
‘王林’苹果愈伤组织培养在固体培养基[30 g·L-1蔗糖+4.74 g·L-1MS+0.5 mg·L-16-BA+1 mg·L-12,4-D+8 g·L-1琼脂(pH 6.0)]上,黑暗培养,温度25℃。
1.2 总RNA的提取和定量分析
采用韩朋良等[25]的方法提取RNA并反转录得到cDNA。然后以cDNA为模板,以5′-CCACCATCCTC TTCACCG-3′和5′-CACCCGCCACCTCTTTCT-3′为特异性引物,检测苹果中的表达水平。
采用张全艳等[26]方法进行荧光定量PCR反应,每样本进行3次重复。最后采用2-∆∆CT法进行定量数据分析。
1.3 MdERF72的克隆
以-F(5′-ATGTGTGGTGGTGCTATCA TTTCCG-3′)和-R(5′-ATACAGAAGCT GCCCTTGTTGCTG-3′)分别为上、下游引物,‘嘎拉’组培苗叶片的cDNA为模板进行PCR扩增。反应体系为25 μL:其中ddH2O 17.25 μL,dNTPs(2 mmol·L-1)2 μL,HiFi buffer I 2.5 μL,上、下游引物(10 μmol·L-1)各1 μL,cDNA模板1 μL,HiFiTaq DNA Polymerase0.25 μL。
1.4 MdERF72的生物信息学分析
利用NCBI数据库(http://www.ncbi.nlm.nih.gov/)下载及拟南芥中ERF-B2亚家族中的基因;用DNAMAN 6.0进行多序列氨基酸同源性比较并用MEGA 5.0构建系统发育树;用ProtParam工具预测蛋白质分子量与理论等电点;分别在PlantCARE(http:// bioinformatics.psb.ugent.be/webtools/plantcare/html/)、ProtScale(http://web.expasy.org/cgi-bin/protscale/ protscale.pl)和Netphos 3.1 Serve(http://www.cbs. dtu.dk/services/NetPhos/)上分析启动子上的顺式作用元件,氨基酸的亲/疏水性以及预测蛋白质磷酸化位点。
1.5 植物表达载体构建及农杆菌介导的苹果愈伤组织遗传转化
参照Hu等[27]的方法对‘王林’苹果的愈伤组织进行遗传转化。
1.6 NaCl和低温处理苹果愈伤组织相关指标测定
将生长良好的野生型和转基因‘王林’苹果愈伤组织在25℃常温及4℃低温下处理。在暗处培养,分别于0、5、10和15 d测量鲜重、丙二醛(MDA)含量、相对电导率、过氧化氢(H2O2)含量及超氧阴离子(OFR)含量。
将‘王林’苹果野生型和过量表达愈伤组织分别铺于愈伤固体培养基、添加100 mmol·L-1NaCl的愈伤固体培养基和添加150 mmol·L-1NaCl的愈伤固体培养基,在暗处培养一段时间后,观察表型及检测相关指标。
苹果愈伤组织中MDA含量采用硫代巴比妥酸法[28]测定,相对电导率采用崔之益等[29]的方法。过氧化氢(H2O2)含量及超氧阴离子含量(OFR)分别用过氧化氢(H2O2)测试盒(科铭生物,苏州,中国)、超氧阴离子(OFR)试剂盒(科铭生物,苏州,中国)进行检测。
1.7 数据统计与分析
使用DPS统计软件Tukey法对试验数据进行差异显著性分析(<0.05)。
2 结果
2.1 MdERF72全长的克隆
以‘嘎拉’苹果组培苗cDNA为模板,- F和-R为上、下游引物进行基因克隆。结果(图1)显示,PCR扩增获得了1条约750 bp的条带。测序发现,该基因包含长为759 bp完整的开放阅读框。与预测结果一致,可用于后续试验。
2.2 MdERF72生物信息学分析
在AppleGFDB(http://www.applegene.org/blastp. asp)数据库中检索的序列号MDP0000128979,发现位于苹果第13号染色体上,含有一个内含子。保守结构域分析表明,该基因含有1个ERF转录因子家族特有的AP2/ERF结构域(图2),因此,推断该基因为植物ERF转录因子家族成员。

图1 MdERF72 PCR扩增
用MEGA5.0软件最大似然法,对NCBI登录的拟南芥AtERF-B2亚家族的5个蛋白与MDP0000128979进行系统进化分析。结果发现,苹果ERF蛋白(MDP0000128979)与拟南芥AtERF72(At3g16770)亲缘关系最近(图3),因此将该基因命名为。
氨基酸理化性质分析表明,MdERF72编码253个氨基酸,预测其蛋白质分子量为27.61 kD,等电点(pI)为5.10。另外,亲疏水预测结果显示MdERF72疏水部分大于亲水部分,表明其属于疏水性蛋白。磷酸化位点分析显示,MdERF72只有苏氨酸磷酸化位点,表明该蛋白可能受到磷酸化作用的调控。

图2 MdERF72及其同源基因的氨基酸序列比对分析

图3 苹果ERF蛋白MDP0000128979与拟南芥ERF-B2家族蛋白系统进化树分析
2.3 MdERF72启动子顺式作用元件分析
PlantCARE分析发现启动子序列含有多个与抗逆性相关的调控元件:低温响应元件LTR,厌氧胁迫相关顺式作用元件ARE,干旱胁迫相关顺式作用元件MBS;另外,还发现了不同激素响应作用元件:生长素调节相关顺式作用元件TGA-box,茉莉酸响应顺式作用元件TGACG-motif core以及调节植物生长发育相关的光响应顺式作用元件Sp1(表1)。

表1 MdERF72基因启动子重要顺式作用元件分析
2.4 苹果中MdERF72的表达分析
用50 μmol·L-1ACC处理‘嘎拉’苹果组培苗后,实时荧光定量PCR检测的相对表达水平。结果表明,表达量相比对照明显升高,说明是乙烯正调控转录因子(图4)。
通过实时定量PCR检测在‘嘎拉’苹果生长根、茎、叶、花、果实(花后60 d)中的相对表达水平。结果表明,在根、茎、叶、花、果实中均有表达,但茎和果实中的表达量较高(图5)。因此,检测了处于不同成熟阶段的果实中的相对表达量。结果发现,随着果实成熟,的表达量逐渐升高,在230 d达到顶峰(图6)。
2.5 ‘嘎拉’组培苗中MdERF72对NaCl及4℃低温胁迫的响应
100 mmol·L-1NaCl以及4℃低温处理‘嘎拉’苹果组培苗后,于0、1、3、6、12和24 h取样后进行qRT-PCR分析。结果表明,在NaCl以及4℃低温处理后,随处理时间增加,表达量逐渐升高,在NaCl处理1 h达到最高值(图7-A),4℃低温处理6 h时达到顶峰(图7-B)。

不同字母在0.05水平上有显著差异。下同 Different letters indicate significant difference at 0.05 levels. The same as below

图5 MdERF72在苹果不同组织中的相对表达水平
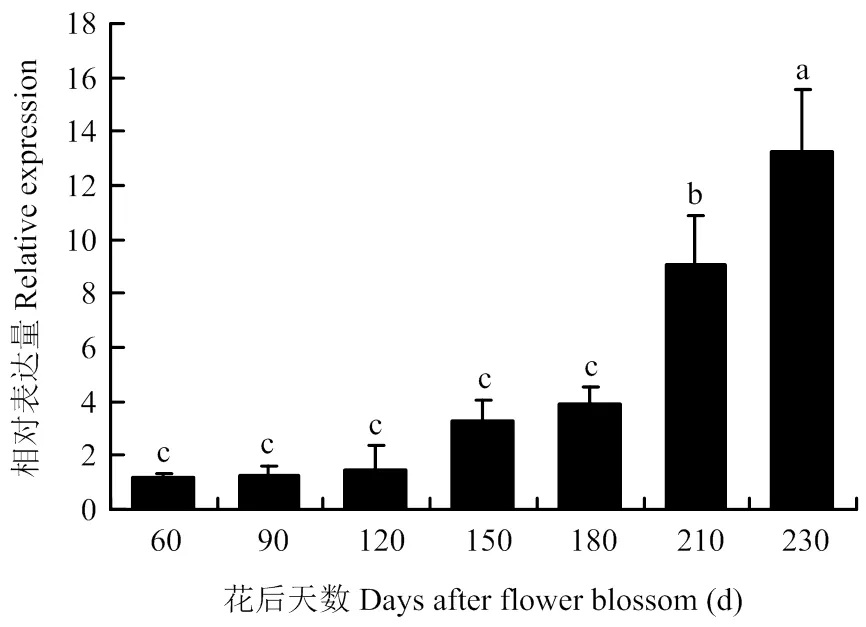
图6 MdERF72在苹果不同发育时期的相对表达水平
2.6 农杆菌介导的苹果愈伤组织的遗传转化
构建::过表达载体,通过农杆菌介导的方法侵染‘王林’苹果愈伤组织。获得3个转基因愈伤组织(图8),分别命名为-OE1、-OE2、-OE3。

图7 ‘嘎拉’组培苗中MdERF72对NaCl(A)和4℃(B)低温的响应
2.7 过量表达MdERF72苹果愈伤组织对NaCl及4℃低温胁迫的抗性
将过量表达苹果愈伤组织(OE1、OE2、OE3)与野生型愈伤组织(WT)分别用0、100和150 mmol·L-1NaCl的培养基处理。结果发现,在含有100和150 mmol·L-1NaCl的培养基上培养15 d(图9),3个过表达愈伤组织的生长速率均高于野生型(图10-A)、丙二醛含量(图10-B)、相对电导率(图10-C)、过氧化氢含量(图10-D)和超氧阴离子含量(图10-E)都低于野生型,表明可以提高转基因苹果愈伤组织对高盐胁迫的抗性。

图8 MdERF72转基因苹果愈伤组织的鉴定
同样将过量表达苹果愈伤组织(OE1、OE2和OE3)与野生型愈伤组织(WT)分别在25℃和4℃培养,结果发现,在4℃培养15 d后(图11),3个过表达愈伤组织的生长速率都高于野生型(图12-A),丙二醛含量(图12-B)、相对电导率(图12-C)、过氧化氢含量(图12-D)和超氧阴离子含量(图12-E)都低于野生型,表明转基因苹果愈伤组织对低温胁迫抗性提高。
3 讨论
苹果是世界上最重要的经济作物之一。中国是世界上苹果种植面积最大、产量最高的国家,随着国际农业合作力度的不断加深,我国也成为世界上苹果及相关加工品主要出口国之一。然而,近年来极端天气频发,苹果的生长面临着严峻的考验,其中盐碱化、干旱、低温等胁迫对苹果的产量和品质造成了严重损伤,因此,选育抗盐、抗旱、耐寒的优良苹果砧木是目前所要解决的关键问题。
面对复杂的环境变化,植物通过一系列的信号传递和能量代谢抵御外界不良环境的侵害。在这一过程中,转录因子发挥着重要的调控作用。因此,研究转录因子的功能,对提高植物的抗逆性及选育优良品种具有重要意义。乙烯应答因子是植物特有的一类转录因子,与生物/非生物胁迫密切相关。例如,在水稻和菊花中过表达,可以提高转基因植株在干旱、高盐和低温胁迫处理下的耐受性[30-32];在烟草中过表达可以提高对烟草花叶病毒的抗性[33];在烟草中过表达陆地棉可以提高对赤星病的抗性[34]。关于苹果中的功能,前人研究发现,苹果参与茉莉酸(JA)介导的果实成熟[35]。然而,苹果中对非生物胁迫的响应尚未有报道。本研究发现,的表达受高盐和低温胁迫诱导;并且随着果实的成熟,内源乙烯释放量增多,的表达量逐渐升高,因此,推断是乙烯响应的正调控因子。另外,本研究表明,除在苹果茎中表达量较高外,在果实中的表达量也很高,可能参与苹果果实抵御外界不利的非生物和生物胁迫;而且前人的研究表明,乙烯响应因子作为激素和胁迫信号的一个非常重要的调节中心[36],这一报道支持乙烯响应因子家族基因可能参与非生物胁迫抵抗力;同时,本研究发现在苹果愈伤组织中过表达确实可以提高其对高盐和低温胁迫的抗性。

图9 苹果野生型(WT)和MdERF72过量表达愈伤组织(OE1、OE2和OE3)在NaCl处理下的生长状态
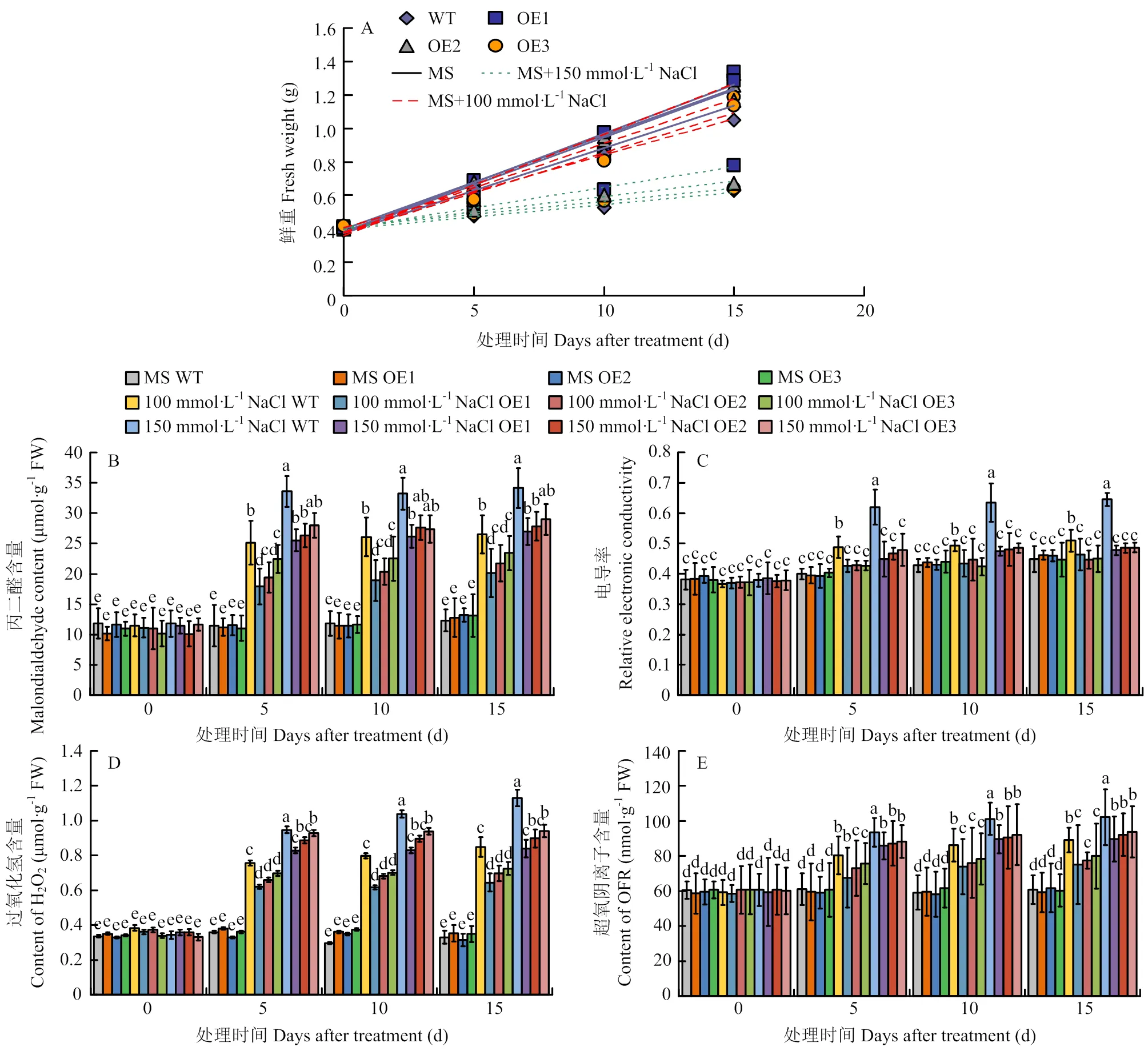
图10 苹果野生型(WT)和MdERF72过量表达愈伤组织(OE1、OE2和OE3)在NaCl处理下的鲜重(A),丙二醛含量(B),电导率(C),过氧化氢含量(D),超氧阴离子含量(E)

图11 苹果野生型(WT)和MdERF72过量表达愈伤组织(OE1、OE2和OE3)在4℃低温处理下的生长状态

图12 苹果野生型(WT)和MdERF72过量表达愈伤组织(OE1、OE2和OE3)在4℃低温处理下的鲜重(A),丙二醛含量(B),电导率(C),过氧化氢含量(D),超氧阴离子含量(E)
提高作物对盐胁迫的抗性,可以有效的提高产量和品质。由于气候多变、植被破坏加剧及耕作管理不当等原因,土壤盐碱化越来越严重,据不完全统计,全球9亿多hm2土地面临土壤盐碱化问题。土壤盐碱化会导致植物根系对水分和营养的吸收受到抑制,使树势衰弱,抗性下降,病害频发。面对土壤盐碱化,除了从改良土壤方面入手,还可以通过提高植物的耐盐性来改善。在水稻中,植物对盐胁迫的响应机制已经有较为完善的研究。在苹果中,植物对盐胁迫的响应尚不明确。本研究中发现的正调控苹果对高盐及低温的胁迫响应,对于选育抗盐、耐寒的优良苹果砧木具有重要指导意义。
4 结论
克隆获得苹果乙烯响应因子基因,该基因编码253个氨基酸。包含一个AP2保守结构域。进化树分析显示,与拟南芥亲缘关系最近。在苹果茎和果实中表达量较高,并且对高盐和低温胁迫有明显响应。转基因愈伤在高盐和低温胁迫下生长势要明显强于野生型,说明在响应高盐和低温胁迫过程中发挥着重要的正调控作用。
[1] 杨志佳. 盐碱胁迫下拟南芥14-3-3蛋白对蛋白激酶SOS2和PKS5调控的研究[D]. 北京: 中国农业大学, 2019.
YANG Z J. Regulation of protein kinases SOS2 and PKS5 by 14-3-3 protein under salt and alkali stress in. Beijing: China Agricultural University, 2019. (in Chinese)
[2] LICAUSI F, OHME-AKAGI M, PERATA P. APETALA 2/Ethylene Responsive Factor (AP2/ERF) transcription factors: mediators of stress responses and developmental programs., 2013, 199(3): 639-649.
[3] RIECHMANN J L, HEARD J, MARTIN G, REUBER L, JIANG C Z, KEDDIE J, ADAM L, PINEDA O, RATCLIFFE O J, SAMAHA R R, CREELMAN R, PILGRIM M, BROUN P, ZHANG J Z, GHANDEHARI D, SHERMAN B K, YU G L.transcription factors: Genome-wide comparative analysis among eukaryotes., 2000, 290(5499): 2105-2110.
[4] NAKANO T, SUZUKI K, FUJIMURA T, SHINSHI H. Genome-wide analysis of the ERF gene family inand rice., 2006, 140(2): 411-432.
[5] OHME-TAKAGI M, SHINSHI H. Ethylene-inducible DNA binding proteins that interact with an ethylene-responsive element., 1995, 7(2): 173-182.
[6] MOOSE S P, SISCO P H. Glossy15, an APETALA2-like gene from maize that regulates leaf epidermal cell identity., 1996, 10(23): 3018-3027.
[7] GU Y Q, WILDERMUTH M C, CHAKRAVARTHY S, LOH Y T, YANG C, HE X H, MARTIN G B. Tomato transcription factors Pti4, Pti5, and Pti6 activate defense responses when expressed in., 2002, 14(4): 817-831.
[8] MITO T, SEKI M, SHINOZAKI K, TAKAGI M O, MATSUI K. Generation of chimeric repressors that confer salt tolerance inand rice., 2011, 9(7): 736-746.
[9] JAGLO K R, KLEFF S, AMUNDSEN K L, ZHANG X, HAAKE V, ZHANG J Z, DEITS T, THOMASHOW M F. Components of theC-repeat/dehydration-responsive element binding factor cold-response pathway are conserved inand other plant species., 2001, 127(3): 910-917.
[10] NOVILLO F, MEDINA J, SALINAS J.CBF1 and CBF3 have a different function than CBF2 in cold acclimation and define different gene classes in the CBF regulon., 2007, 104(52): 21002-21007.
[11] HSIEH T H, LEE J T, YANG P T, CHIU L H, CHARNG Y Y, WANG Y C, CHAN M. Heterology expression of theC-repeat/ dehydration response element binding Factor 1 gene confers elevated tolerance to chilling and oxidative stresses in transgenic tomato., 2002, 129(3): 1086-1094.
[12] KASUGA M, MIURA S, SHINOZAKI K, SHINOZAKI K Y. A combination of theDREB1A gene and stress-induciblepromoter improved drought-and low-temperature stress tolerance in tobacco by gene transfer., 2004, 45(3): 346-350.
[13] ITO Y, KATSURA K, MARUYAMA K, TAJI T, KOBAYASHI M, SEKI M, SHINOZAKI K, SHINOZAKI K Y. Functional analysis of rice DREB1/CBF-type transcription factors involved in cold-responsive gene expression in transgenic rice., 2006, 47(1): 141-153.
[14] PINO M T, Skinner J S, JEKNIĆ Z, HAYES P M, SOELDNER A H, THOMASHOW M F, CHEN T H H. Ectopicover- expression enhances freezing tolerance and induces cold acclimation- associated physiological modifications in potato., 2008, 31(4): 393-406.
[15] LIU Q, KASUGA M, SAKUMA Y, ABE H, MIURA S, Yamaguchi- HINOZAKI K, SHINOZAKI K. Two transcription factors, DREB1
and DREB2, with an EREBP/AP2 DNA binding domain separate two cellular signal transduction pathways in drought- and low-temperature- responsive gene expression, respectively, in., 1998, 10(8): 1391-1406.
[16] CHEN J R, LÜ J J, LIU R, LIU R, XIONG X Y, WANG T X, CHEN S Y, GUO L B, WANG H F. DREB1C fromenhances freezing tolerance in transgenicand China Rose (Jacq.)., 2010, 60(3): 199-211.
[17] ZHANG Z, HUANG R. Enhanced tolerance to freezing in tobacco and tomato overexpressing transcription factoris modulated by ethylene biosynthesis., 2010, 73(3): 241-249.
[18] TRUJILLO L E, SOTOLONGO M, MENENDEZ C, OCHOGAVÍA M E, COLL Y, HERNÁNDEZ I, HIDALGO O B, THOMMA B P H J, VERA P, HERNÁNDEZ L. SodERF3, a novel sugarcane ethylene responsive factor (ERF), enhances salt and drought tolerance when overexpressed in tobacco plants., 2008, 49(4): 512-525.
[19] SERRA T S, FIGUEIREDO D D, CORDEIRO A M, ALMEIDA D M, LOURENÇO T, ABREU I A, SEBASTIÁN A, FERNANDES L, MOREIRA B C, OLIVEIRA M M, SAIBO N J M. OsRMC, a negative regulator of salt stress response in rice, is regulated by two AP2/ERF transcription factors., 2013, 82(4/5): 439-455.
[20] JUNG J, WON S Y, SUH S C, KIM H, WING R, JEONG Y, HWANG I, KIM M. The barley ERF-type transcription factor HvRAF confers enhanced pathogen resistance and salt tolerance in., 2007, 225(3): 575-588.
[21] KIM Y H, JEONG J C, PARK S, LEE H S, KWAK S S. Molecular characterization of two ethylene response factor genes in sweetpotato that respond to stress and activate the expression of defense genes in tobacco leaves., 2012, 169(11): 1112-1120.
[22] 刘文奇, 陈旭君, 徐晓晖, 凌建群, 郭泽建. ERF类转录因子基因的超表达提高烟草的耐盐能力.植物生理与分子生物学学报, 2002, 28(6): 473-478.
LIU W Q, CHEN X J, XU X H, LING J Q, GUO Z J. Overexpression of ERF transcription factorgene enhances salt tolerance of tobacco.. 2002, 28(6): 473-478. (in Chinese)
[23] SHIN R, PARK J M, AN J M, PAEK K H. Ectopic expression ofbacterial, and oomycete pathogens., 2002, 15(10): 983-989.
[24] 刘伟. 乙烯响应因子ERF4/ERF72参与苹果砧木缺铁应答的功能研究[D]. 北京: 中国农业大学, 2017.
LIU W. Functional research of ethylene response factor ERF4/ERF72 involved in iron deficiency response of apple rootstocks. Beijing: China Agricultural University, 2017. (in Chinese)
[25] 韩朋良, 刘肖娟, 刘鑫, 董元花, 胡大刚, 郝玉金. 苹果生长素阻遏蛋白基因的分子克隆与功能鉴定. 园艺学报, 2018, 45(6): 1041-1053.
HAN P L, LIU X J, LIU X, DONG Y H, HU D G, HAO Y J. Molecular cloning and functional identification of apple auxin repressor protein gene., 2018, 45(6): 1041-1053. (in Chinese)
[26] 张全艳, 于建强, 王佳慧, 胡大刚, 郝玉金. 苹果的克隆及其在苹果愈伤组织的抗盐功能鉴定. 园艺学报, 2017, 44(11): 2163-2170.
ZHANG Q Y, YU J Q, WANG J H, HU D G, HAO Y J. Molecular cloning and functional characterization ofreveals its involvement in salt tolerance in apple callus., 2017, 44(11): 2163-2170. (in Chinese)
[27] HU D G, SUN C H, MA Q J, YOU C X, CHENG L, HAO Y J. MdMYB1 regulates anthocyanin and malate accumulation by directly facilitating their transport into vacuoles in apples., 2016, 170(3): 1315-1330.
[28] 赵世杰, 许长成, 邹琦, 孟庆伟. 植物组织中丙二醛测定方法的改进. 植物生理学通讯, 1994, 30(3): 207-210.
ZHAO S J, XU C C, ZOU Q, MENG Q W. Improvements of method for measurement of malondialdehyde in plant tissues., 1994, 30(3): 207-210. (in Chinese)
[29] 崔之益, 李蕊萍, 胡加新, 奚如春. 电导法在植物研究中应用. 安徽农业科学, 2014, 42(17): 5358-5359, 5366.
CUI Z Y, LI R P, HU J X, XI R C. Application of conductivity method in botanical research., 2014, 42(17): 5358-5359, 5366. (in Chinese)
[30] OH S J, SONG S I, KIM Y S, JANG H J,KIM S Y, KIM M, KIM Y K,NAHM B H, KIM J K.and, 2005, 138(1): 341-351.
[31] HONG B, TONG Z, MA N, KASUGA M, SHINOZAKI Y, GAO J P. Expression of thegene in transgenic chrysanthemum enhances tolerance to low temperature., 2006, 81(6): 1002-1008.
[32] HONG B, TONG Z, MA N, LI J, KASUGA M, YAMAGUCHI S K, GAO J P. Heterologous expression of thegene in chrysanthemum increases drought and salt stress tolerance., 2006, 49(5): 436-445.
[33] FISCHER U, DRÖGE-LASER W. Overexpression of, a new member of the tobacco ethylene response transcription factor family enhances resistance to tobacco mosaic virus., 2004, 17(10): 1162-1171.
[34] ZUO K J, QIN J, ZHAO J Y, LING H, ZHANG L D, CAO Y F, TANG K X. Over-expressiontranscription factor in tobacco enhances brown spots disease resistance by activating expression of downstream genes., 2007, 391(1/2): 80-90.
[35] LI T, XU Y X, ZHANG L C, JI Y L, TAN D M, YUAN H, WANG A D. The jasmonate-activated transcription factor MdMYC2 regulatesand ethylene biosynthetic genes to promote ethylene biosynthesis during apple fruit ripening., 2017, 29(6): 1316-1334.
[36] Müller M, Munné-Bosch S. Ethylene response factors: A key regulatory hub in hormone and stress signaling., 2015, 169(1): 32-41.
Analysis of Apple Ethylene Response Factorto Abiotic Stresses
WANG JiaHui, GU KaiDi, WANG ChuKun, YOU ChunXiang, HU DaGang, HAO YuJin
(College of Horticulture Science and Engineering, Shandong Agricultural University/State Key Laboratory of Crop Biology/MOA Key Laboratory of Horticultural Crop Biology(Huanghuai Region)and Germplasm Innovation, Tai’an 271018, Shandong)
【】Ethylene response factor (ERF) , a plant-specific transcription factor, is involved in the growth and development of root formation, hypocotyl elongation, fruit ripening, and organ senescence. It also plays a vital role in regulating responses of plant biological and abiotic stress, as well as fruit qualities. In this study, we cloned the apple ethylene response factor. Subsequently, a series of expression analysisand functional identification of transgenic apple calli were performed to study its role in abiotic stress responses. These results provided a theoretical basis for exploring the functions of【】Using Orin apple calli (Borkh.) as the test material, thewas cloned from apple fruits by RT-PCR assay. Bioinformatics methods were used to analyze its amino acid sequence, physicochemical properties genetic relationship, and spatial structure. MEGA5.0 was used to construct the phylogenetic tree for analyzing the homology of its protein sequence with ERF-B2 subfamily in.The real-time fluorescence PCR (qRT-PCR) assays were performed to analyse the expression ofdifferent developmental stages.Meanwhile, the expression ofWe also constructed its overexpression vector and obtained stable overexpression apple calli through-mediated genetic transformation. The fresh weight, malondialdehyde content, electrical conductivity, hydrogen peroxide content and superoxide anion content of the wild type and transgenic apple calli were detected after NaCl and low temperature treatment.【】was located on chromosome 13 in apple genome, which had an AP2/ERF domain, unique to ERF family. Phylogenetic tree analyses indicated that the appleexhibited the highest sequence similarity to, and belonged to the B2 subfamily of ERF family.Analysis of amino acid physicochemical properties indicated thatencodes 253 amino acids, and its protein molecular weight was predicted as 27.61 kD, the isoelectric point (pI) was 5.10. In addition, the pro-hydrophobic prediction showed that the hydrophobic portion ofwas larger than the hydrophilic portion, indicating that it belonged to a hydrophobic protein. Phosphorylation site analysis revealed thathad only one threonine phosphorylation site, suggesting that the protein might be regulated by phosphorylation.The results revealed that thepromoter sequence contains-acting elements associated with jasmonic acid (JA), auxin and drought signals. qRT-PCR analysis showed thatwas a positive regulatory transcription factor of ethylene, which was expressed in all tissues of apple. Its expression in fruits and stems was relatively high, and gradually increased with the fruit ripening. The expression ofsignificantly induced by high salt and low temperature.Under the treatment of high salt and low temperature stresses, the- overexpressing apple calli had stronger growth potential than the wild type control, and the conductivity, malondialdehyde, hydrogen peroxide and superoxide anion content were lower than the wild type control, indicating thatincreased the resistance to salt and low temperature stresses.【】played an important role in the regulation of high salt and low temperature stresses. Overexpression ofcould increase the resistance of apple calli to high salt and low temperature stresses.
apple;; ethylene response factor; stress responses

10.3864/j.issn.0578-1752.2019.23.017
2019-03-21;
2019-07-01
国家自然科学基金(31601728,31430074,31772288)、山东省现代农业产业技术体系(SDAIT-06-03)、国家现代苹果产业技术体系(CARS-27)、山东省自然科学基金(ZR2016CQ13)
王佳慧,E-mail:wangjhedu@126.com。
郝玉金,E-mail:haoyujin@sdau.edu.cn。通信作者胡大刚,E-mail:fap_296566@163.com
(责任编辑 赵伶俐)
