QuEChERS-气相色谱分析厦门海域鱼体中有机氯类农药残留特征及风险评价
2020-01-13毕思远曹建涛李保玲朱志强曹涛李森
毕思远,曹建涛,李保玲,朱志强*,曹涛,李森
1(哈尔滨体育学院,黑龙江 哈尔滨,150008) 2(济南市农产品质量检测中心,山东 济南,250000)3(广东省检迅检测科技有限公司,广东 东莞,523843) 4(深圳市汇知科技有限公司,广东 深圳,518000)
有机氯农药(organochlorine pesticides, OCPs)是一种公认的持久性有机污染物[1],对生物体的内分泌系统、生殖系统和神经系统均有毒性,可产生致畸、致癌效应[2]。这类物质可通过降雨、地表径流等方式进入水环境[3],同时由于其具有高脂溶性,极易经食物链在生物体内富集并产生生物放大效应[4]。有研究表明,食用鱼类是人体农药摄入的重要途径之一[5],因为它们能通过皮肤和鳃直接从水环境中吸收OCPs,也能通过食物链放大作用富集OCPs[6],其富集系数可达40 000倍[7]。因此,研究鱼类中OCPs的残留量对保障人体健康有重要意义。
鱼肉样品通常含有大量蛋白质和脂肪,基质复杂,对其进行分析时通常需要进行富集和净化等前处理操作。目前,我国关于水产品中有机氯农药测定主要采用GB 23200.88—2016,其中目标物用丙酮-石油醚索氏提取,经弗罗里硅土柱净化后用气相色谱测定,索氏提取需耗费大量溶剂。凝胶渗透色谱[6,8]、硅胶固相萃取[4,9]和磺化[3]在鱼肉样品OCPs测定中运用较多,但凝胶渗透色谱设备昂贵,溶剂耗费较多,固相萃取净化稳定性好,回收率高,但操作效率低下,难以满足大批量样品快速检测的要求,磺化能有效去除鱼肉中的脂肪和蛋白质,但大量硫酸易对操作人员造成身体伤害,且容易污染环境。QuEChERS方法操作简便,回收率好,操作效率高,成功克服了上述样品前处理方法的缺点[10],已广泛应用于水果[11-12]、蔬菜[13-14]、粮食[15-16]和茶叶[17-18]等样品中的农药残留检测,但在鱼类等脂肪含量较高的动物样品中OCPs检测的应用较少。
本试验在国内外标准和文献[10-19,20]的基础上,建立超声波辅助萃取,QuEChERS净化,通过气相色谱-气质联用确证、气相色谱定量测定鱼肉中OCPs的检测方法,并将其用于厦门海域10种鱼类中OCPs的残留分析。
1 材料与方法
1.1 仪器与试剂
7890B气相色谱仪(配电子捕获检测器)、7890B-5977B气相色谱-质谱联用仪(配EISS离子源),美国Agilent公司; 3K15台式高速离心机,德国SIGMA;N-EVAP 12管氮气浓缩仪,上海安谱; T25组织匀浆机、Vortex GENIUS 3涡旋振荡器,德国IKA。
丙酮、正己烷均为色谱纯,美国Fisher Chemical;N-丙基乙二胺(PSA)、C18固相萃取吸附剂,美国Agilent公司;无水硫酸镁、百灵威、α-六六六、β-六六六、γ-六六六、δ-六六六、p,p’-DDE、o,p’-DDT、p,p’-DDD、p,p’-DDT艾氏剂、狄氏剂、七氯、环氧七氯、异狄氏剂、硫丹Ⅰ、硫丹Ⅱ,质量浓度均为100 μg/mL,北京坛墨质检科技有限公司。
1.2 样品的采集与制备
选取从某大型超市购买的青石斑鱼作为方法验证样品,在厦门海域近岸外的9.26 km渔船随机购买10种常见鱼类,采样鱼类相关参数见表1。海冰低温保存带回实验室,每条取可食部分切成小块,混合均匀后制成肉糜,-20 ℃冷冻保存,7 d内完成分析。
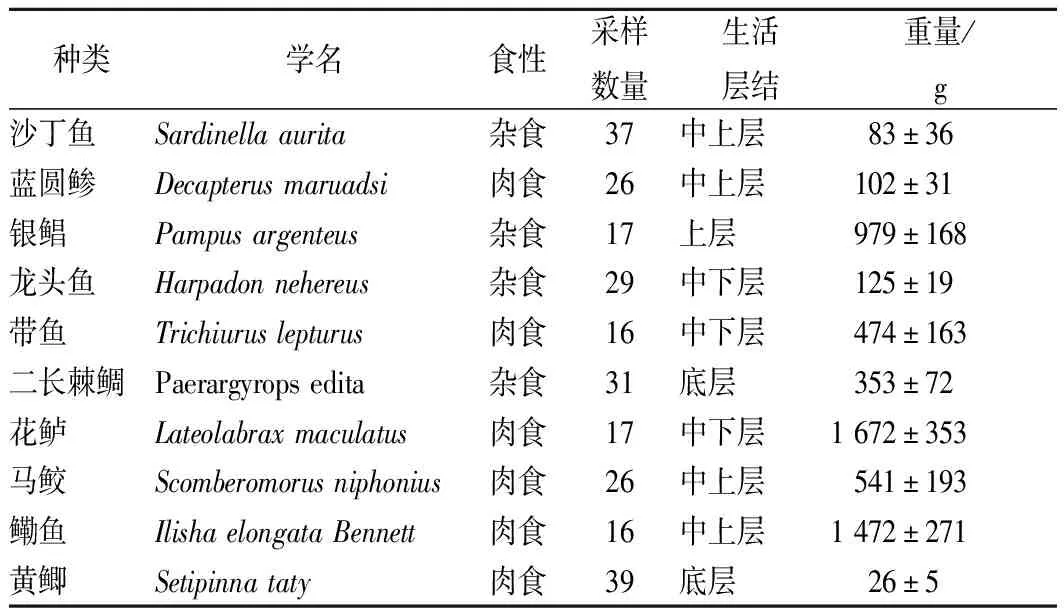
表1 采样鱼类相关参数Table 1 Parameters for fishes
1.3 试验方法
1.3.1 样品处理
称取鱼肉样品2.00 g于50 mL离心管,加10 mLV(正己烷)∶V(丙酮)=1∶1,12 000 r/min匀浆提取1 min,加入0.4 g无水MgSO4和0.1 g无水醋酸钠,剧烈振荡1 min,超声10 min,旋涡1 min,8 000 r/min离心2min,移取上清液6 mL于装有400 mg PSA、150 mg C18和900 mg无水MgSO4的15 mL离心管,旋涡1 min,然后以8000 r/min离心2 min,取上清液5 mL于10 mL玻璃刻度试管,40 ℃氮气浓缩近干,用0.1 mL正己烷溶解,旋涡后转移至内置衬管的进样小瓶,用GC-ECD定量,GC-MS确证。
1.3.2 仪器条件
1.3.2.1 气相色谱条件
进样口温度280 ℃,检测器(ECD)温度300 ℃,载气N2流量1.2 mL/min,DB-1MS色谱柱30 m×0.25 mm×0.25 μm,柱初温90 ℃,保持0.5 min,20 ℃/min升温至180 ℃,10 ℃/min升温至230 ℃,20 ℃/min升温至280 ℃,保持6 min,进样量2 μL。
1.3.2.2 气相色谱-质谱联用条件
进样口温度280 ℃,检测器(ECD)温度300 ℃,载气H2流量1.0 mL/min,DB-1MS色谱柱30 m×0.25 mm×0.25 μm,柱初温50 ℃,保持0.5 min,20 ℃/min升温至130 ℃,8 ℃/min升温至250 ℃,15 ℃/min升温至280 ℃,保持5 min,进样量2 μL。SIM采集模式,各组分采集离子参考GB 23200.8—2016。
1.4 方法性能测试
1.4.1 标准曲线
为减小基质效应对定量结果的影响,采用空白基质溶液配制标准曲线系列。分别取各OCPs组分0.1 mL,用正己烷稀释至10.00 mL,配成1.00 μg/mL混合标准溶液,取阴性鱼肉样品按1.3.1处理定容后,用该正己烷溶液将1.00 μg/mL标准溶液稀释成1.00、2.00、5.00、10.00、20.00、50.00 μg/L标准曲线系列,以浓度为横坐标,峰面积为纵坐标绘制标准曲线,外标法定量。
1.4.2 回收率、精密度、检出限和定量限
取鱼肉阴性样品,添加1.00 μg/mL混合标准溶液0.002、0.01和0.05 mL,使样品中各OCPs的浓度为1.0、5.0和10 μg/kg,做加标回收试验,并计算各组分的精密度,每个浓度做6个平行试验。在最低添加浓度(1.0 μg/kg)的样品结果中,以3倍信噪比计算鱼肉样品中各OCPs的检出限,以10倍信噪比计算鱼肉样品中各OCPs的定量限。
1.5 风险评估
人体中所累积的有机污染物大部分来自食物,海产品作为沿海居民的主要食物来源,有必要评估OCPs对人体健康的风险。本试验采用世界卫生组织规定的每日允许摄入量(acceptable daily intake,ADI)作为评价标准,计算居民每日膳食摄入量(estimated daily intake,EDI),与GB 2763—2016中规定的ADI值相比较,评估OCPs对人体健康的潜在风险[21]。具体计算如公式(1)所示:
(1)
式中:ω,鱼肉中OCPs的浓度,μg/kg;CR,鱼类人均每日摄入量,g/d;BW,消费者体质量,kg。
本试验中鱼类人均每日摄入量CR按100 g/d计算,消费者体质量BW采用60 kg。
2 结果与分析
2.1 方法性能试验

图1 加标样品(0.5 μg/kg)中OCPs的分离色谱图Fig.1 Gas chromatography of OCPs in fish samples addstandard 0.5 μg/kg
从图1和表2可知,14种OCPs在1.3.2.1的仪器条件下,在1~50 μg/L质量浓度范围内线性关系良好,相关系数均大于0.998 8。鱼肉样品含有15%~20%的蛋白质和5%左右的脂肪,乙腈虽然广泛应用于水果和蔬菜样品的农残提取,但并不适合脂肪含量偏高的样品,因为乙腈会使蛋白质快速变形,阻碍乙腈渗透而导致萃取效率偏低。因此本研究采用GB23200.88—2016相似的萃取溶剂体系提取鱼肉中的OCPs,采用V(正己烷)∶V(丙酮)=1∶1提取OCPs的同时会提取出鱼肉中的脂质,因此减少鱼肉取样量为2 g,同时采用先净化后浓缩的方式,使PSA、C18和MgSO4与溶剂接触更加充分,以获得更好的净化效果。结果表明,经400 mg PSA、150 mg C18和900 mg无水MgSO4净化后,可以基本消除脂质对ECD的影响,同时使用GCMS对阳性样品进行确认,进一步保证结果的准确性。用气相色谱分析1.3.1处理后的加标样品,OCPs的回收率为86.5%~97.4%,精密度为4.8%~12.1%,最低检出限为0.01 μg/kg,能够满足鱼肉中的OCPs分析。
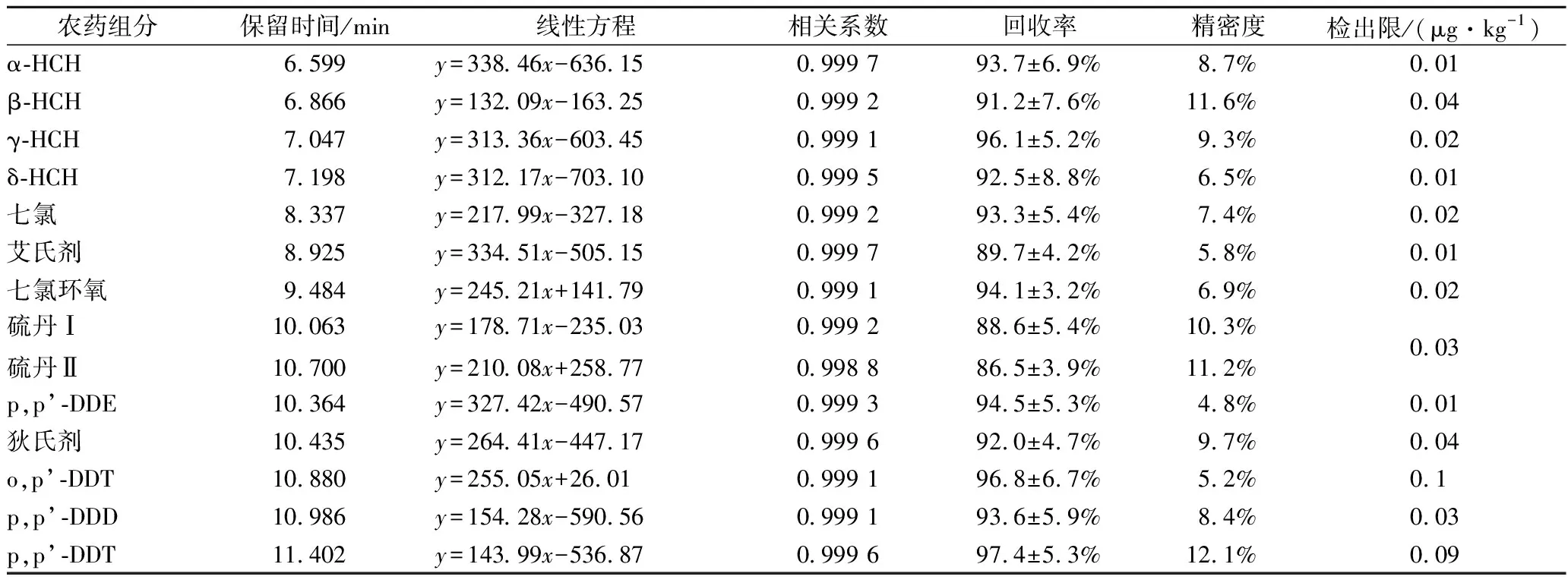
表2 有机氯农药的线性方程、相关系数、回收率、精密度、检出限和定量限Table 2 The linear equations, correlation coefficients, recovery, precision, LOD and LOQ of OCPs
2.2 实际样品有机氯农药分析及风险评价
OCPs具有疏水性,对脂质具有很高的亲和力,水环境中OCPs的生物富集效应主要依靠水-脂的两相分配[22],鱼类能够直接从水中吸收OCPs,也能通过摄食富集OCPs,但是对OCPs的代谢缓慢,所以常被用于水环境的整体OCPs污染水平评价[23]。
2.2.1 六六六
HCHs曾经作为一种广谱农药而广泛应用于农业,我国自1992年开始禁止使用六六六。工业的HCHs由4种异构体组成,α-HCH(60%~70%)、β-HCH(5%~12%)、γ-HCH(10%~15%)、δ-HCH(6%~10%),而林丹中的γ-HCH超过90%[24-25]。从表3可知,有3种鱼类均检出4种HCHs异构体,这3种鱼类均为肉食性中下层鱼类。黄鲫和带鱼的HCHs含量最高,这可能是黄鲫为常栖息于淤泥底质中,而带鱼脂肪含量较高的原因。所有异构体中β-HCH的检出率和平均浓度最高,α-HCH的检出率最低。这可能是因为在4种异构体中,β-HCH最容易被底层淤泥富集[26],且α-HCH和γ-HCH也可以转化成β-HCH[27];另外,由于β-HCH中氯原子的特殊位置,使其更难被降解[28],导致β-HCH在沉积物中积累,然后在鱼类等水生生物中富集。α-HCH/γ-HCH的值可以用来分析HCHs的来源,当α-HCH/γ-HCH≥3时,表示水环境中的HCHs主要来自工业污染、大气转移和沉积物的输入[29-30],α-HCH /γ-HCH≤1时则表示污染来自于林丹[31-32]。从表3可以看出,10种鱼类中4种HCHs异构体残留的浓度β-HCH>γ-HCH>δ-HCH>α-HCH,所有鱼类中α-HCH与γ-HCH的比值均小于1,表明该水域中HCHs的污染来自于林丹。另外,本研究中的HCHs总量在ND~5.759 μg/kg,黄鲫和带鱼的EDI值最高,分别为5.759和5.665 μg/kg。
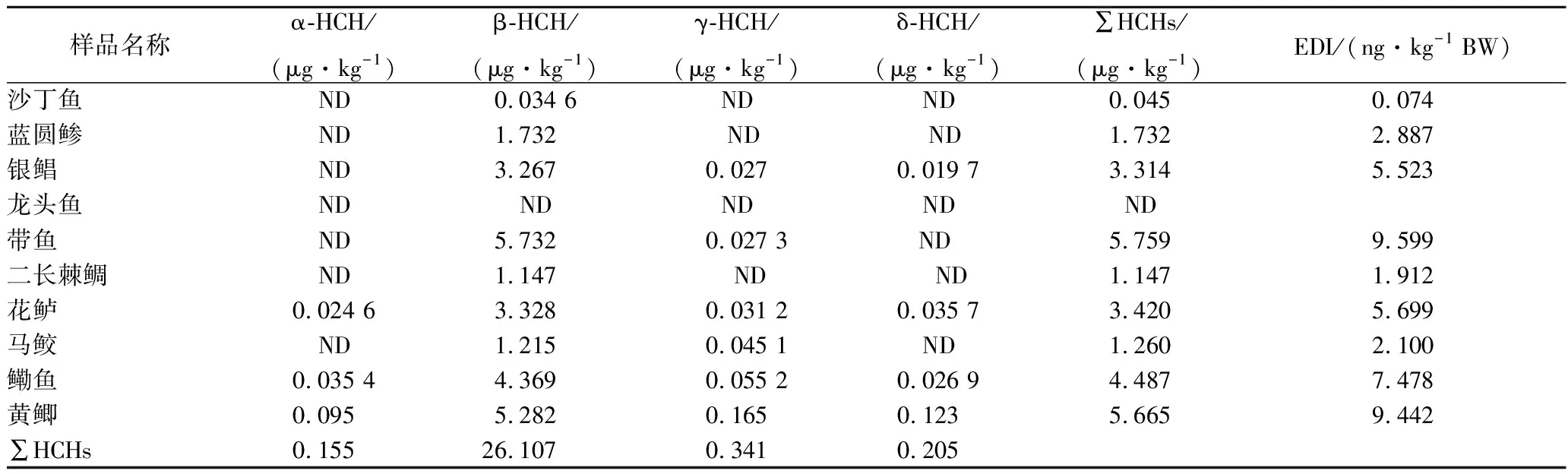
表3 鱼类六六六农药含量
注:“ND”表示未检测。下同。
2.2.2 滴滴涕
DDTs在采集鱼类中的检出率为100%,且浓度高于HCHs,可能是DDTs的疏水性更强,且生物富集系数更高的原因。龙头鱼、带鱼和鳓鱼的DDTs含量最高,可能是因为龙头鱼的脂肪含量高,DDTs更容易富集在脂肪组织,而带鱼和鳓鱼则可能因为个体较大,生长年份较长,富集DDTs的时间更长所致。其平均浓度依次为DDD>DDE>DDT。DDT使用后,大部分DDT在有氧和厌氧条件下分别缓慢转化为DDE和DDD[33-34],因此,DDT和其代谢物(DDD+DDE)的比值常用来判断DDT的使用时间和生物转化的指标[35],也可以用于分析水环境中DDT的污染来源[29-30,36], DDT/(DDD+DDE)>1表示近期使用过DDT,反之则表示污染来自于早期使用的DDT[29-30,37]。从表4可以看出,所有鱼类样品中DDT/(DDD+DDE)均小于1,表明该水域中近期没有受到新的DDT污染。另外,DDD与DDE的比值能反应DDT的降解方式,DDD/DDE<1表示有氧降解,DDD/DDE>1表示无氧降解[38]。本研究中所有样品中的DDD/DDE比值均为0.9~1.7,说明该水域鱼类DDTs的降解途径大部分是厌氧的。工业上O’P’-DDT与P’P’-DDT的比值在0.2~0.3,试验中O’P’-DDT /P’P’-DDT的比值为0.7~1.4之间,说明该水域最近可能有三氯杀螨醇输入。各鱼类DDTs的EDI值均远小于国标规定的10 μg/kg BW,说明该水域鱼类的DDTs残留量是安全的,但是应该警惕三氯杀螨醇输入后引起的DDTs污染增加。
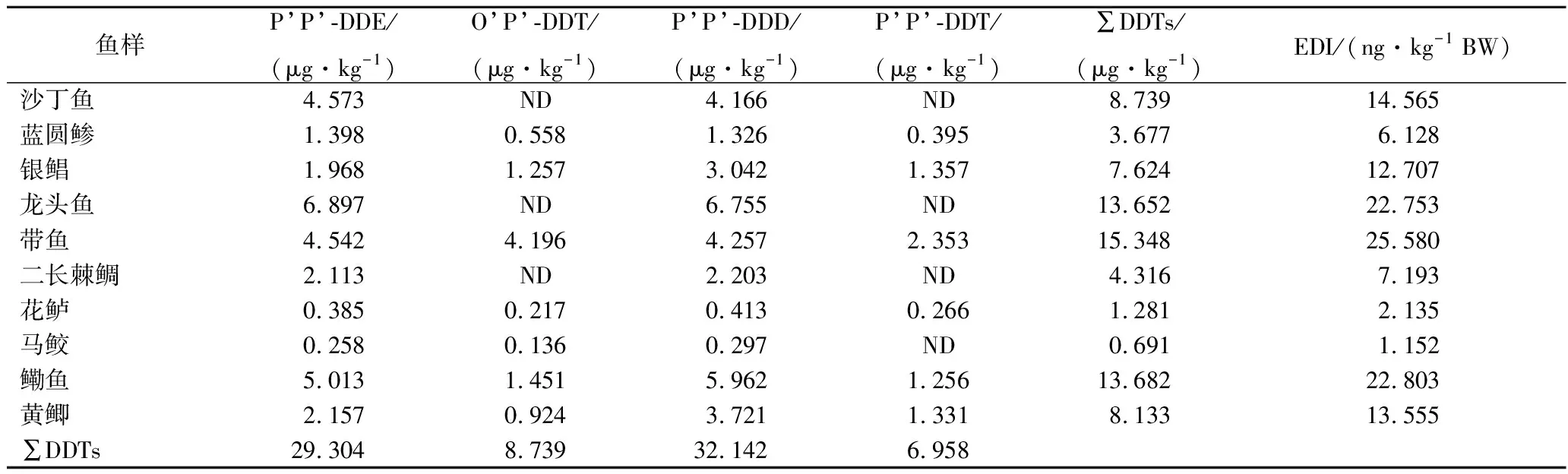
表4 鱼类滴滴涕农药含量
2.2.3 硫丹、艾氏剂、狄氏剂和异狄氏剂
硫丹由硫丹Ⅰ和硫丹Ⅱ组成,这2种异构体都对光降解具有很强的抵抗力,但是其代谢物硫丹硫酸盐易受光分解的影响[39]。从表5可以看出,所有的鱼肉中都检出硫丹Ⅰ,只有82%的样品检出硫丹Ⅱ,但是抽样鱼类硫丹的平均含量:硫丹Ⅱ>硫丹Ⅰ,这可能是因为硫丹Ⅰ在沉积物中降解更快[40]。工业硫丹产品中硫丹Ⅰ和硫丹Ⅱ的比例约为2.33,可以用两者的比值来判断水域的硫丹污染时间,本研究同时检出2种硫丹的鱼类中硫丹Ⅰ/硫丹Ⅱ均小于1,说明该水域近几年没有受到新的硫丹污染[29-30]。
抽样鱼类中七氯和七氯环氧的检出率分别为80%和90%,其浓度与鱼肉中脂肪含量存在一定的相关性,脂肪含量较高的鱼类中七氯含量较高,与王翀[2]的研究结果一致。从表5可知,七氯和环氧七氯检出浓度都不高,这与汤清清等[41]的研究结果相比有所降低。
艾氏剂和狄氏剂均为环戊二烯结构的杀虫剂,被列入世界卫生组织国际癌症研究机构公布的致癌物清单。两者在所有抽样鱼类中均未检出,因为这类物质在水中的溶解度低,且易于土壤紧密结合,在土壤和水中会缓慢向下迁移。此外,这些极性物质对动物脂肪具有高度的亲和力,容易导致其在食物链的富集。但是,此类物质具有挥发性,能在大气中光降解。这可能会减少水环境中的污染程度[40]。
七氯(七氯和环氧七氯之和)和硫丹(硫丹Ⅰ与硫丹Ⅱ之和)的ADI分别为0.1 μg/kg BW和 6 μg/kg BW,均超过其EDI的100倍以上,说明食用这些鱼类风险很小。

表5 鱼类有机氯农药含量 单位:μg/kg
3 结论
鱼肉样品经QuEChERS提取和净化处理后,用气相色谱检测,质谱确证,方法回收率为83.2%~103.5%,相对标准偏差在4.8%~12.1%,检出限0.01~0.09 μg/kg,实际样品分析结果表明:该法简单、易操作,测定结果准确,能满足鱼肉中多种OCPs的分析要求。采集的10种鱼类均有OCPs检出,含量在5.532~22.174 μg/kg之间,带鱼和鳓鱼的OCPs含量最高,分别为22.174和19.910 μg/kg,P’P’-DDD、P’P’-DDE和β-HCH是最主要的OCPs污染物。各异构体含量的比值表明厦门水域HCHs和DDTs大部分来自早期农药使用残留,但有疑似排入三氯杀螨醇。整体OCPs较往年有所降低[2,41],计算估计每日摄入量均远低于GB2763—2016规定的每日允许摄入量,食用该水域鱼类产生有机氯农药危害的风险较低。
