低强度UV-A光循环辐照对4 ℃下鲜切菠菜品质及抗氧化能力的影响
2020-01-13郁杰张雨宸谢晶
郁杰,张雨宸,谢晶
1(上海海洋大学 食品学院,上海,201306) 2(农业农村部冷库及制冷设备质量监督检验测试中心(上海),上海,201306)3(上海冷链装备性能与节能评价专业技术服务平台,上海,201306)4(食品科学与工程国家级试验教学示范中心(上海海洋大学),上海,201306)
菠菜(SpinaciaoleraceaL.)又名波斯菜、赤根菜、鹦鹉菜等,属藜科菠菜属,一年生草本植物,原产于伊朗,外观呈墨绿色,叶片厚实且大小适中,叶片和茎为主要食用部分,富含维生素A、维生素C以及铁元素等微量元素,深受国内外消费者青睐,在我国,人们常将其鲜切后置于4 ℃下售卖[1],但由于菠菜叶片面积大气孔分布广,极易受到腐败菌侵染,一旦微生物进入气孔内部,很难被清除[2],同时鲜切后的菠菜发生汁液流失、愈伤呼吸剧烈(healing respiration)[3],这一系列反应加剧了鲜切菠菜相关代谢酶的降解进程以及微生物对其的侵染,同未经加工的菠菜相比,鲜切菠菜的贮运时间更短,因此在顺应消费者对鲜切菠菜的需求下,应着重维持鲜切菠菜货架期内的品质,探寻适宜的保鲜方式。
紫外线(ultraviolet, UV)是指波长10~400 nm辐射的总称,根据波长不同,可分为长波紫外线UV-A(320~400 nm)、中波紫外线UV-B(280~320 nm)和短波紫外线UV-C(200~280 nm),其中UV-A约占太阳总辐射的6%,是紫外辐射中危害最小的部分[4],UV-A辐射对采后作物基因的表达、酶、活性氧代谢等生理反应均有不同程度的影响,而植物本身也会触发一系列抗逆反应来中和辐照的影响,如:黄酮类化合物、羟基肉桂酸及抗坏血酸等抗氧化物的合成[5],还有文献指出,通过UV-A照射,光粒子可与细胞中水分子相互作用产生自由基[6],而鲜切菠菜组织内水分含量高达92%,因此该效应在植物中十分明显,植物细胞可对这些活性氧产生强烈的反应增强抗逆进程提高品质。同时,辐照处理具有绿色环保、无副产物的优势,且应用成本低、操作可行性高,近年来已经广泛应用于上海青[7]、牛角椒[8]、苹果[9]等果蔬中。
本试验首先确定UV-A处理鲜切菠菜的最佳光照总量,随后通过不同的照射方式处理鲜切菠菜,结合腐败菌数量、水分变化、超氧化物歧化酶等抗氧化指标,综合探讨UV-A对鲜切菠菜的保鲜效果,为延长鲜切菠菜的货架期提供新思路。
1 材料与方法
1.1 试验试剂
NaCl、丙酮、碳酸钙粉、石英砂、KI,(AR级)国药集团化学试剂有限公司;总超氧化物歧化酶(T-SOD)测试盒、抗坏血酸(Vitamin C)测定试剂盒、过氧化物酶(POD)测定试剂盒(测植物)、抗坏血酸过氧化物酶(APX)测试盒,南京建成生物科技有限公司;三氯乙酸(AR级),上海生工生物工程有限公司;I2(AR级),上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
H-2050R-1型高速冷冻离心机,长沙湘仪离心机有限公司;HVE-50高温高压灭菌锅,日本Hi-rayama制造有限公司;VS-1300L-U超净工作台,上海康福特环境科技有限公司;BCD-447W冰箱,博西华家用电器有限公司;E200三目生物显微镜,尼康仪器(上海)有限公司;D30D微型计算机,戴尔公司;WYT-32型手持式折光仪,泉州光学仪器厂;WFZ UV-2100型紫外可见分光光度计,上海尤尼柯仪器有限公司;植物紫外线UV辅助补光灯390 nm(9 W/0.6 m):T8(波长范围:374~406 nm,峰值:390 nm),山东贵翔光电有限公司;ST-513光强测定仪,先驰光电股份有限公司;高光防雾膜(PVC材质,食品级,膜厚度11 μm),良维(厦门)吸塑包装有限公司。
1.3 试验方法
1.3.1 菠菜鲜切处理及分组
菠菜:要求当天采摘、大小均一、色泽鲜绿、清洁、无明显缺陷、无病虫毒害。菠菜为大棚种植,有刺种,于3月份采摘,采摘时温度约15 ℃,湿度约为80%,采摘后20 min内由农户直接送至试验室。
将样品用自来水冲洗,除去表面泥污,且至洗涤后的废水仍为澄清代表清洗完成,待其晾干后用已灭菌的不锈钢菜刀距菠菜叶片茎部约4 cm处鲜切。初筛组随机分为6大组,每大组分为18个小组;试验组将菠菜随机分为4大组,每大组分为8个小组。以上每个小组分装70 g/盒,包装材料为高透光防雾膜。
1.2.2 光参数的确定
使用光强测定仪测定。灯下垂直30 cm处透过防雾膜的辐照度4.2 W/m2,峰值波长398 nm,半波宽16.8 nm,主波长436.64 nm,色纯度97.9%,光子通量密度10.12 μmol/(m2·s)。
1.3.3 UV-A光照方式及环境变量
各试验组的光照方式见表1,以饱和KCl盐溶液控制湿度,使样品在4 ℃,85% RH的环境下贮藏。单日光照总量的设定通过初筛试验组根据鲜切菠菜的货架期筛选得出,分别为360、420、600、720、900 s。
1.4 指标测定
1.4.1 革兰氏阴性菌的计数
参考KOUKOUNARAS等[10]的方法计数。
1.4.2 假单胞菌的计数
参考郁杰等[11]的方法计数。
1.4.3 水分变化
各个样品取样位置要求一致,并按照4.0 cm×3.0 cm的尺寸剪切成长方形,参照杨冲等[12]的试验方法进行低场核磁共振(low-field nuclear magnetic resonance, LF-NMR)T2谱的测定。
1.4.4 气孔情况
参考楼柏丹等[13]的方法并稍作改进,步骤如下:选取直接撕取表皮法,固定叶片后用无菌手术刀轻划一下叶片表面,用镊子掀开叶片的表皮,使用软刷刷去叶肉细胞,后用镊子将表皮完全取下,乙醇脱色后放在载玻片中央使用1% I2-KI溶液染色90 s,盖上盖玻片,镜检观察,选择目镜10×,物镜10×,放大100倍观察气孔情况。
1.4.5 可溶性固形物
将样品充分研磨后,在4 000 r/min的条件下离心10 min,取上清液滴加至检测镜上,合上盖板防止产生气泡,水平对准光源准确读取刻度尺读数,以质量分数(%)表示,重复3次。
1.4.6 叶绿素含量
参照NY/T 3082—2017[14]标准,按照公式(1)计算总叶绿素的含量,使用分光光度法测定总叶绿素、叶绿素a、叶绿素b的含量,并计算脱镁叶绿素、类胡萝卜素的含量。
(1)
式中:G,1 g样品中叶绿素的含量,mg/g;A645,在645 nm处测得的提取液吸光度;A663,在663 nm处测得的提取液吸光度;VT,提取液的总体积,mL;n,提取液稀释倍数;FW,鲜切菠菜鲜质量,g。
1.4.7 Vc含量
参照果蔬采后生理生化试验指导[15]中2,6-二氯酚靛酚滴定法测定抗坏血酸的含量。
1.4.8 APX活性
参照徐冬颖等[16]的方法,方法如下,(1)上清液的制备:取1 g样品叶片放入9 mL冰冷的磷酸盐缓冲液中,用匀浆机以10 000~15 000 r/min在冰浴的条件下上下研磨制成100 g/L的匀浆液,在5 000×g的条件下离心10 min,取上清。(2)反应体系为3 mL,在测定管中依次加入含有0.1 mmol/L EDTA和0.5 mmol/L抗坏血酸的反应缓冲液2.6 mL和待测样品的上清液0.1 mL,最后加入2 mmol/L H2O2溶液0.3 mL启动酶促反应,立即混匀并开始计时,在反应15 s时开始记录反应体系在波长290 nm处吸光度,将其作为初始值OD290I,每隔30 s记录1次记为OD290F,连续测定取得至少6个点的数据后,根据公式(2)计算每分钟吸光度的变化值ΔOD290,重复3次后取平均值,如公式(3)所示计算酶活性。
(2)
式中:ΔOD290,每分钟反应混合液吸光度变化值;OD290F,反应混合液吸光度终止值;OD290I,反应混合液吸光度初始值;tF,反应终止时间,min;tI,反应初始时间,min。

(3)
式中:APX活性,1 g样品中APX的含量,U/g;ΔOD290,每分钟反应混合液吸光度变化值;V,样品提取液总体积,mL;VS,测定时所取样品提取液体积,mL;m,样品质量,g。
1.4.9 SOD活性
参照T-SOD测试盒中的羟胺法,方法如下,(1)上清液的制备:取1g样品叶片放入9 mL冰冷的磷酸盐缓冲液中,在冰浴的条件下用匀浆机以10 000~15 000 r/min上下研磨制成100 g/L的匀浆液,在5 000×g的条件下离心10 min,取上清。(2)反应体系为4.3 mL,在测定管中分别加入75 mmol/L磷酸盐缓冲液(pH 7.8)1 mL、待测样品的上清液1 mL、0.1 mol/L盐酸羟胺溶液0.1 mL、75 mmol/L黄嘌呤溶液0.1 mL和0.037 U/L黄嘌呤氧化酶0.1 mL,用旋涡混匀器充分混匀,对照管以1 mL蒸馏水代替,置37 ℃恒温水浴30 min后取出,加入显色剂2 mL混匀,室温放置10 min,于波长550 nm处蒸馏水调零并比色,重复3次,参照公式(4)计算酶活性。

(4)
式中:SOD活性,1 g样品中SOD的含量,U/g。
1.4.10 POD活性
参照胡瑞斌等[17]的方法,方法如下,(1)上清液的制备:取1g样品叶片放入9 mL冰冷的磷酸盐缓冲液中,用匀浆机以10 000~15 000 r/min在冰浴的条件下上下研磨制成100 g/L的匀浆液,在5 000×g的条件下离心10 min,取上清。(2)反应体系为3.7 mL,在测试管中分别加入3.0 mL 25 mmol/L愈创木酚溶液和0.5 mL待测样品上清液,再加入200 mL 0.5 mol/L H2O2溶液迅速混合启动反应,同时开始计时。将混合液倒入比色皿中,以蒸馏水为参比,在反应15 s时开始记录反应体系在波长470 nm处吸光度,将其作为初始值OD470I,后每隔1 min记录1次记为OD470F,连续测定取得至少6个点的数据后,根据公式(5)计算每分钟吸光度的变化值ΔOD470,重复3次后取平均值,见公式(6)计算酶活性。
(5)
式中:ΔOD470,每分钟反应混合液变化值;OD470F,反应混合液吸光度终止值;OD470I,反应混合液吸光度初始值;tF,反应终止时间,min;tI,反应初始时间,min。

(6)
式中:POD活性,1 g样品中POD的含量,U/g;ΔOD470,每分钟反应混合液变化值;V,样品提取液总体积,mL;VS,测定时所取样品提取液体积,mL;m,样品质量,g。
1.4.11 数据处理及分析
本试验重复3次,各指标每次测定设3次平行,取平均值用origin 2018软件绘图,并使用IBM SPSS Statistics 24对组间数据进行ANVOA方差显著性分析(P<0.05代表存在显著差异、P<0.01代表差异极显著)。
2 结果与分析
2.1 单日UV-A光照总量的筛选
在BERNADETH等[18]的研究中可知,愈伤后的高等植物细胞受到外源辐照的刺激后,会激活不同的防御机制,以此中和辐照带来的损伤,辐照时间越长,机体的抗逆进程越强烈。因此本试验首先根据货架期筛选最佳辐照剂量,如图1所示,以间隔24 h、单日持续光照总量在420 s的辐照条件下,鲜切菠菜的货架期可延长至10 d为最高,故根据初筛试验结果设计试验组,如表1所示。
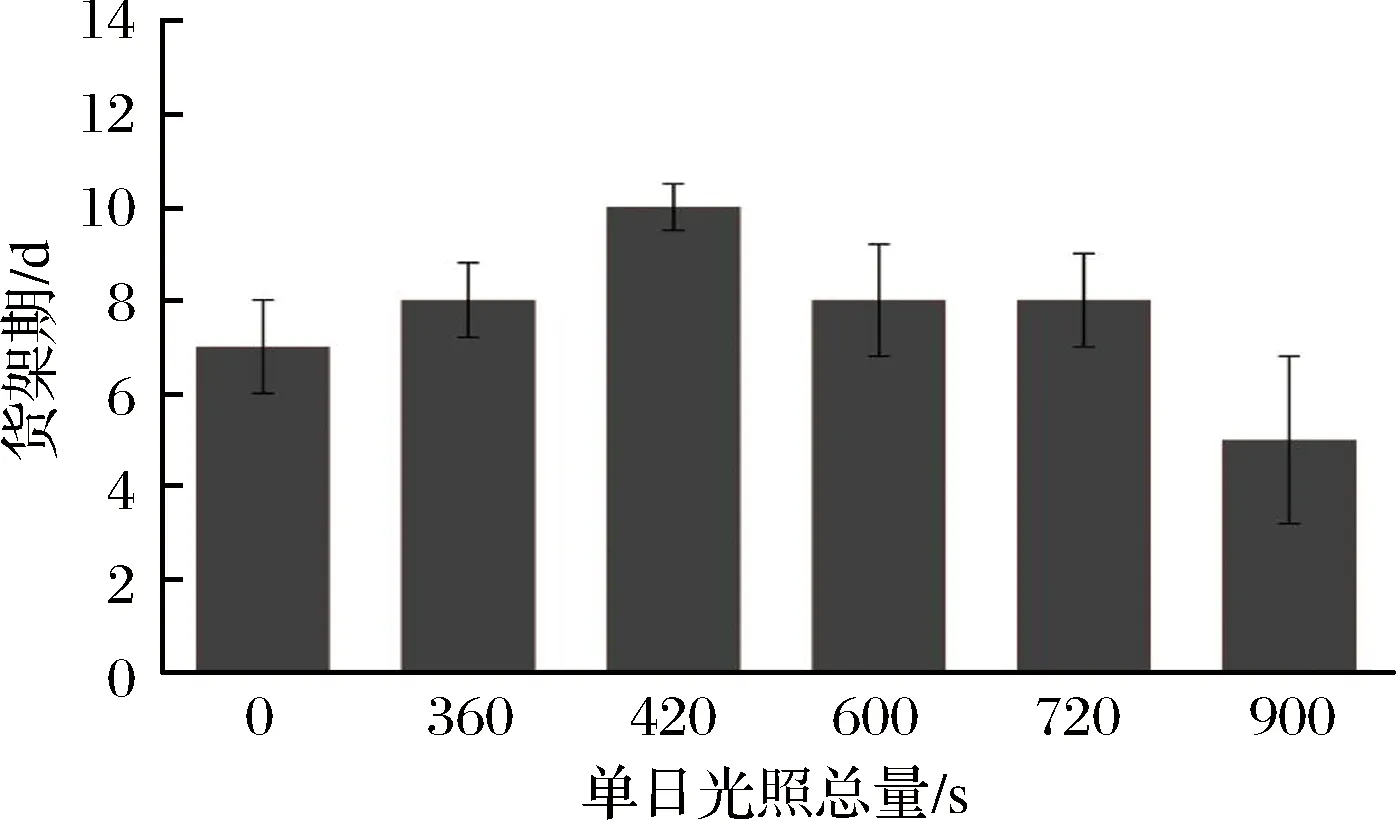
图1 不同光照总量的UV-A光对鲜切菠菜货架期的影响Fig.1 Effects of different irradiation time of UV-A onshelf life of fresh-cut spinach

表1 不同光照频率的UV-A光处理鲜切菠菜的分组情况Table 1 Groups of fresh-cut spinach treated withdifferent irradiation frequencies of UV-A
2.2 UV-A光照抑菌性能的评估
已有文献证实,在叶类净菜的贮藏过程中,腐败菌的增长与发酸、软腐等一系列品质劣变有强相关性,荧光假单胞菌为鲜切菠菜的主要腐败菌[11]。由图2可知,各辐照处理组的总菌、假单胞菌的数量均呈先下降后上升的趋势,在前4 d,各辐照处理组总菌含量均显著低于CK组(P<0.05),且抑菌性能依次为A组>B组>C组,假单胞菌数量变化与总菌变化趋势类似;到了贮藏末期,各组总菌含量差异不显著(P>0.05),但各辐照处理组假单胞菌数量显著低于CK组(P<0.05),辐照组组间差异不明显(P>0.05)。ANA等[19]的研究指出UV-A的杀菌性能一般,假单胞菌属受到辐照后会短暂地失去增殖能力,但仍具备致腐能力,这与本试验结果一致:在前2 d,经过辐照后的细菌数量并未急剧下降,验证了这个观点,但之后细菌数量呈下降趋势,推测一方面是由于一部分细菌对冷藏环境的不耐受使得数量变化不明显[20],另一方面是经UV-A光处理,刺激鲜切菠菜分泌了某些抑菌物质,如类黄酮物质,间接使得细菌数量降低[21]。
2.3 水分变化
鲜切菠菜组织内水分约占92%,叶片挺直主要依靠体内水分压力,如果水分流失,会导致细胞膨压降低,表观上可以观察到叶片萎蔫、皱缩,因此测定水分变化对评价鲜切菠菜样品品质从而评判保鲜方式的优劣显得十分重要。采后失水包括水分蒸发和呼吸消耗2个方面,其中水分蒸发引起的损耗是主要方面[16]。本试验通过绘制并反演计算各个处理组在不同时期样品弛豫时间T2,得到的T2图谱可以反映样品在贮藏前期(0 d)、贮藏中期(6 d)、贮藏末期(12 d)叶片中结合水(T21:0~2 ms)、不易流动水(T22:2~20 ms)、自由水(T23:20~1 000 ms)的迁移情况,峰面积与波峰呈正比关系,因此可以根据波峰判断水分含量[22]。由图3可得,在0~6 d内,CK组、A组、B组结合水、不易流动水含量呈上升趋势,C组含量变化不明显(P>0.05),可能是因为愈伤和辐照协同刺激了鲜切菠菜发生抗逆反应以适应环境[5],在果蔬中抗逆反应主要分为2个方面:一方面通过减少自由水使得机体新陈代谢速率下降,另一方面通过增加结合水含量增强抗逆能力[23]。其次,各组自由水含量呈大幅下降趋势,组间差异极显著(P<0.01),由高到低依次为A组>B组>C组>CK组,这是因为菠菜经过鲜切及外源辐照的刺激导致作物呼吸旺盛、代谢加快带动机体更快地蒸腾失水,故贮藏前期失水较快;到了贮藏末期(12 d),CK组结合水含量下降,表明细胞结构已被破坏,代谢崩溃,B组自由水含量为最高,这表明间隔8 h循环辐照鲜切菠菜更有利于维持水分含量,关于辐照能够减缓作物的水分流失,结合气孔情况指标,猜测可能是因为作物收到辐照后暂时关闭气孔进而关闭了蒸腾失水途径[24]。

a-总菌;b-假单胞菌图2 贮藏过程中总菌及假单胞菌的变化Fig.2 Changes of total viable counts and pseudomonasduring storage

a-贮藏第0天T2图谱;b-贮藏第6天T2图谱;c-贮藏第12天T2图谱图3 不同处理方式对鲜切菠菜水分变化的影响Fig.3 Effect of different treatments on moisture change of fresh-cut spinach
2.4 气孔变化
在高等植物中,气孔具有以下几点作用:(1)植物的蒸腾失水即通过气孔的开闭控制机体水分含量以适应外界环境的变化。(2)采后叶菜仍可短暂地进行光合作用,气孔就是光的接收者,辐照可使叶片气孔开放,光量子促使光敏色素活跃进而参与光合作用以延迟叶绿体衰老进程[25]。图4为鲜切菠菜气孔放大100倍后观察到的结果,如图4-a所示,在第0天,各试验组叶片气孔呈开放状态,这是因为愈伤后的组织呼吸加快,蒸腾作用明显;如图4-b所示,到了第6天,CK组气孔呈闭合状态,这是因为受到4 ℃低温的影响,但各试验组呈半开半闭状态,这是因为辐照刺激气孔打开,进而进行抗逆反应,从总叶绿素、水分变化指标可以验证这个观点;如图4-c所示,到了第12天,各组失水严重,所以各组气孔均闭合,避免失水。

图4 不同处理方式对鲜切菠菜气孔的影响Fig.4 Effect of different treatments on stoma of fresh-cutspinach注:图中右下方白色标尺代表长度为20 μm。
2.5 可溶性固形物
在果蔬中可溶性固形物包括糖分、总维生素、半纤维素等营养物质,是衡量鲜切菠菜中营养成分的重要指标[26]。由图5可得,各样品可溶性固形物的含量均随着贮藏时间的延长而降低,这是因为采后蔬菜发生干耗[27],在前2 d,各辐照组与CK组差异不明显,之后,辐照组可溶性固形物含量短暂地增加,且下降趋势较为平稳,但CK组在6 d后可溶性固形物急剧下降,总的来说,在6 d内,A组对维持可溶性固形物效果最优,其次是B、C组;6 d之后,B组下降最慢,其次是C组。出现以上现象可能是因为辐照短暂地加快了蔗糖磷酸合成酶、蔗糖合酶合成方向和光合作用,从而积累了少量的可溶性糖等物质[28],但8 d之后,可溶性固形物不再积累且开始下降,这是因为光合作用中暗反应严格依赖温度进行酶促反应[29],在4 ℃低温下,暗反应无法及时还原多糖,而作物本身的干耗仍不断继续,继而导致可溶性糖含量的降低,在12 d,B、C组含量最高,且差异不显著(P>0.05),其次为A组,CK组含量最低。

图5 不同处理方式对鲜切菠菜可溶性固形物的影响Fig.5 Effect of different treatments on soluble solidsof fresh-cut spinach
2.6 光合色素含量的变化
叶绿素是含镁的四吡咯衍生物,当镁离子被氢离子取代后形成脱镁叶绿素,会使叶片出现褐变、发黄等现象[30],因此结合脱镁叶绿素可以动态地评判叶绿素分子的状态。由图6-a和图6-b可知,B组和C组在贮藏过程中使叶绿素含量始终保持在较高水平,叶绿素分子结构较为完整,而A组和CK组含量差异变化相似(P>0.05),呈快速下降趋势,这可能是因为在叶绿体内膜上,每次闪光生成一个产物,而这个产物必须在第2次闪光到来之前被利用掉,若第2次闪光到达太早,则吸收的能量主要以热和荧光的形式损失[31],叶绿素分子会被激发成三线态,但当与基态的氧分子结合时,会较快地将叶绿体分子恢复到基态,但同时氧分子被激发成单线态,单线态氧自由基对生物体损伤较大故不利于维持品质[32]。
类胡萝卜素作为辅助色素存在于高等植物中,吸收光谱在400~500 nm,主要有以下2点功能:(1)作为光合事件的启动者:将吸收的光能传递给叶绿素a从而进行后续的光化学反应。(2)保护叶绿体细胞:胡萝卜素本身可以淬灭单线态氧自由基,本身可以无伤害地衰变回基态。由图6-c可知,CK组含量始终最低,A组由于连续光照,变化最为剧烈,4 d后迅速下降,B组次之,而C组变化最为缓和,在整个贮藏期间都保持了较高水平。因此B、C组不仅可较好地维持类胡萝卜素的含量,还可以维持叶绿素含量。
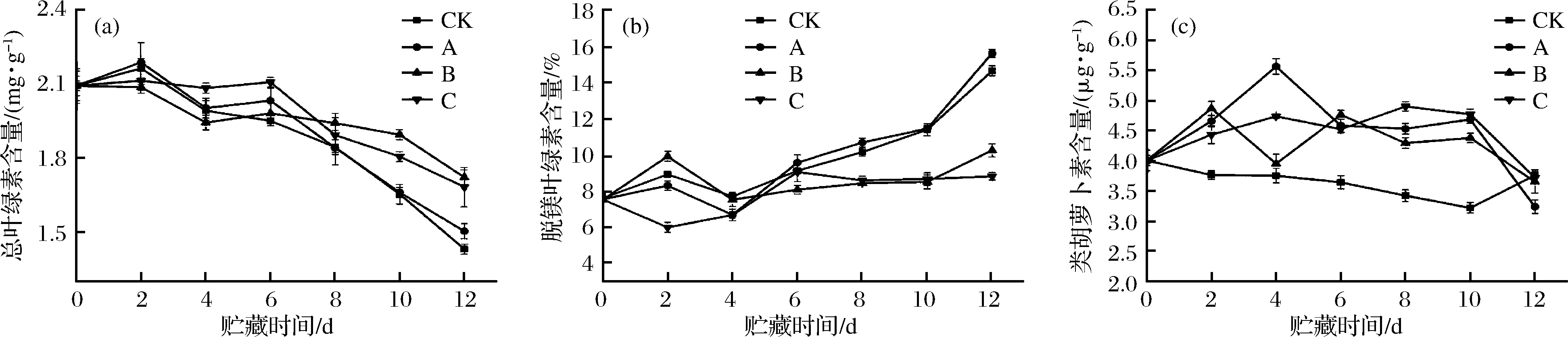
a-总叶绿素的含量;b-脱镁叶绿素的含量;c-类胡萝卜素的含量图6 不同处理方式对鲜切菠菜光合色素的影响Fig.6 Effect of different treatments on photosynthetic pigment of fresh-cut spinach
2.7 Vc含量的变化
对人体来说,Vc是一种人体无法自身合成但又不可或缺的微量元素,主要从果蔬中摄入。同时也是一种抗氧化剂以调节作物的采后生理代谢,已有文献指出,在贮藏过程中,采用光辐照技术处理果蔬,Vc含量均有不同程度上升,如:芹菜[33]、生菜[34]等叶类蔬菜。由图7可得,CK组呈不断下降趋势,各辐照组前6 d呈递增趋势,之后逐渐下降,值得注意的是:单次辐照剂量越大,Vc含量下降速率越快,即A组在贮藏末期含量最低,这一结果同刘超超[35]试验结果一致。

图7 不同处理方式对鲜切菠菜抗坏血酸的影响Fig.7 Effect of different treatments on Vc of fresh-cutspinach
2.8 抗氧化酶含量的变化

3 结论
本试验通过初筛试验以货架期确定最佳光照总量为420 s(1.764 kJ/m2),在这个基础上以不同频率循环辐照4 ℃下贮藏的鲜切菠菜,综合试验结果表明:贮藏期前6 d,以间隔24 h的辐照频率处理鲜切菠菜效果最好,可有效控制总菌、假单胞菌的数量,延缓水分、可溶性固形物的损失,且Vc含量、SOD、APX、POD的活性最高,表明机体在6 d内具有较高的抗逆性能,货架期达10 d;但间隔8 h的辐照频率处理可使鲜切菠菜的货架期达12 d,在第12 天仍可维持最高的水分含量、Vc和可溶性固形物含量,使鲜切菠菜在第12 天仍具有商品价值,而以间隔4 h的辐照频率处理仅使鲜切菠菜的货架期达11 d。因此,可根据不同的保鲜目的,选择不同的照射方式,达到理想的保鲜效果。

a-SOD的含量;b-APX的含量;c-POD的含量图8 不同处理方式对鲜切菠菜抗氧化酶的影响Fig.8 Effect of different treatments on antioxidant enzyme of fresh-cut spinach
