金属离子对植物乳杆菌RS66CD生物膜形成及环境耐受性的影响
2020-01-13赵佳伟敖晓琳蔡义民刘书亮陈安均万胡徐飞王帆何金阳
赵佳伟,敖晓琳*,蔡义民,刘书亮,陈安均,万胡,徐飞,王帆,何金阳
1(四川农业大学 食品学院,四川 雅安,625014) 2(日本国际农林水产研究中心,日本 茨城,305-8686;)3(四川李记乐宝食品有限公司,四川 眉山,620030)
乳酸菌(lactic acid bacteria,LAB)是一类能利用各种糖产生乳酸的革兰氏阳性细菌的总称[1]。乳酸菌不仅应用于工业化生产,而且对人体的健康有着不可忽视的影响。研究证实,乳酸菌可维持肠道健康,克服婴儿腹泻、抗生素相关性腹泻,改善老年痴呆患者的认知、情绪功能等[2-4]。因此乳酸菌功能及开发应用是目前研究的热点。
生物膜(biofilm)这一专有名词在1978年被提出,也有其他学者翻译为生物被膜[5],指菌体被胞外聚合物(EPS)包裹附着在载体表面的混合物[6]。HIROMI等[7]研究了形成生物膜之后的植物乳杆菌JCM 1149和浮游菌株在各种有机酸、乙醇和次氯酸钠中的生长情况,研究结果表明,生物膜中的微生物比浮游菌株表现出更好的抗逆性。KIEW等[8]研究发现,成膜后的鼠李糖乳杆菌比浮游菌株具有更好的耐热性,并且可以在模拟胃肠道的环境中维持更高的活性。
生物膜的形成受到很多因素影响,包括载体表面的粗糙程度、pH、黏附力、基因调控和金属离子等[9-11]。其中金属离子对于生物膜的形成具有明显的作用。一定浓度的Mg2+可以刺激初期生物膜的产生;Fe3+主要是促进胞外蛋白的分泌,产生架桥作用,提高基因的表达水平来提高生物膜的稳定性;低浓度的Na+通过调控相关基因的表达和补偿生物膜表型不稳定来促进生物膜的形成[12]。本试验旨在筛选出对植物乳杆菌RS66CD生物膜形成具有明显促进作用的金属离子,来提高其环境抗逆性。
1 材料与方法
1.1 材料与试剂
植物乳杆菌(Lactobacillusplantarum)RS66CD,从优质传统泡菜中筛选得到,具有良好的发酵性能。
MRS液体培养基,凯恒生物科技有限公司;改良MRS液体培养基(去掉MRS液体培养基中的MgSO4·7H2O和MnSO4·4H2O);NaCl、CaCl2、MgCl2、FeCl3、MnCl2、戊二醛、结晶紫(均为国产分析纯),成都市科龙化工试剂厂。
1.2 仪器与设备
SW-CJ-1F超净工作台,力辰科技;PHS-4C+精密pH计,成都世纪方舟科技有限公司;3001酶标仪,Thermo Scientific公司;SORVALL高速离心机,美国科骏仪表有限公司;EVO18扫描电镜,Carl Zeiss。
1.3 实验方法
1.3.1 植物乳杆菌成膜菌株和游离菌株的制备
试验组(成膜菌株):将活化好的植物乳杆菌按照1%的接种量,接入改良MRS液体培养基,培养基中金属离子的种类、含量和培养条件根据单因素试验和正交试验确定。观察金属离子和不同培养条件对植物乳杆菌RS66CD生物膜形成的影响。
对照组(游离菌株):活化好的植物乳杆菌按1%的比例,接入MRS液体培养基中,37 ℃培养24 h。
空白对照组(未加金属离子):活化好的植物乳杆菌按1%的比例,接入改良MRS液体培养基中,37 ℃培养24 h。
1.3.2 生物膜半定量测试
活化好的菌株按照1%比例接种(其中试验组接种到改良MRS液体培养基,对照组接种到MRS液体培养基中),添加到96孔细胞培养板中,每孔添加200 μL,在不同条件下培养。培养完成后倒出培养液,用无菌水冲洗3次,56 ℃干燥固定1 h。加入0.5%结晶紫50 μL,染色5~10 min,用无菌蒸馏水清洗2~3次,37 ℃晾干,测定OD490 nm[13]。采用OD490 nm来反映生物膜的形成量:A490≤0.17表明没有形成;A490>0.34表明大量生成[14]。
1.3.3 生物膜形态观察
将消毒过后的盖玻片置于24孔板中,按照1∶100的比例将菌体与改良的MRS液体培养基混合均匀,每孔添加1 mL,按后续设计的金属离子浓度及培养条件下培养。取出盖玻片置于2.5%戊二醛磷酸缓冲液中,4 ℃固定8 h,再依次用40%、70%、90%和100%(2次)的乙醇脱除水分,每次15 min,再进行干燥、镀金及扫描电镜观察[15]。以MRS液体培养基在37 ℃下,培养24 h作为对照组。
1.3.4 金属离子对植物乳杆菌RS66CD生物膜形成的影响
分别向改良MRS液体培养基中添加NaCl(40、44、46、48、52、56、60 g/L)、CaCl2(5、15、25、35、45、55 g/L)、MgCl2(5、15、25、35、45、55 g/L)、MnCl2(5、15、25、35、45,55 g/L)、FeCl3(15、25、35、45、55 g/L),考察乳酸菌在不同金属离子及不同浓度对生物膜形成的影响。将过夜活化培养后的植物乳杆菌按1%的比例分别接种至上述的培养基中,振荡摇匀后加到96孔细胞培养板中,每孔添加200 μL,37 ℃放置24 h[16]。按照1.3.2的方法对生物膜形成量进行测定。按照1.3.3的方法进行扫描电镜观察,对试验结果进行验证。
1.3.5 培养条件对植物乳杆菌生物膜RS66CD形成的影响
1.3.5.1 培养温度
在确认最佳金属离子及作用范围下,参照任晓镤[17]的方案,将植物乳杆菌按照1%的比例接种,分别在8、15、20、25、37、42、50 ℃下培养24 h,按照1.3.2的方法测定形成量。
1.3.5.2 培养时间
在确认的最佳金属离子及添加量下,将植物乳杆菌按照1%的比例接种,37 ℃分别培养12、24、36、48、60、72 h[18]。按照1.3.2的方法测定形成量。
1.3.6 正交试验
根据单因素试验结果选取金属离子添加量、培养时间和培养温度3个因素进行正交试验,以植物乳杆菌实际成膜量为标准,未接种的MRS液体培养基作为空白组,如公式(1)所示。
实际成膜量=OD值试验组-OD值空白组

(1)
1.3.7 植物乳杆菌RS66CD生物膜耐受性测定
1.3.7.1 温度耐受性
参照司淼菲[19]的方法,将1.3.6最适培养条件下培养的试验组和MRS液体培养基37 ℃培养24 h的对照组,分别接种到5 mL的MRS液体培养基中,菌液浓度均为106CFU/mL。置于55、60、65、70 ℃下水浴30 min,平板计数,分别计算试验组和对照组的存活率,来比较成膜前后的菌株对温度的耐受性。
1.3.7.2 盐耐受性
将1.3.6最适培养条件下培养的试验组和MRS液体培养基37 ℃培养24 h的对照组,分别接种至5 mL的NaCl含量为60、80、100、120、140 g/L的MRS液体培养基中[16],菌液浓度均为106CFU/mL,37 ℃处理4 h,进行平板计数。分别计算试验组和对照组的存活率,比较成膜前后的菌株对不同盐浓度的耐受性。
1.3.7.3 pH耐受性
将1.3.6最适培养条件下培养的试验组和MRS液体培养基37 ℃培养24 h的对照组,分别接种到5 mL的pH值为2、3、4、8、9的MRS液体培养基中,菌液浓度均为106CFU/mL,37 ℃处理4 h,进行平板计数。分别计算两者的存活率,来比较对不同pH的耐受性。
1.3.7.4 胆盐耐受性
配制胆盐质量浓度为0.25、0.50、1.00、2.00、4.00 g/L的5 mL的MRS液体培养基,将1.3.6最适培养条件下培养的试验组和MRS液体培养基37 ℃培养24 h的对照组分别接种到培养基中,菌液浓度均为106CFU/mL,37 ℃处理4 h,进行平板计数。分别计算试验组和对照组的存活率,来比较成膜前后的菌株对不同胆盐浓度的耐受性。
1.3.7.5 存活率计算
分别计算试验组和对照组经不同条件处理后的存活率,对比两者耐受性。按公式(2)计算:

(2)
1.4 数据分析
每个样品做3个平行,采用SPSS 22.0软件进行统计分析。最终数据表示为平均值±标准偏差,试验结果用SPSS 22.0 软件进行Duncan多重比较和方差分析,显著性水平为0.05,不同字母表示具有显著差异。
2 结果与分析
2.1 不同培养条件对植物乳杆菌RS66CD生物膜形成的影响
2.1.1 不同金属离子对生物膜形成的影响
由图1可知,添加NaCl,CaCl2,MgCl2和MnCl2所测定的OD值均大于0.34,而FeCl3所有浓度下测定的OD值均小于0.17。说明Fe3+促进植物乳杆菌生物膜形成的能力较小,而Na+、Ca2+、Mg2+和Mn2+都具有不同程度促进生物膜形成的能力,其中Na+的促进效果最为明显。但从图1也可以看出,对照组所测OD值大于一些添加低浓度的金属离子。这主要是由于植物乳杆菌RS66CD本身产胞外多糖,并且对照组的培养基更适合微生物的生长,所以会导致更多的菌体附着在96孔板底部。选取Na+,Mg2+,Ca2+,Mn2+和Fe3+所测OD值最大的浓度以及游离菌株进行扫描电镜观察。结果如图2所示,Na+的促进效果最为明显,故确定48 g/L的Na+作为后续试验添加的金属离子。
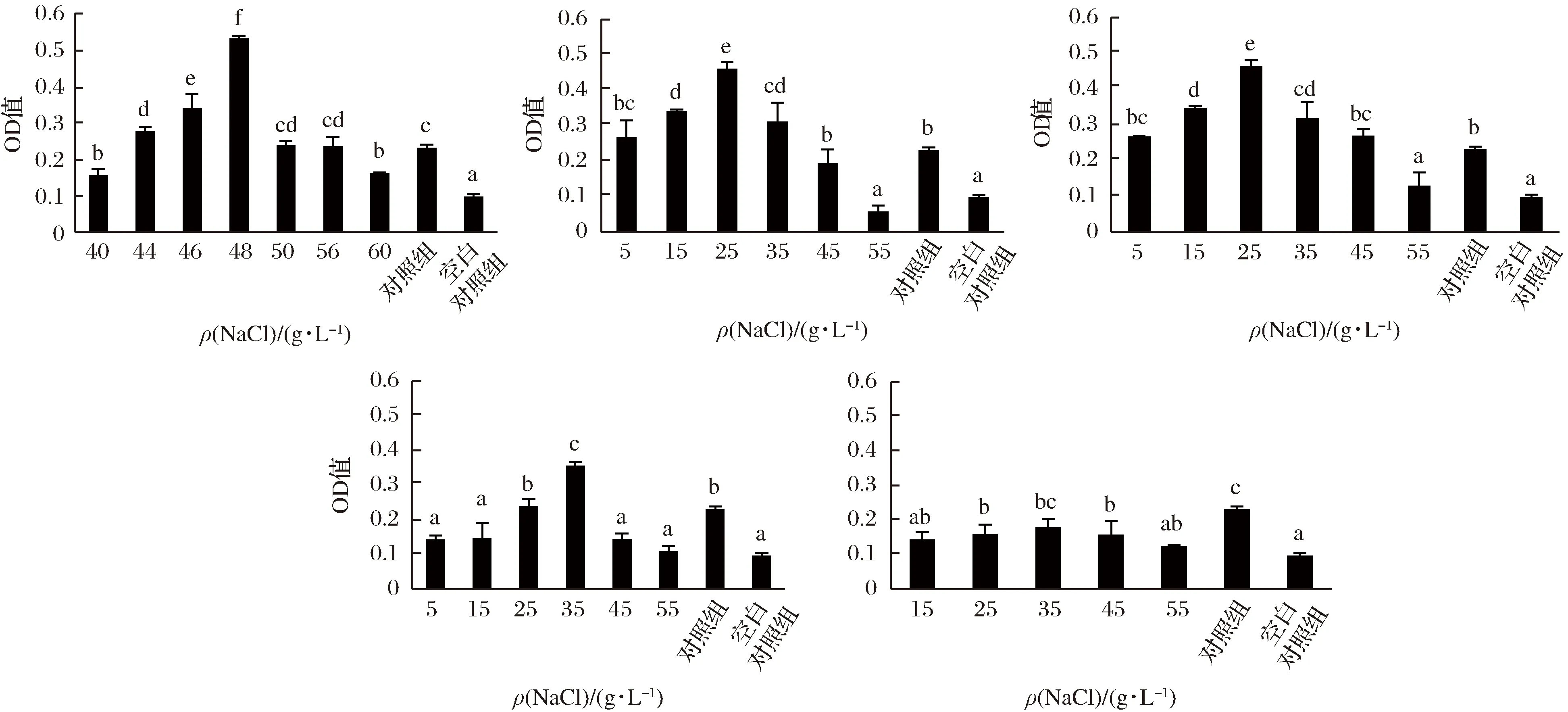
图1 不同金属离子对于植物乳杆菌生物膜形成的影响Fig.1 L. plantarum biofilm effected by different metal ions注:不同字母代表差异显著,P<0.05。下同。

a-Mn2+添加量为35 g/L;b-Ca2+添加量为25 g/L;c- Mg2+添加量为25 g/L;d- Fe3+添加量为35 g/L;e-Na+添加量为48 g/L;f-游离菌株图2 不同金属离子最适浓度下生物膜的扫描电镜图Fig.2 SEM of biofilm at optimum concentrations ofdifferent metal ions
2.1.2 培养时间对生物膜形成的影响
生物膜的形成具有几个明显的生理阶段,包括表面黏附、微菌落形成、生物膜的成熟和生物膜分散[20]。培养时间对植物乳杆菌生物膜形成的影响如图3所示,由于12 h的培养时间较短,菌体还处于生长阶段,产膜量较小,所以附着在96孔板底部的菌体量少,因此OD值也较小。培养至24 h时,开始形成生物膜来抵御盐胁迫的不良环境,36 h处生物膜达到最大量,此时OD值也最大。随着培养时间的增加,生物膜开始逐渐发生解聚,OD值下降。
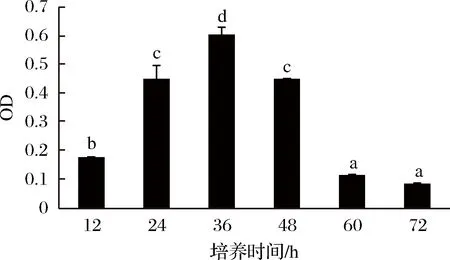
图3 培养时间对植物乳杆菌生物膜形成的影响Fig.3 L. plantarum biofilm effected by culture time
2.1.3 培养温度对生物膜形成的影响
从图4可知,不同温度条件下培养对菌株RS66CD生物膜形成的影响差异性显著。由试验结果来看,在15和37 ℃时出现2个高峰。37 ℃为乳酸菌最适生长温度,因此在37 ℃条件下培养有助于菌体生长,累积的生物膜形成量也最大。15 ℃作为适宜的低温胁迫,菌体在此温度胁迫下,产生生物膜来抵抗不良环境[13]。而培养温度过低或过高都会影响菌体生长,导致菌体密度过低,不能形成稳定的膜结构。

图4 培养温度对植物乳杆菌生物膜形成的影响Fig.4 L. plantarum biofilm effected by culturetemperature
2.2 正交试验结果
根据单因素试验结果,设计了L9(3)4正交试验。以实际成膜量作为评判依据,对试验结果进行分析,选出最优组合。结果如表2所示,对植物乳杆菌生物膜形成最主要的影响因素为时间,其次为Na+浓度及培养温度(B>A>C)。得出最佳培养条件为A3B1C3,即NaCl添加量53 g/L, 40 ℃下培养24 h。将每个单因素最佳浓度,正交试验得出的最佳培养条件和游离菌株通过扫描电镜进行观察,对试验结果进行验证,结果如图5所示,在正交试验确定的最佳培养条件培养的植物乳杆菌形成的生物膜最明显。
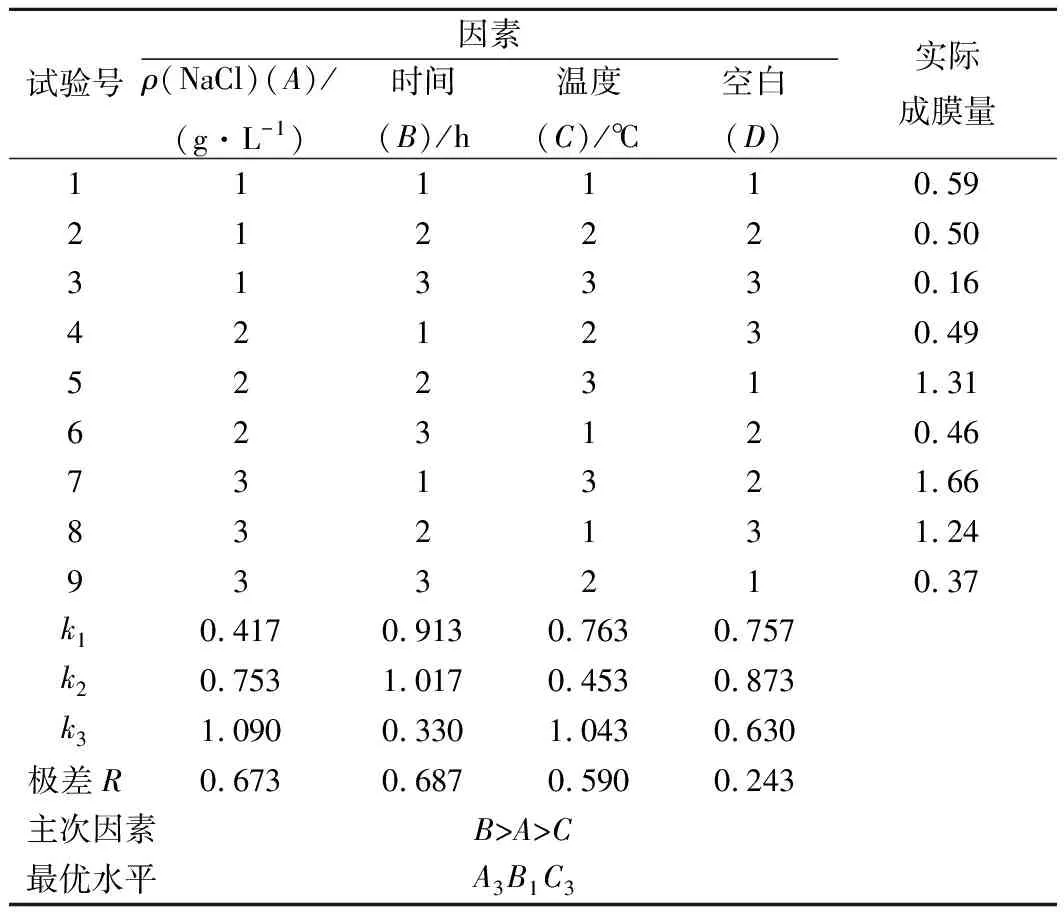
表2 正交试验结果Table 2 Results of orthogonal experiment

a-最适培养温度;b-最适培养时间;c-最适钠离子添加量d-正交试验最适条件;e-游离菌株图5 不同培养条件下生物膜形成以及游离菌株扫描电镜图Fig.5 SEM to observe biofilms of different culture conditionsand free strains
2.3 植物乳杆菌RS66CD在生物膜形成前后对环境耐受性的影响
2.3.1 温度耐受性
结果如图6所示,随着温度的升高,两者的存活率呈下降趋势,但是由于试验组的菌体形成了生物膜,在相同处理温度下比对照组表现出更好的抗逆性。由图6可以看出来,试验组在70 ℃处理30 min后还具有一定的活性,说明生物膜的形成可以更好地保护菌体,同时也可能由于试验组在培养时温度较高,提高了菌体的热应激能力。但在65 ℃以后,试验组和对照组的存活率都大幅度降低,说明生物膜提高菌体对温度耐受性是有一定范围的。在工业生产上可以利用这一特点,来保证杀灭杂菌的同时维持乳酸菌的活性[21]。
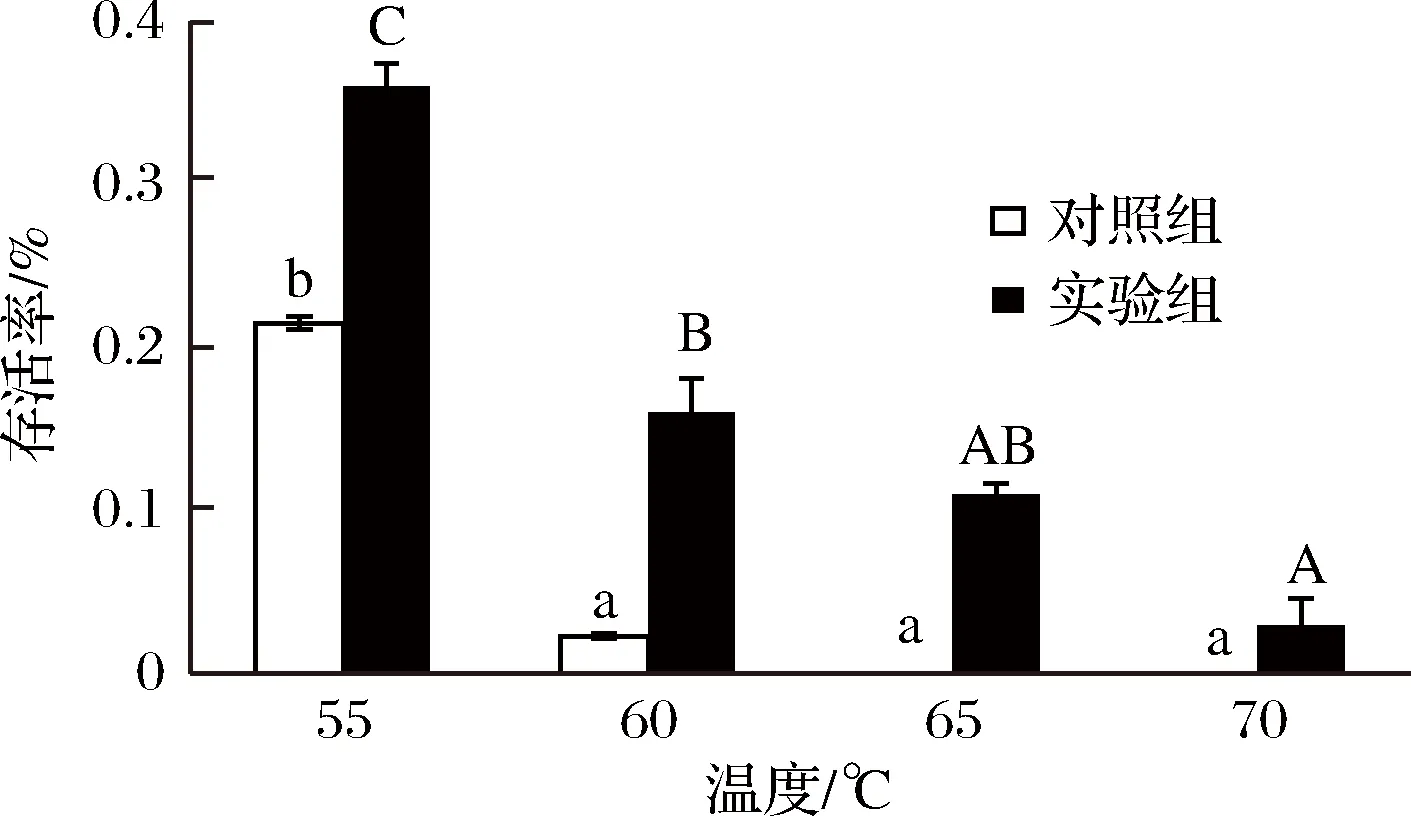
图6 成膜菌株与游离菌株对温度的耐受性Fig.6 The tolerance to temperature of biofilm and planktonicL. plantarum
2.3.2 盐浓度耐受性
结果如图7所示,随着盐浓度的不断增加,两者的存活率均在降低。但是在相同盐浓度条件下,试验组表现出更好的盐耐受性。同时随着盐浓度的增加,试验组存活率的比例也在不断的上升。说明生物膜的形成提高了对盐度的耐受性。

图7 成膜菌株与游离菌株对盐的耐受性Fig.7 The tolerance to NaCl of biofilm and planktonicL. plantarum
2.3.3 pH耐受性
pH值对于微生物的生理活性具有至关重要的影响,可以通过改变酶活性来影响微生物的生理代谢,或者通过改变微生物表面电荷来影响物质的吸收[22]。从图8可以看出,供试pH条件下,试验组和对照组的存活率都在下降,将pH调整到2时,菌体完全失活;试验组比对照组表现出更好的耐受性。这可能是由于EPS的官能团随着pH增加而增加,絮凝效果增强,但是超出这一范围则会呈现相反的效果[23-24]。

图8 成膜菌株与游离菌株对pH的耐受性Fig.8 The tolerance to pH of biofilm and planktonicL. plantarum
2.3.4 胆盐耐受性
从图9可以看出,在胆盐质量浓度低于0.50 g/L时,试验组的存活率明显高于对照组,表现出对胆盐良好的耐受性。植物乳杆菌要进入人体发挥作用,必定要经过胃酸,胆盐等消化液的消化。所以可以通过使植物乳杆菌形成生物膜,来提高进入人体后的存活率。随着胆盐浓度的增加,菌体的存活率也明显下降,但试验组存活率明显高于对照组。说明生物膜的形成可以保护菌体,使其在一定胆盐浓度下存活。
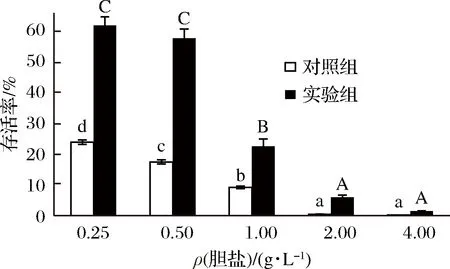
图9 成膜菌株与游离菌株对胆盐耐受性Fig.9 The tolerance to bile salt of biofilm and planktonicL. plantarum
3 讨论
本试验主要研究了几种金属离子对于植物乳杆菌RS66CD生物膜形成的影响,首先确定影响效果最显著的金属离子,在此基础上选取最佳金属离子的添加量、培养时间、培养温度3个单因素,进行正交试验,得到最适培养条件。结果表明,NaCl添加量为53 g/L,40 ℃培养24 h,植物乳杆菌形成的生物膜最显著。
研究结果与徐文生[25]、谢丽斯等[26]的研究结果相似,即在低浓度条件下Na+可以促进生物膜形成,但随着Na+浓度不断升高生物膜的形成会逐渐受到抑制。这可能是由于在一定渗透压下,菌体会产生生物膜来抵抗不良环境。同时在盐胁迫条件下,会导致raf、GroEL、DanK、LuxS等基因的表达,从而调控生物膜的形成[16,27]。并且渗透压可以补偿生物膜表型不稳定,使生物膜变得平滑[28]。
通过比较试验组和对照组处理后的存活率,得出成膜后植物乳杆菌的耐受性显著增加。其中在温度耐受性试验中试验组的存活率比对照组平均高出5倍;pH值耐受性中高出2.8倍;盐耐受性中高出5倍;胆盐耐受性中高出7倍。此外AKINBOBOLA[29]及黄忠强[30]等的研究分别表明,形成生物膜后绿脓杆菌对盐浓度耐受性和金黄色葡萄球菌对消毒剂耐受性显著提升。这可能是由于生物膜的形成可以减缓氧化应激对菌体的伤害,生物膜基质和相关多糖可以提高菌体对极端环境的耐受性[31]。综上所述,生物膜作为一种生物屏障,使存在其中的菌体相较于单个游离菌株在面对不良环境时显示出更好的抗逆性。
在工业生产中,可以通过添加适当的Na+来促使生物膜的形成,从而提高植物乳杆菌对环境的抗逆性。本试验探究了植物乳杆菌RS66CD生物膜形成的最适条件,对比了形成生物膜前后的环境耐受性。但是对调控生物膜形成的相关基因还未进行深入研究。本试验希望为以后利用生物膜提高植物乳杆菌环境耐受性提供新的思路和方法。
