增强海藻糖胞内积累提高大肠杆菌耐受性与乙醇产率
2020-01-13王惊春田康明苗佳王彩喆金鹏王正祥
王惊春,田康明,苗佳,王彩喆,金鹏,王正祥*
1(天津科技大学 化工与材料学院,天津,300457) 2(天津科技大学 生物工程学院,天津,300457)
随着全球化石燃料储备的全面枯竭和人们对环境问题的日益重视,生物质乙醇成为了最具潜力的化石燃料的替代品[1]。大肠杆菌因其具有清晰的研究背景、简单的遗传操作和先进的工业经验,已成为最可能用于生物质乙醇生产的新一代菌种之一。通过引入来源于Zymomonasmobilis的乙醇合成途径,重组大肠杆菌获得了较高的乙醇产率,乙醇占发酵产物的95%以上[2-3]。但与酵母生产菌种相比,重组大肠杆菌对高浓度底物(糖)和产物(乙醇)的耐受性较低。
乙醇发酵过程中菌株受到的主要环境胁迫包括:(1)发酵初期,生物质水解液中高浓度单糖(主要是葡萄糖)的渗透压力对大肠杆菌细胞生长和酶生物合成的不利影响[4-5]。(2)随着发酵的进行,乙醇含量积累,高浓度乙醇开始影响细胞形态和生理活性,成为影响乙醇产量的主要因素。在此环境下,大肠杆菌自身具有应对这些环境压力的耐受机制[6],例如细胞膜组成成分的改变[7-10]、依赖于热激蛋白的压力应激系统[11-12]和积累各种压力保护剂等。
海藻糖是大肠杆菌遭受环境胁迫时,合成并积累的一种最重要的相容性溶质。海藻糖最重要的功能是保护细胞膜结构中的蛋白质和脂质免受不同类型的压力损伤,如高温和冻融等[13]。大肠杆菌中,海藻糖的生物合成由操纵子otsBA负责,otsA编码海藻糖-6-磷酸合成酶,otsB编码海藻糖-6-磷酸磷酸化酶[14]。渗透压力、高温、低温、干燥和生长进入稳定期时,通过rpoS编码的转录起始因子诱导其表达[15-16],激活海藻糖的合成。大肠杆菌在不同的渗透压力条件下,海藻糖通过不同的途径分解,分别由3种酶催化:周质海藻糖酶(TreA)、胞质海藻糖酶(TreF)和海藻糖-6-磷酸水解酶(TreC)。在高渗透压和细胞生长转入稳定期时,TreA表达增加[17-18]。treF的转录仅受高渗透压的微弱诱导,部分依赖于稳定期的转录起始因子RpoS[19]。TreC的表达仅在低渗透压力条件下受海藻糖诱导[20]。
通过基因工程手段改变海藻糖代谢途径,发现大肠杆菌的海藻糖含量与压力耐受性之间存在相关关系[21],而海藻糖积累对产乙醇大肠杆菌工程菌株的压力耐受性和发酵性能的影响,则至今没有解释。为此,本文对具有工业前景的大肠杆菌B0013-1031H中海藻糖代谢途径进行改造,评价重组菌的葡萄糖与乙醇耐受性和乙醇合成效率的改变,以期获得在更高底物浓度下高效合成乙醇的新菌株,为产乙醇大肠杆菌优良菌种的开发提供理论依据。
1 材料与方法
1.1 菌株和质粒
本文所用的菌株和质粒见表1。出发菌株E.coliB0013-1031H为本实验室前期构建,其中pta-ackA,ldhA,pflB和frdA基因已被删除,以阻断副产物乙酸、乳酸、甲酸和琥珀酸的形成[22]。pMD19T-simple载体购自宝生物工程(大连)有限公司。携带Z.mobilis乙醇合成途径关键酶基因pdc和adhB的质粒pEtac-PA,为本实验室前期构建[3]。

表1 本研究所用的菌株和质粒Table 1 Strains and plasmids used in this study
1.2 培养基
LB培养基(5 g/L酵母粉,10 g/L蛋白胨,10 g/L NaCl)作为菌株活化和培养的常规培养基。固体培养基添加15 g/L琼脂。必要时添加100 μg/mL氨苄青霉素(Amp)、30 μg/mL庆大霉素(Gm)或50 μg/mL卡那霉素(Km)。改良M9基础培养基[24]添加5 g/L葡萄糖,作为种子培养基,以及摇瓶发酵试验中细胞生长培养基,细胞生长结束,补加需要的葡萄糖,用于乙醇发酵。LB培养基和M9基础培养基均在121 ℃高压蒸汽灭菌20 min后备用。500 g/L葡萄糖贮备液在115 ℃高压蒸汽灭菌20 min后备用。
1.3 基因操作
常见的分子操作按照标准方法进行。根据本实验室前期建立的方法[23],应用Red同源重组技术,对海藻糖分解代谢相关基因treA、treF和treC进行敲除,对海藻糖生物合成操纵子otsBA的启动子进行替换,本文所用引物见表2。

表2 本研究所用的引物Table 2 Primers used in this study
续表2

引物序列(5′-3′)treCF1ATGCGGAAAGCGAACAGTAtreCR2ATCACGCCGAGGTTGTTACtreCInv1TCATCACCAAAGCGAGAAAtreCInv2AGACCGCAGAAGAGTGGAACaraHF1TTGCTGCTGAATAAAACCACCTTTGGaraHR2 CTCGGGCCCGGTTCTCCTCCTTCTCTTTTCTTATTGPldhAF1GAGGAGAACCGGGCCCGAGCGTCATCAGCAGPldhAR2GTTAACGGTTCTGTCATAAGACTTTCTCCAGTGATGTTGAATCACotsBF1TGGAGAAAGTCTTATGACAGAACCGTTAACCGAAACCCCotsBR2CTCCAGACATCCGGCACACCRldhAF1GAGCGTCATCAGCAGCGTCRaraHR2 GGTTCTCCTCCTTCTCTTTTCTTATTG
1.4 海藻糖代谢途径阻断和合成途径强化突变株的构建
以B0013-1031H染色体DNA为模板,以引物treAF1和treAR2,扩增treA基因,克隆入经SmaⅠ酶切的载体pSKsym后获得重组质粒pSKsym-treA。重组质粒用引物treAInv1和treAInv2反向PCR扩增含有treA基因上下游同源臂和pSKsym载体骨架的片段。提取质粒pSK-EcdifGm,经SmaⅠ酶切后,回收dif-Gm-dif片段,与上述反向PCR扩增的产物连接,获得含有treA基因敲除突变盒的重组质粒pSKsym-treA’::difGm。以该质粒为模板,用引物treAF1和treAR2扩增获得突变盒片段treA’::difGm,DpnⅠ消化模板后纯化备用。将突变盒treA’::difGm电转化入菌株B0013-1031H/pKD46,经Red重组和Xer重组后获得突变株B0013-1031H(ΔtreA::dif)。使用相同的方法在该菌株中进一步敲除treF和treC基因,获得的突变株B0013-1031H(ΔtreA::dif,ΔtreF::dif,ΔtreC::dif)记为JC31。
以大肠杆菌B0013-1031H染色体DNA为模板,分别用引物araHF1/araHR2、PldhAF1/PldhAR2和otsBF1/otsBR2扩增araH(589 bp)、PldhA(287 bp)和otsB(710 bp)基因片段,再通过重叠PCR扩增出araH-PldhA-otsB基因片段。将araH-PldhA-otsB基因片段克隆入载体pMD19T-simple后获得重组质粒T-araH-PldhA-otsB。该重组质粒用引物RldhAF1和RaraHR2反向PCR扩增后,在启动子PldhA上游克隆入dif-Gm-dif片段,获得含有突变盒的重组质粒T-araH’-PldhA-otsB’::difGm。以该重组质粒为模板,再用引物araHF1和otsBR2扩增获得突变盒片段araH’-PldhA-otsB’::difGm,DpnⅠ消化模板后纯化备用。采用电转化方法,将突变盒araH’-PldhA-otsB’::difGm转入菌株JC31/pKD46,经重组后获得的突变株,记为JC41。
1.5 葡萄糖和乙醇耐受性试验
耐受性试验按照文献[25]中方法并加以调整。测试菌株分别划线于LB琼脂平板上,37 ℃培养过夜。挑取单菌落接种于50 mL LB液体培养基中,37 ℃,200 r/min培养12 h。调整菌液初始浓度相同,再用M9培养基稀释不同倍数,每次稀释4倍,分别稀释1、2、3、4和5次。稀释后的菌液分别取5 μL滴于含有不同葡萄糖和乙醇浓度压力的M9平板上,37 ℃培养3 d。
1.6 产乙醇重组菌的构建
将携带Z.mobilis乙醇合成途径关键酶基因pdc和adhB的质粒pEtac-PA分别转化出发菌株B0013-1031H、海藻糖代谢途径改造突变株JC31和JC41,分别命名为B0013-1031H-PA、JC31-PA和JC41-PA。
1.7 乙醇发酵试验
取保藏于-70 ℃的保藏物划线于LB平板(含50 μg/mL Km),37 ℃条件培养过夜,单菌落接种LB液体培养基,37 ℃,200 r/min培养12 h,细胞生长至OD600值为3左右。离心(8 000 r/min,5 min)收集菌体,用M9培养基洗涤并重悬,作为种子液接种于50 mL含5 g/L葡萄糖的M9液体培养基中,接种量控制在初始OD600值为0.1。开始2阶段发酵:好氧为菌体生长阶段,培养条件为37 ℃,200 r/min振荡培养12 h;随后转入发酵阶段,每瓶补加所需的葡萄糖、终浓度1%的蛋白胨和2 g灭菌的CaCO3,用橡皮塞密封瓶口,置于37 ℃培养箱中静置发酵。
1.8 分析与测定
发酵过程中定时取样,检测菌体量、胞内海藻糖含量、葡萄糖浓度和乙醇浓度。
1.8.1 菌体量测定
菌体量采用浊光度法,600 nm波长下测定。细胞干重采用65 ℃烘干至恒重测定。发酵阶段样本先经等体积1 mol/L的HCl去除CaCO3后再通过浊光度法或烘干恒重法测定菌体量。
1.8.2 海藻糖含量测定
取30 mL待测菌液于50 mL离心管中,8 000 r/min离心5 min。弃上清,用1 mL PBS缓冲液洗涤细胞,8 000 r/min离心5 min。弃上清,加2 mL去离子水重悬细胞,吸取1 mL细胞悬液分别于1号和2号EP管中。1号EP管8 000 r/min离心5 min后弃上清,细胞沉淀烘至恒重后测细胞干重。2号EP管于-70 ℃冷冻过夜后,100 ℃煮沸20 min,12 000 r/min离心15 min,上清液即为细胞溶解产物,用于胞内海藻糖含量的测定。
使用酶法测定胞内海藻糖含量(该测定方法通过使用课题组克隆表达的新型海藻糖酶彻底水解海藻糖形成葡萄糖进而通过葡萄糖含量测定标定海藻糖含量。方法建立过程及其在海藻糖测定中的应用近期另文发表)。吸取0.5 mL细胞溶解产物,加0.5 mL海藻糖酶液,以0.5 mL细胞溶解产物加0.5 mL缓冲液作为对照。于55 ℃下反应30 min,使用生物传感仪检测葡萄糖生成量,计算海藻糖浓度。
1.8.3 葡萄糖和乙醇含量测定
采用SBA-40C生物传感仪酶膜法测定葡萄糖和乙醇浓度。所有数据均为3次平行试验结果的平均值。
2 结果与分析
2.1 海藻糖代谢途径阻断和合成途径强化
按照方法1.4,通过同源重组敲除海藻糖分解代谢相关基因treA、treF和treC,获得了突变株JC31;通过同源重组将ldhA基因的启动子整合于JC31菌株的otsB基因上游,获得了突变株JC41。分别用引物treAF1/treAR2、treFF1/treFR2、treCF1/treCR2和araHF1/otsBR2对出发菌株B0013-1031H、突变株JC31和JC41进行PCR鉴定。B0013-1031H分别扩增出treA(2.4 kb)、treF(1.7 kb)、treC(2.8 kb)和araH-otsB(1.3 kb)(图1-A);突变株JC31分别扩增出treA’::dif(1.0 kb)、treF’::dif(1.0 kb)、treC’::dif(1.0 kb)和araH-otsB(1.3 kb)(图1-B);突变株JC41分别扩增出treA’::dif(1.0 kb)、treF’::dif(1.0 kb)、treC’::dif(1.0 kb)和araH’-PldhA-otsB’::dif(1.6 kb)(图1-C)。PCR鉴定结果说明突变株JC31和JC41构建成功。
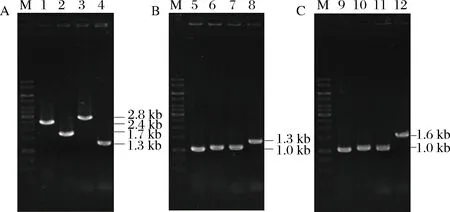
M-1 kb DNA Ladder Marker; 1~4分别为: treA、treF、treC和araH-otsB; 5~8分别为: treA’::dif、treF’::dif、treC’::dif和araH-otsB; 9~12分别为: treA’::dif、treF’::dif、treC’::dif和araH’-PldhA-otsB’::dif图1 E. coli B0013-1031H及其突变株JC31和JC41的PCR鉴定Fig.1 PCR identification of E. coli B0013-1031H(A)and its mutants JC31(B) and JC41(C)
2.2 大肠杆菌海藻糖代谢途径突变株的海藻糖积累
在获得了海藻糖代谢途径突变株后,进一步研究了其胞内海藻糖合成与积累水平。根据所述方法分别测定对照菌株B0013-1031H、突变株JC31和JC41在不同培养条件下的海藻糖积累,结果如图2所示。
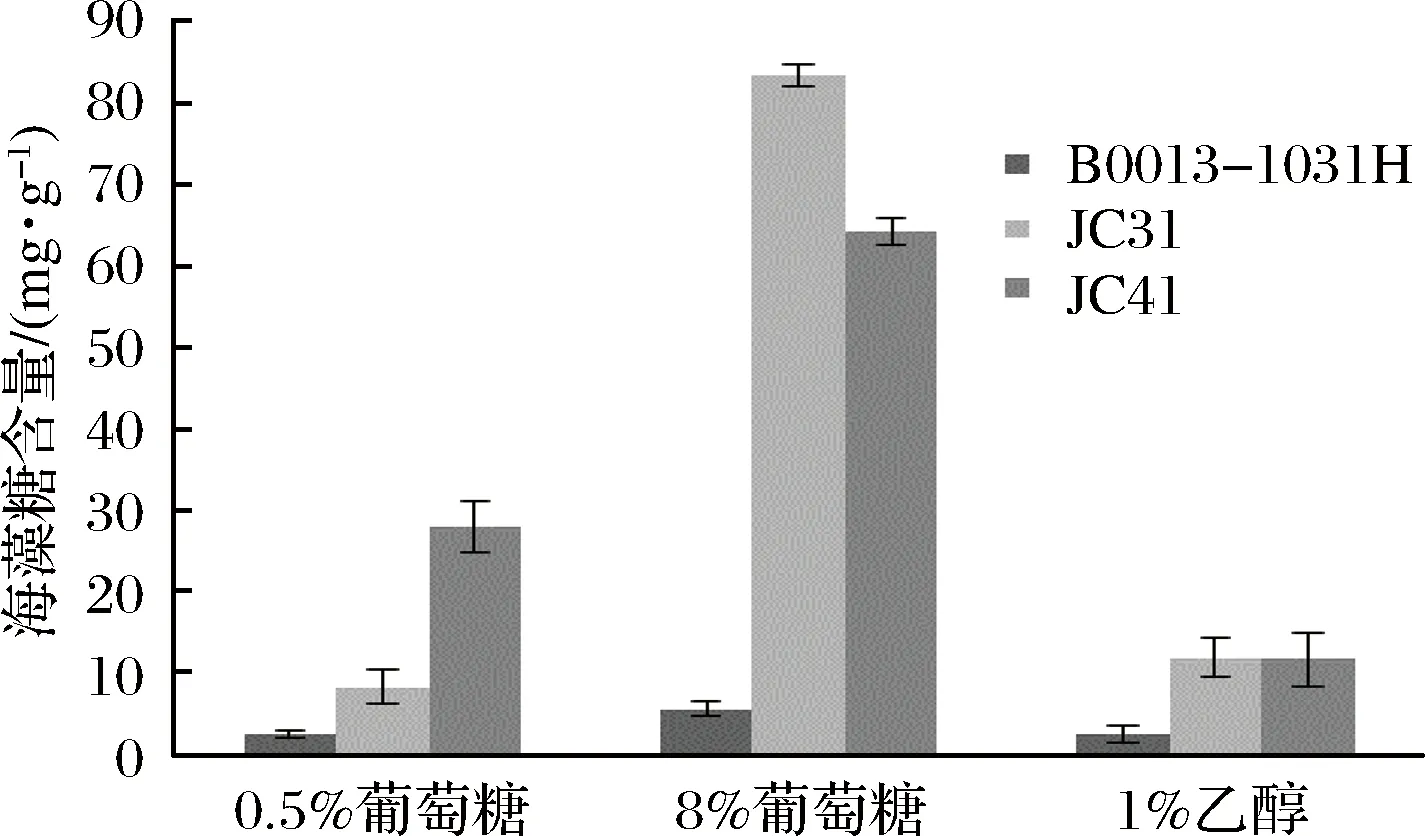
图2 E. coli B0013-1031H及其突变株JC31和JC41在不同培养条件下的胞内海藻糖含量Fig.2 Intracellular trehalose content of E. coli B0013-1031Hand its mutants JC31 and JC41 under different conditions
与菌株构建的预期一致,在不同条件下,突变株JC31和JC41均比对照菌株B0013-1031H具有更高的胞内海藻糖含量。在普通培养条件下(含0.5%葡萄糖的M9培养基),突变株JC31的胞内海藻糖含量为8.28 mg/g细胞干重,约为出发菌株的3倍;突变株JC41的胞内海藻糖含量为28.03 mg/g细胞干重,约为出发菌株的12倍(出发菌株B0013-1031H的胞内海藻糖含量为2.35 mg/g细胞干重)。说明阻断菌株海藻糖分解途径和加强海藻糖合成途径显著提高了菌株的海藻糖积累水平。
2.3 海藻糖积累提高了大肠杆菌底物和产物耐受性
为了评价海藻糖积累对大肠杆菌耐受性的影响,对出发菌株B0013-1031H、突变株JC31和JC41在较高浓度葡萄糖和乙醇胁迫环境下的耐受性进行分析,结果见图3。在没有葡萄糖压力的M9(含0.5%葡萄糖)平板上,出发菌株B0013-1031H、突变株JC31和JC41 3株菌的生长情况基本一致。而在含6%和8%葡萄糖的M9平板上,3株菌的生长均受到较大程度的渗透压力的抑制。但在相同的稀释倍数下,突变株JC31和JC41的菌落数明显多于菌株B0013-1031H。在没有乙醇胁迫的M9(含0.5%葡萄糖)平板上,出发菌株B0013-1031H、突变株JC31和JC41 3株菌的生长情况基本一致。而在仅含1%和2%乙醇的M9平板上,3株菌的生长均受到较大程度的抑制,可见乙醇对细胞活性的伤害很大。但在相同的稀释倍数下,突变株JC31和JC41的菌落数明显多于出发菌株B0013-1031H。说明海藻糖代谢途径突变株JC31和JC41与出发菌株B0013-1031H相比,对高浓度葡萄糖和乙醇压力有更高的耐受性,明显具有更好的生长能力。
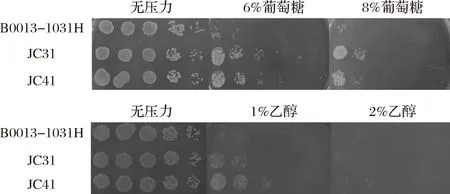
图3 E. coli B0013-1031H及其突变株JC31和JC41的耐受性Fig.3 Stress tolerance of E. coli B0013-1031H andits mutants JC31 and JC41
与菌株的胞内海藻糖含量(图2)对照来看,在无压力条件下,菌株的胞内海藻糖积累对细胞生长没有影响,3株菌的生长状况相似;在葡萄糖压力下,突变株JC31的生长状况最好,其胞内海藻糖含量也最高;在乙醇压力下,突变株JC31和JC41的生长状况相近,胞内海藻糖积累水平也相近。可见菌株对压力环境的耐受性高低与其胞内海藻糖积累水平一致,海藻糖积累越高,菌株的耐受性越强。
2.4 乙醇发酵性能评价
将携带Z.mobilis乙醇合成途径关键酶基因pdc和adhB的质粒pEtac-PA分别转化出发菌株B0013-1031H、突变株JC31和JC41,获得了产乙醇重组大肠杆菌B0013-1031H-PA、JC31-PA和JC41-PA。根据1.7所述方法分别在50和120 g/L葡萄糖浓度下进行乙醇发酵试验,定时取样分析菌体量、葡萄糖、乙醇和胞内海藻糖含量。
在50 g/L葡萄糖的发酵条件下,菌株JC41-PA的菌体量与B0013-1031H-PA和JC31-PA逐渐显示出差异,JC41-PA的最大菌体量为4.13 g/L,较对照提高了6.4%(图4-a),胞内海藻糖的大量积累提高了菌株在50 g/L葡萄糖的发酵条件下的菌体生长能力。3个菌株的乙醇转化率和产量基本相同,但是海藻糖积累菌株JC31-PA和JC41-PA的葡萄糖消耗速率和乙醇合成速率均略低于对照菌株(图4-b),这与其胞内海藻糖含量表现出明显的相关性,胞内海藻糖含量越高的菌株,其乙醇发酵效率越低。在厌氧发酵初期,3个菌株受到葡萄糖渗透压力的诱导,胞内海藻糖积累水平均有大幅度的升高(图4-c)。
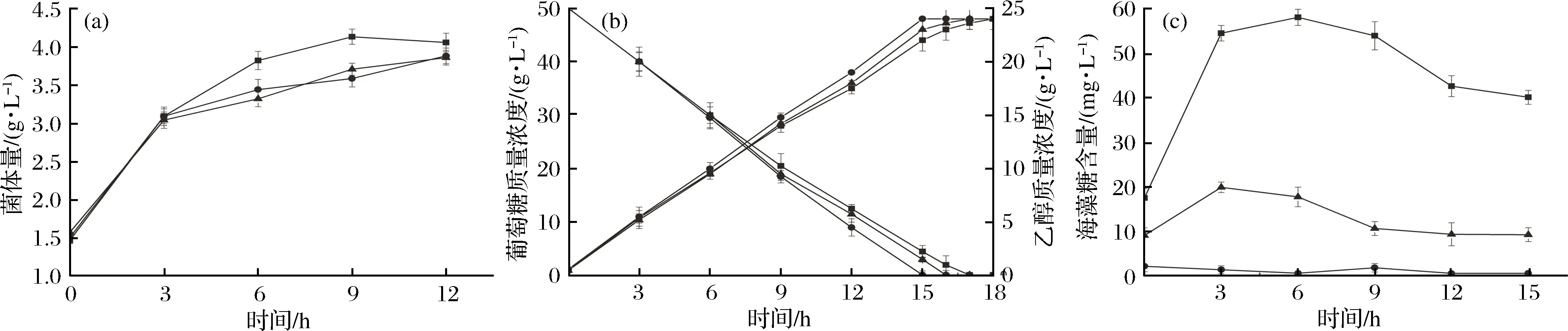
a-菌体量; b-乙醇产量;c-海藻糖积累●-B0013-1031H-PA; ▲-JC31-PA; ■-JC41-PA图4 50 g/L葡萄糖条件下产乙醇重组E. coli的代谢特征Fig.4 The metabolic properties of ethanologenic E. coli in 50 g/L glucose
在高于120 g/L的葡萄糖质量浓度的发酵条件下,菌株B0013-1031H-PA、JC31-PA和JC41-PA的菌体量始终保持基本相同(图5-a),菌株胞内海藻糖积累对其在120 g/L葡萄糖的发酵条件下的菌体生长无显著影响。3个菌株的发酵效率随时间的延长都逐渐降低,伴随乙醇的大量积累,菌株JC31-PA逐渐表现出最优良的发酵性能。菌株JC31-PA的最大乙醇产量为50.6 g/L,较对照菌株提高了5.42%(对照菌株为48 g/L);乙醇转化率为48.72 g/100 g葡萄糖,较对照菌株提高了12.67%(对照菌株为43.24 g/100 g葡萄糖),达到理论转化率的95%(图5-b)。一定程度上提高胞内海藻糖含量,从而提高了菌株在120 g/L高糖浓度下的乙醇发酵性能;而胞内海藻糖更高水平地积累,则可能会阻碍葡萄糖的运输和利用,从而降低了乙醇发酵效率。3个菌株的胞内海藻糖含量不仅在厌氧发酵初期发生大幅增长,在发酵36 h后又发生一次不同程度的增长(图5-c),这可能与高浓度底物的发酵条件下,发酵后期较高的乙醇浓度诱导有关。
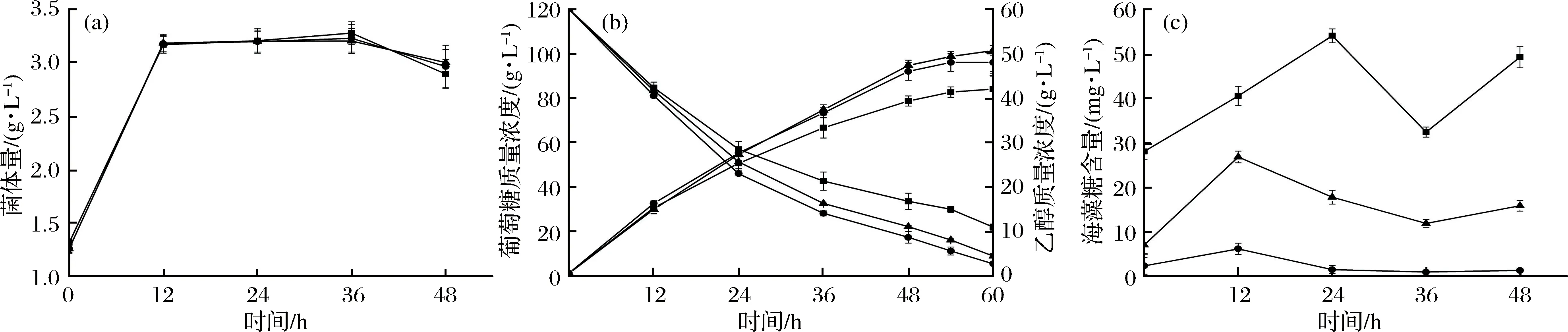
a-菌体量; b-乙醇产量;c-海藻糖积累●B0013-1031H-PA; ▲JC31-PA; ■JC41-PA图5 120 g/L葡萄糖条件下产乙醇重组E. coli的代谢特征Fig.5 The metabolic properties of ethanologenic E. coli in 120 g/L glucose
3 讨论
海藻糖是细胞中一种重要的压力保护剂,海藻糖过量积累可以有效提高大肠杆菌在高温、高渗透压力和一些高浓度发酵产物中的生长能力[21]。
本研究利用Red同源重组技术敲除大肠杆菌B0013-1031H中海藻糖分解途径获得突变株JC31,并进一步加强其海藻糖合成途径获得突变株JC41,显著提高了菌株胞内海藻糖的合成与积累,并显著提高了其对葡萄糖和乙醇的耐受性。
进一步引入乙醇合成途径后,获得了产乙醇重组大肠杆菌B0013-1031H-PA、JC31-PA和JC41-PA。在更高浓度底物(葡萄糖)的发酵条件下,海藻糖积累菌株JC31-PA的发酵性能较对照菌株得到改善,乙醇产量和转化率显著提高。
发酵液中乙醇浓度增加1%,仅蒸馏阶段就可以节约蒸汽150 kg[26],更高的乙醇产率对降低能耗和废液排放、节约生产成本和提高经济效益具有重要意义,因此提高菌株对更高浓度底物和乙醇的耐受性,并提高其在更高浓度底物下的发酵性能成为了对乙醇生产菌种的重要要求。本研究结果表明,通过海藻糖代谢途径改造,一定程度上提高大肠杆菌胞内海藻糖积累,是提高产乙醇重组大肠杆菌在高浓度底物发酵下的乙醇产率的有效策略和技术途径。但是胞内海藻糖含量最高的菌株其发酵效率却有所下降,因此还有待于进一步精确调控海藻糖积累水平,以实现产乙醇重组大肠杆菌耐受性和乙醇产率的最优化,为实现工业化生产奠定基础。
