蛋白酶抑制剂对体外循环瓣膜置换术围术期胰岛素抵抗的影响
2020-01-11江继端蒋鹏飞
江继端 蒋鹏飞


[摘要] 目的 研究體外循环心脏瓣膜置换术中蛋白酶抑制剂的应用对围术期胰岛素抵抗的影响。 方法 选取2018年5月~2019年5月于我院行体外循环瓣膜置换术患者40例,按随机数字表法分为乌司他丁组(U组)和对照组(C组),每组各20例。术中U组于CPB前给予乌司他丁1.2×104 U/kg静滴,C组予等量生理盐水。两组分别于CPB前(T1)、CPB 15 min(T2)、主动脉开放后15 min(T3)、CPB后15 min(T4)、手术结束时(T5)5个时间点,抽取桡动脉血及冠状静脉窦血,比较两组间相应时间点血糖、胰岛素、血浆TNF-α浓度、心肌葡萄糖净摄取量、胰岛素敏感指数的变化及其之间的关系。 结果 C组患者血糖(桡动脉血糖和冠状静脉窦血糖)自CPB开始后明显增高,U组患者血糖自主动脉开放后15 min显著增高,两组患者血糖均于CPB后15 min达峰值;与CPB前比较,两组患者CPB期间和CPB后胰岛素、TNF-α浓度较CPB前均显著增加。T2~T5,U组血糖、胰岛素及TNF-α浓度均显著低于C组相应时点;心肌葡萄糖净摄取量于CPB 15 min时开始下降,说明心肌在CPB期间对葡萄糖的摄取和利用发生障碍;胰岛素敏感指数均显著降低,差异有统计学意义(P<0.001)。U组心肌葡萄糖净摄取量明显高于C组相应时点,表明U组患者心肌对葡萄糖的利用较C组有明显改善,差异有统计学意义(P<0.05)。 结论 体外循环心脏瓣膜置换术患者应用蛋白酶抑制剂可显著降低TNF-α的分泌,减轻胰岛素抵抗,增加心肌对葡萄糖的摄取、利用,有利于术中心肌保护。
[关键词] 蛋白酶抑制剂;体外循环;肿瘤坏死因子-α;胰岛素抵抗
[中图分类号] R654.2 [文献标识码] B [文章编号] 1673-9701(2020)31-0110-04
[Abstract] Objective To study the effect of protease inhibitors on perioperative insulin resistance during cardiopulmonary bypass heart valve replacement. Methods Forty patients who underwent cardiopulmonary bypass heart valve replacement in our hospital from May 2018 to May 2019 were selected and divided into ulinastatin group(group U) and control group(group C) according to the random number table method, with 20 cases in each group. During the operation, group U was given ulinastatin 1.2×104 U/kg intravenously before CPB, and group C was given the same amount of normal saline. Radial artery blood and coronary sinus blood of the two groups were taken at 5 time points before CPB(T1), CPB 15 min(T2), 15 min after the aorta opening(T3), 15 min after CPB(T4), and at the end of the operation(T5). The changes of blood glucose, insulin, plasma TNF-α concentration, net myocardial glucose uptake, insulin sensitivity index and their relationship between the two groups at the corresponding time point were compared. Results The blood glucose(radial artery blood glucose and coronary sinus blood glucose) in group C was significantly increased after CPB, and that in group U was significantly increased at the 15 min afteropening of autonomic artery. The blood glucose of both groups reached the peak at 15 min after CPB. Compared with that before CPB, the concentrations of insulin and TNF-α during and after CPB in both groups were significantly increased compared with those before CPB. The concentrations of blood glucose, insulin and TNF-α in group U were significantly lower than those in group C at T2-T5. The net glucose uptake of myocardium began to decrease at 15 min after CPB, which indicated that glucose uptake and utilization were impaired during CPB. The insulin sensitivity index was significantly reduced, and the difference was statistically significant(P<0.001). The net glucose uptake of group u was significantly higher than that of group C at the corresponding time point, indicating that the utilization of glucose in group u was significantly improved compared with that in group C, and the differences were statistically significant(P<0.05). Conclusion The use of protease inhibitors in patients undergoing cardiopulmonary bypass heart valve replacement surgery can significantly reduce the secretion of TNF-α, reduce insulin resistance, and increase the uptake and utilization of glucose by the myocardium, which is beneficial to intraoperative myocardial protection.
[Key words] Protease inhibitors; Cardiopulmonary bypass; Tumor necrosis factor-α; Insulin resistance
体外循环(Cardiopulmonary bypass,CPB)是心脏瓣膜置换手术的重要辅助手段,体外循环与术中全身炎性反应的发生关系密切。另一方面,高血糖作为心脏直视手术的一种常见并发症,一直困扰着人们。其发生原因很复杂,CPB期间胰岛素抵抗(Insulin resistance,IR)被认为起着重要作用[1]。目前已有很多研究证实,CPB期间大量产生的炎症因子如肿瘤坏死因子α(Tumor necrosis factor-α,TNF-α)分泌增加在心肌IR的发生机制中起着重要作用[2-3]。乌司他丁作为一种蛋白酶抑制剂,能有效抑制中性粒细胞激活,并间接抑制TNF-α、白介素6(Interleukin-6,IL-6)等炎症因子产生,具有较明确的抗炎与器官保护作用[4],目前已广泛应用于体外循环心脏瓣膜置换术中。但蛋白酶抑制剂能否通过其抑制炎症反应的作用对术中IR及血糖的变化产生影响,目前尚未见报道。本研究拟应用蛋白酶抑制剂控制体外循环术中炎症反应,抑制TNF-α等炎症因子的分泌,探讨体外循环瓣膜置换术中蛋白酶抑制剂对IR的影响,现报道如下。
1 资料与方法
1.1 一般资料
选择2018年5月~2019年5月于我院行体外循环心脏瓣膜置换术的患者40例,纳入标准:①无糖尿病史,无其他内分泌及代谢异常史者;②无超重及肥胖者;③术前肝肾功能、凝血功能無异常者;④接受首次、择期体外循环瓣膜置换术者。排除标准:既往有心脏手术史,肝肾功能严重受损,有糖尿病史,过敏体质,哺乳及妊娠期妇女等。本研究中所有患者均签署知情同意书,并经医院医学伦理委员会审核批准。
按随机数字表法分为乌司他丁组(U组)和对照组(C组),每组各20例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性,见表1。
1.2 方法
患者入手术室后予常规心电监护,建立外周静脉通道,在局麻下行桡动脉穿刺置管,用于持续动脉血压监测和动脉血标本采集。所有患者均在气管插管静吸复合麻醉及中低温CPB辅助下进行手术。麻醉诱导:静脉注射咪哒唑仑(江苏恩华药业股份有限公司,批准文号:国药准字H19990027)0.05~0.10 mg/kg、舒芬太尼(宜昌人福药业有限责任公司,批准文号:国药准字H20054172)0.3~0.5 μg/kg、丙泊酚(四川国瑞药业有限责任公司,批准文号:国药准字H20030115)1 mg/kg、苯磺顺阿曲库铵(江苏恒瑞医药有限公司,批准文号:国药准字H20060869)0.1 mg/kg,3~5 min后,肌松完全后插入气管导管,调整气管导管位置,呼吸机控制呼吸。术中静脉持续泵注瑞芬太尼(宜昌人福药业有限责任公司,批准文号:国药准字H20030197),间断静脉注射苯磺顺阿曲库铵,辅以七氟烷(上海恒瑞医药有限公司,批准文号:国药准字H20070172)吸入维持麻醉。麻醉深度:脑电双频指数(Bispectral index,BIS)维持在40~60。术中U组于CPB前给予乌司他丁1.2×104 U/kg静滴,C组予等量生理盐水。所有患者均使用Stockert S5体外循环机和Maquet VKMO78000成人膜式氧合器。采用非搏动性灌注,灌注流量范围为2.2~2.4 L/(m2·min)。行主动脉及上下腔静脉插管(单纯主动脉瓣置换术采用右房插管),常规放置左房引流管。阻断主动脉后,经主动脉根部灌注心脏停跳液(需行主动脉瓣置换术患者切开主动脉后经左右冠状动脉灌注),停跳液为4∶1含血冷晶体心肌保护液,每25分钟灌注1次。
麻醉诱导后行右锁骨下静脉穿刺,将单腔20 G深静脉导管置入右心房冠状静脉窦水平(置入长度约17~18 cm),体外循环开始后切开右心房将该导管置入冠状静脉窦内,以便采集冠状静脉窦血标本[5]。
1.3 标本采集与测定
两组分别于CPB前(T1)、CPB 15 min(T2)、主动脉开放后15 min(T3)、CPB后15 min(T4)、手术结束时(T5)5个时间点,采集桡动脉血2 mL和冠状静脉窦血7 mL,其中桡动脉血及冠状静脉窦血标本各2 mL用于血气分析检测血糖,余冠状静脉窦血5 mL在3000 r/min离心5 min分离出血浆,置入4℃冰箱中保存备用。
将动脉血及冠状静脉窦血标本各2 mL利用GEM Premier3000血气分析仪分别行血气分析检测血糖。血浆TNF-α浓度使用酶联免疫吸附试验(ELISA)双抗体夹心法检测,胰岛素浓度采用放射免疫分析法测定。
1.4 数据换算
心肌葡萄糖净摄取量[Glu(a-v)]=桡动脉血糖(Glua)-冠状静脉窦血糖(Gluv);胰岛素敏感指数=1/(I×G),I为胰岛素,G为冠状静脉窦血糖,以上数值均为同一时间点测定值。
1.5 统计学方法
应用SPSS24.0统计学软件进行分析,正态分布的连续型变量以均数±标准差(x±s)表示,组间比较使用独立样本t检验,计量资料以[n(%)]表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者各时间点血糖及心肌葡萄糖代谢比较
C组患者血糖(桡动脉血糖和冠状静脉窦血糖)自CPB开始后明显增高,U组患者血糖自主动脉开放后15 min开始增高,两组患者血糖均于CPB结束后15 min达峰值,此后逐渐降低,但至手术结束时尚未恢复到CPB前水平。T2~T5,U组患者血糖显著低于C组相应时点,差异有统计学意义(P<0.05)。主动脉开放后两组患者心肌葡萄糖净摄取量均显著下降,T3~T5,U组心肌葡萄糖净摄取量明显高于C组,差异有统计学意义(P<0.05)。见表2。
2.2 两组患者各时间点TNF-α比较
CPB开始后两组患者的血浆TNF-α浓度逐渐增加,于主动脉开放15 min达峰值,停CPB后仍显著高于CPB前。T2~T4血浆TNF-α浓度与T1相比显著增加,差异有统计学意义(P<0.05)。T2~T5 U组TNF-α浓度显著低于C组相应时点,差异有统计学意义(P<0.05)。见表3。
2.3 两组患者各时间点胰岛素比较
两组患者胰岛素浓度自CPB开始后显著增高,于CPB开始后15 min时达峰值,至手术结束时仍显著高于CPB前。T2~T5,U组胰岛素浓度显著低于C组相应时点,差异有统计学意义(P<0.05)。见表4。
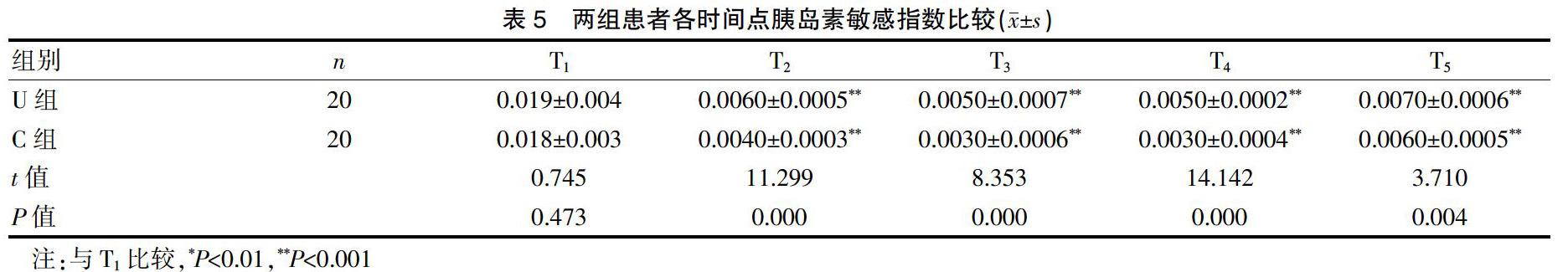
2.4 两组患者各时间点胰岛素敏感指数比较
两组CPB期间胰岛素敏感指数均显著下降,于主动脉开放15 min时降至最低,此后逐渐升高,但至手术结束时仍显著低于CPB前。T2~T5,两组患者的胰岛素敏感性较CPB前显著下降,其中,U组胰岛素敏感指数明显高于C组相应时点,差异有统计学意义(P<0.05)。见表5。
3 讨论
体外循环心脏手术由于麻醉与手术的剧烈创伤、体外循环管路对血液的刺激、体外循环中的低体温与血液稀释及非生理性灌注、心肌缺血再灌注损伤等因素使应激激素和TNF-α等炎症介质的分泌大量增加,引起全身炎症反应,同时细胞对胰岛素的敏感性降低,导致IR的产生,血糖显著升高[6-7],心肌对葡萄糖的摄取及氧化利用减少,造成术后心肌功能受损。有研究表明,体外循环期间的缺血心肌是TNF-α等炎症介质的重要来源[8-9]。
蛋白酶抑制剂是一种重要的围术期抗炎症和脏器保护药物,可减少促炎因子、增加抗炎因子,调节促炎与抗炎平衡,从而减轻炎症反应和心肌缺血再灌注损伤。其中乌司他丁最为常用,目前已广泛应用于各种体外循环手术。目前已有研究表明,乌司他丁对体外循环心脏手术中的炎症反应有明显抑制作用[10]。石佳等[11]研究发现乌司他丁可显著抑制体外循环手术中TNF-α等炎症介质的分泌。周涛等[12]研究发现,乌司他丁可减轻犬体外循环手术后的胰岛素抵抗,该作用与乌司他丁减轻机体炎性反应有关。
本研究结果显示,CPB开始后两组患者血浆TNF-α浓度均显著增加,但U组患者TNF-α增高程度明显低于C组,表明乌司他丁可显著抑制体外循环瓣膜置换术中TNF-α等炎症介质的分泌。与石佳等[11]、周涛等[12]的研究结果一致。
本研究结果显示,两组患者CPB开始后血糖和胰岛素浓度均明显增高,表明心内直视手术中血糖升高不是由胰岛素分泌减少所致,而是由于机体对胰岛素的敏感性降低引起的。两组患者胰岛素敏感指数和心肌葡萄糖净摄取量的变化表明CPB开始后心肌对胰岛素的敏感性较CPB前明显降低,心肌对葡萄糖的摄取及氧化利用发生严重障碍,说明CPB期间发生了严重的胰岛素抵抗。同时TNF-α分泌程度与IR程度的变化基本一致,表明TNF-α在IR的发生中起了重要作用。大量资料表明,在肿瘤、感染、创伤等病理情况下,机体的TNF-α水平明显增高,并呈现明显的IR状态[13],表明IR的发生与TNF-α含量的升高密切相关。临床实验结果也从多方面揭示,TNF-α有明显抑制胰岛素的作用[14-15]。本研究结果显示,U组相对C组TNF-α分泌明显减少,胰岛素抵抗程度也相应减轻,这一结果说明,蛋白酶抑制剂能明显减轻体外循环瓣膜置换术中IR的程度,其作用可能与抑制CPB期间炎症反应有关。
综上所述,在体外循环心脏瓣膜置换手术中应用蛋白酶抑制剂,可有效抑制TNF-α等炎症介质的分泌,减轻IR的程度,增加心肌对葡萄糖的摄取及利用,从而有利于保护心肌功能。
[参考文献]
[1] 隋东虎,石应康,王儒蓉,等. 体外循环缺血再灌注后心肌胰岛素抵抗现象的初步研究[J]. 中国胸心血管外科临床杂志,2001,8(1):28-31.
[2] Olson NC,Callas PW,Hanley AJ,et al. Circulating levels of TNF-α are associated with impaired glucose tolerance,increased insulin resistance,and ethnicity:the insulin resistance atherosclerosis study[J]. J Clin EndocrinoI Metab,2012,97(3):1032-1040.
[3] 张建,汤全,刘达兴. 体外循环缺血再灌注后心肌缺血胰岛素抵抗与相关因子变化关系的研究[J]. 心肺血管病杂志,2014,33(4):562-565.
[4] 李克寒. 乌司他丁对体外循环心脏瓣膜置换术患者围术期IL-6和TNF-α的影响[J]. 山东医药,2011,51(43):83-84.
[5] 刘凡,李保华,崔炜,等. 冠状静脉窦导管放置方法及常见问题解决方案[J]. 临床荟萃,2006,21(1):36.
[6] Liang UY,Wu HS,Li J,et al. Role of insulin receptors in myocar-dial ischaemia-reperlusion injury during cardiopulmonary by-pass[J]. Acta Cardiol,2011,66(3):323-331.
[7] Krinsley J. Perioperative glucose control[J]. Curr Opin Anaesthesiol,2006,19:111-116.
[8] Bennett-Guen-ero E,Panah MH,Bodiao CA,et al. Automated de-teetion of gastric lumimd partial pressure of carbon dioxide duringcardiovascular surgery using the Tonocap[J]. Anesthesiology,2000,92:38-45.
[9] Summer WR. Severe sepsis:New concepts in pathogenesis andmanagement[J]. Am J Med Sci,2004,328:193-195.
[10] 劉恋,陈榕,夏中元,等. 乌司他丁降低体外循环术后患者炎性反应的系统评价[J]. 山西医科大学学报,2016, 47(7):653-657.
[11] 石佳,薛庆华,吕红,等. 蛋白酶抑制剂对体外循环心脏手术围术期炎性因子的影响[J].心肺血管病杂志,2012,5(3):288-292.
[12] 周涛,李遂宁,向道康,等. 乌司他丁对犬体外循环心内直视手术胰岛素抵抗的影响[J].中华实验外科杂志,2016,33(9):2166-2169.
[13] Rapp-Kesek D,Stridsberg M,Andersson LG,et al. Insulin-resist-ance after Cardiopulmonary bypass in the elderly patient[J]. Scand Cardiovasc J,2007,41:102-108.
[14] Plomgaard P,Bouzakri K,Krogh-Madsen R,et al. Tumor necrosis factor-alpha induces skeletalmuscle Insulin resistance in healthy human subjects via inhibition of Akt substrate 160 phos-phorylation[J]. Diabetes,2005,54:2939-2945.
[15] Lorenz RA,Lorenz RM,Codd JE. Perioperative blood glucose control during adult coronary artery bypass surgery[J]. Aorn J,2005,81(1):126,144,147-150.
(收稿日期:2020-07-22)
