脑出血患者血清一氧化氮、血管内皮生长因子及低氧诱导因子-1α水平与病理特征和预后的关系
2020-01-09马红梅赵春水郝彦超
马红梅, 赵春水, 郝彦超
开封市中心医院神经内科一病区(河南开封 475000)
脑出血 (intracerebral hemorrhage,ICH)是指非外伤引发的脑实质内血管破裂出血,占全部脑卒中的20%~30%[1]。由于其发病急、起病快、病情严重,患者的临床致残率、病死率均处于较高水平,且极易出现预后不良,针对寻找脑出血早期预测及预后不良的特异性指标十分必要。研究发现[2],脑出血后,患者出血部位及周围组织极易出现损伤及功能障碍,致使血液中众多生化指标出现异常。其中,脑出血患者血清一氧化氮(nitric oxide,NO)作为评价血管内皮功能的公认指标因能量代谢受阻往往会显著提高[3]。近年来人们关于心脑血管疾病的相关研究表明[4],脑出血的预后与患者机体的多种细胞因子水平存在一定联系,其中血管内皮生长因子(vascular endothelial growth factor,VEGF)、低氧诱导因子-1α(hypox iainducible factor-1α,HIF-1α)与脑出血病情的发展与预后都有着一定的联系[5-6]。因此,为进一步探究脑出血患者血清相关指标与脑出血患者临床表现及预后的相关性,收集本院收治的脑出血患者51例进行研究,现报告如下。
1 资料与方法
1.1 一般资料 选取本院急诊科室2016年3月至2018年12月期间收治的脑出血患者51例作为观察组,选取本院体检中心同期健康人群40例为对照组,收集其临床资料进行研究与分析。其中,观察组男32例,女19例,年龄45~79岁,平均(62.35±8.22)岁,患者均为首次出血,病程不超过24 h;对照组男23例,女17例,年龄45~78岁,平均(61.42±7.35)岁。两组患者一般资料比较见表1,其中观察组高血压病史患者显著多于对照组,差异有统计学意义(P<0.05),其余资料差异无统计学意义(P>0.05)。纳入标准:观察组患者均参考《中华医学会第四届全国脑血管病学术会议》修订的脑血管病诊断标准确诊为脑出血,均采取保守治疗。观察组、对照组均排除:(1)恶性肿瘤患者;(2)心、肝、肾功能不全者;(3)并发有其他心脑血管疾病者;(4)合并自身免疫系统疾病者;(5)妊娠、哺乳期妇女。本研究经医院伦理委员会批准通过,患者及家属知情并同意。


项目例数性别(例)男女年龄(岁)体质指数(kg/m2)吸烟史(例)高血压史(例)观察组51321962.35±8.2227.33±7.842636对照组40231761.42±7.3526.43±8.561615t/2值0.2580.5610.5221.0889.963P值0.6120.5760.6030.2970.002
1.2 方法 观察组患者分别于入院次日和接受治疗后第30 天取其清晨空腹静脉血4 mL,对照组于体检当天取空腹静脉血4 mL,静置1 h后以3 000 r/min转速离心10 min,取血清保存于-80℃冰箱中待用。
统计所有患者的性别、年龄、身高、体重、吸烟史、高血压史等基本资料,计算体质指数=体重(kg)/身高2(m2)。采用硝酸还原酶法测定血清中NO的水平,采用双抗体夹心酶联免疫吸附法(ELISA)测定血清中的VEGF和HIF-1α,试剂盒购自上海酶联生物科技有限公司,操作严格按照说明书进行。
根据患者入院后CT检查图像结果测算出血量,确认出血部位:出血量=π/6×长×宽×层数。根据出血量高低分为小量组:<10 mL;中量组:10~30 mL;大量组:>30 mL。
1.3 预后评价 观察组入院治疗后第90天应用改良Rankin量表(mRS)评价患者的预后情况,0~2分为预后良好,2~6分为预后不良。
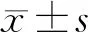
2 结果
2.1 血清NO、VEGF、HIF-1α水平 观察组患者入院次日、治疗后第30天血清中的NO、VEGF、HIF-1α水平均显著高于对照组(P<0.05),观察组患者在治疗后第30天的血清NO、VEGF、HIF-1α水平显著降低(P<0.05)。见表2。
2.2 第30天血清NO、VEGF、HIF-1α水平与临床病理特征的关系 观察组血清NO、VEGF、HIF-1α水平与患者的高血压史、出血量有关,差异有统计学意义(P<0.05)。见表3。


组别例数NO(μmol/L)VEGF(ng/mL)HIF-1α(ng/mL)观察组入院次日5145.36±11.25*#210.82±68.21*#1 867.85±274.35*#第30天5141.23±7.22*183.56±51.89*1 768.51±204.62*对照组4027.48±8.62165.54±40.541 316.38±228.27
*与对照组比较P<0.05;#与第30天比较P<0.05

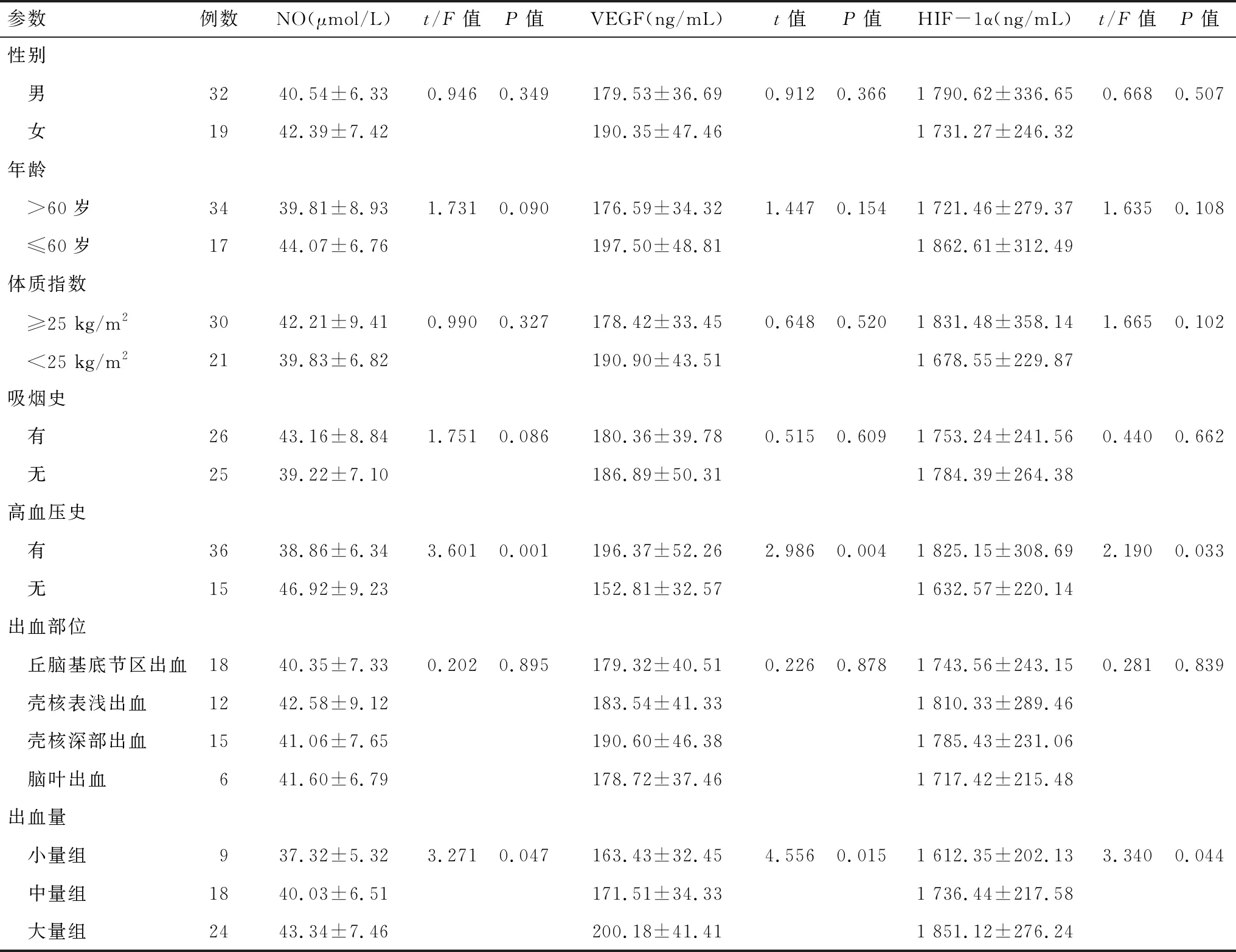
参数例数NO(μmol/L)t/F值P值VEGF(ng/mL)t值P值HIF-1α(ng/mL)t/F值P值性别 男3240.54±6.330.9460.349179.53±36.690.9120.3661 790.62±336.650.6680.507 女1942.39±7.42190.35±47.461 731.27±246.32年龄 >60岁3439.81±8.931.7310.090176.59±34.321.4470.1541 721.46±279.371.6350.108 ≤60岁1744.07±6.76197.50±48.811 862.61±312.49体质指数 ≥25 kg/m23042.21±9.410.9900.327178.42±33.450.6480.5201 831.48±358.141.6650.102 <25 kg/m22139.83±6.82190.90±43.511 678.55±229.87吸烟史 有2643.16±8.841.7510.086180.36±39.780.5150.6091 753.24±241.560.4400.662 无2539.22±7.10186.89±50.311 784.39±264.38高血压史 有3638.86±6.343.6010.001196.37±52.262.9860.0041 825.15±308.692.1900.033 无1546.92±9.23152.81±32.571 632.57±220.14出血部位 丘脑基底节区出血1840.35±7.330.2020.895179.32±40.510.2260.8781 743.56±243.150.2810.839 壳核表浅出血1242.58±9.12183.54±41.331 810.33±289.46 壳核深部出血1541.06±7.65190.60±46.381 785.43±231.06 脑叶出血641.60±6.79178.72±37.461 717.42±215.48出血量 小量组937.32±5.323.2710.047163.43±32.454.5560.0151 612.35±202.133.3400.044 中量组1840.03±6.51171.51±34.331 736.44±217.58 大量组2443.34±7.46200.18±41.411 851.12±276.24
2.3 第30天血清NO、VEGF、HIF-1α水平与预后mRS评分的关系 治疗后第30天观察组患者血清NO、VEGF、HIF-1α水平与其预后mRS评分的Pearson相关性分析结果显示,血清NO、VEGF、HIF-1α水平均与mRS评分呈正相关(r=0.335、r=0.373、r=0.331,P<0.05)。见图1。
2.4 影响患者预后的危险因素分析 将上述临床病理参数、血清NO、VEGF、HIF-1α纳入分析,单因素分析结果显示,具有高血压史、出血量大、血清NO、VEGF、HIF-1α水平高为影响患者预后的危险因素;COX多因素分析结果显示,血清NO、VEGF、HIF-1α水平高为影响患者预后的独立危险因素。见表4。
3 讨论
随着我国社会人口的老龄化及高血压患者的逐年增多,各类心脑血管疾病近年来尤为高发,脑出血更是其中十分常见的一类高危疾病。引发脑出血的常见病因有高血压、高血脂、血液病、脑动脉粥样硬化、血管老化、溶栓治疗等[7],由于患者脑出血后不仅颅内血管出现损伤,周围脑组织亦有水肿,使得血清中各类细胞因子、游离自由基异常表达,更深一步地损害脑组织[8]。近年来,随着医疗水平的提高,脑出血的临床治疗研究取得良好进展,然而其预后情况仍不甚理想。研究发现,患者的预后情况除与自身部分病理特征相关外,患者在脑出血后机体的众多生化指标亦与预后密切相关。因此本文探讨相关细胞因子与脑出血患者临床病理特征及预后的相关性,为疾病的早期预测与预后提供一定参考。

A:NO与mRS评分;B:VEGF与mRS评分;C:HIF-1α与mRS评分

表4 影响患者预后的危险因素分析
NO是血管内皮细胞释放的一类极不稳定的自由基因子,可穿过细胞膜传递信号,有舒张血管、促进血液流通的功能[9]。研究表明,NO在扩张血管、降低血压的同时,能通过扩散进入血液中的血小板细胞中使其活性降低,减少血小板细胞的凝集与对血管内皮的黏附,抑制血栓的形成[10]。但NO在体内的过量积累亦会刺激大脑释放兴奋因子,增加自由基的释放,导致血管通透性增加,形成脑组织水肿[11]。本研究发现,观察组患者在脑出血后,血清NO的水平显著高于对照组,而经过治疗后第30天血清NO水平显著下降,表明脑出血患者脑出血后机体即反应产生大量NO以舒张血管、降低血压,经治疗后随着症状的减轻和治疗的干预,患者血清NO水平水平下降,但仍高于对照组血清NO水平。
VEGF是有着高特异性的血管调控生成因子,有研究表明,患者血清VEGF与脑出血、恶性肿瘤等疾病均有着密切联系,且脑出血患者脑出血后其血清VEGF水平会随之上调并呈现一定的动态变化[12]。本研究结果显示,观察组患者在脑出血后,血清VEGF水平显著高于对照组,治疗后第30天的血清VEGF则显著下降。研究发现,VEGF不仅具有调控血管生成的功能,对神经组织的生成有一定促进作用[13]。由于患者脑出血后出血灶周围血管及组织易出血损坏并发生脑水肿,VEGF可积极参与修复机体神经血管,减少出血部位的细胞死亡,降低周围组织的损伤并提高神经元的存活,保护脑组织[14]。
HIF-1α是机体细胞在缺氧的微环境下发挥关键作用的转录因子,其在正常氧气浓度下往往会迅速降解,而在缺氧的微环境状态下其活性大大提高并参与调控多种相关基因的转录与表达,使得机体细胞适应缺氧状态[15]。本研究结果亦显示,观察组患者在脑出血后HIF-1α显著高于对照组,治疗30 d后则显著下降,表明患者出血后形成的水肿可能使得周围组织处于缺氧状态从而使得血清HIF-1α水平显著升高。另有研究表明[16],VEGF是HIF-1α的靶基因之一,HIF-1α还有促进血管生成、细胞增殖与凋亡等功能,提示HIF-1α在脑出血后亦发挥着一定的积极修复作用。
本研究观察组血清NO、VEGF、HIF-1α水平与患者的高血压史、出血量有关,通过Pearson相关性分析发现,患者治疗后血清NO、VEGF、HIF-1α水平与患者预后mRS评分均呈显著正相关,高岩升[17]、董静等[18]的研究结果与之相似。COX多因素分析结果亦显示血清NO、VEGF及HIF-1α水平高为影响患者预后的独立危险因素,提示NO、VEGF及HIF-1α均可能参与脑出血患者出血后机体的相关保护与调控过程,与患者预后存在密切联系。
综上所述,脑出血患者血清NO、VEGF及HIF-1α水平显著升高,治疗后趋于下降,且血清NO、VEGF及HIF-1α与脑出血患者的预后密切相关,可能成为其预后参考的生物标志物。
