低浓度二甲双胍干预肝癌微环境诱导肿瘤细胞衰老的机制*
2020-01-09陈纪涛殷威达刘兆宇李明方向明刘季芳
陈纪涛, 殷威达, 刘兆宇, 李明, 方向明, 刘季芳
广州医科大学附属第五医院肿瘤科(广东广州 510700)
细胞衰老是指细胞脱离正常的细胞周期,从此丧失增殖能力进入一种相对稳定的状态,是细胞防御DNA损伤或癌基因刺激等造成的细胞生长失控和癌变的重要屏障。诱导肿瘤细胞衰老,不仅可以永久抑制肿瘤细胞的增殖,而且衰老的肿瘤细胞能被免疫系统清除导致肿瘤消退,因此,近年来肿瘤促衰老研究引起了学者们极大的兴趣[1-3]。最新研究发现,肿瘤的发生与其所处的微环境息息相关[4],肿瘤微环境(TME)是一种肿瘤内部营养物资缺乏,酸度高,缺氧、缺血的环境,且其酸度是肿瘤活化的诱导物[5-6]。对TME的深入了解与研究,能够为肿瘤治疗提供新的策略[7]。本课题组前期研究发现,低浓度(1 mmol/L)二甲双胍治疗肝癌HepG2细胞,呈现扁平铺展、体积膨大、衰老样细胞表型,细胞周期停滞于G0/G1期,作为细胞衰老有效标志物的衰老相关β-半乳糖苷酶(SA-β-Gal,其在pH=6.0的条件下表现活性)表达明显升高,肿瘤细胞的增殖受到明显抑制[8]。据文献报道:肿瘤细胞通过有氧糖酵解产生大量乳酸,且瘤体内缺氧环境诱导CA-Ⅻ催化CO2和H2O生成碳酸[9]。这时,肿瘤细胞通过上调质子泵(V型ATP酶,V-ATPases)、钠氢交换蛋白1(Na+/H+exchanger,NHE1)等将肿瘤细胞内的H+排出胞外,从而维持肿瘤细胞内pH呈碱性(pH≥7.4)、细胞外呈酸性(pH=6.5~7.0)的微环境[10-11]。二甲双胍是否通过改变肿瘤细胞内碱性环境促进肝癌细胞衰老目前尚未清楚。因此,2019年3—8月,本文以这一科学问题展开研究,初步探讨二甲双胍通过诱导肝癌细胞衰老抑制其增殖的分子机制。
1 材料与方法
1.1 材料
1.1.1 细胞株 肝癌细胞HepG2、Huh-7、SK-HEP-1、Hep3b2.1-7和PLC/PRF/5购自中国科学院细胞库。
1.1.2 试剂 二甲双胍盐酸盐购自Sigma公司,CellTiter 96® AQueous One Solution Cell Proliferation Assay购自Promega公司,通用组织细胞衰老特异试剂盒购自上海纽杰美生物技术有限公司,NHE1抗体购自Abcam公司,V-ATPase、HIF-1α、Glut1和CAXII抗体及二抗均购自CST公司。
1.1.3 仪器 细胞计数仪(美国,Countstar IC-1000)、多功能酶标仪(美国,BioTEK)、倒置荧光显微镜(德国,莱卡DMi8)、Western blot 系统(美国,Bio-Rad)、化学发光成像系统(美国,ChemiDoc XRS+)。
1.2 实验方法
1.2.1 细胞培养 将肝癌HepG2、Huh-7、SK-HEP-1、Hep3b2.1-7和PLC/PRF/5细胞从液氮中取出,放在37℃水浴锅快速复苏,HepG2细胞用RPMI 1640+10% FBS培养基培养,其它细胞以DMEM+10% FBS培养,置于37℃、5% CO2恒温培养箱培养,根据细胞生长情况定期换液和传代。
1.2.2 衰老相关β半乳糖苷酶(SA-β-Gal)染色实验 肝癌HepG2、Huh-7、SK-HEP-1、Hep3b2.1-7和PLC/PRF/5细胞长到对数生长期时,分别接种5×103个细胞/孔到24孔板中。待细胞贴壁后,实验组中加入浓度为1 mmol/L的二甲双胍,对照组中加入等体积对应培养液。继续培养24 h后终止培养,检测细胞衰老情况。细胞SA-β-Gal检测试剂步骤如下:在开始检测前,先将SA-β-Gal试剂盒里的GENMED染色液(Reagent E)从-20℃的冰箱里取出,放在冰槽里等待融化。然后移取9.5 mL GENMED稀释液(Reagent D)到15 mL离心管,加入500 μL GENMED染色液(Reagent E),混匀后,放进37℃恒温水槽里预热,标记为GENMED染色工作液,然后进行下列操作:(1)小心抽去24孔细胞培养板里的培养液;(2)每孔加入500 μL GENMED清理液(Reagent A),清洗生长中的细胞表面;(3)小心抽去每孔中的清理液;(4)每孔加入500 μL GENMED固定液(Reagent B),覆盖整个生长表面;(5)在室温下孵育5 min;(6)小心抽去固定液;(7)每孔加入500 μL GENMED酸性液(Reagent C),清洗细胞表面;(8)小心抽去酸性液;(9)重复实验步骤7和8各一次;(10)每孔加入400 μL预热的GENMED染色工作液,覆盖整个细胞表面;(11)放进37℃培养箱,孵育3~16 h,或细胞呈现蓝色(注意:避免液体蒸发);(12)表达SA-β-Gal细胞为阳性细胞呈现蓝色,在200×高倍镜下随机选取5 个视野进行细胞计数。
1.2.3 MTS实验 将密度为90%的细胞用PBS清洗3次,加入胰酶消化,吹打混匀后吸取170 μL加入到含20 mL培养基的离心管中,混匀后将其均匀加入到96孔板中,每孔200 μL,放入细胞培养箱培养。24 h后去掉培养基,根据细胞培养液类型,分别加入0 mmol/L 或1 mmol/L二甲双胍的对应培养基,每孔200 μL,左边区域40孔(每种浓度8个复孔)加入0 mmol/L二甲双胍,右边区域40孔加入1 mmol/L二甲双胍,培养24 h。将20 μL MTS分别加入200 μL DMEM(RPMI 1640)+10%FBS的完全培养基中混匀,弃去96孔板的培养基,按培养基类型分别加入200 μL MTS溶液,放入恒温培养箱培养3 h,用多功能酶标仪测量490 nm处吸光度,该吸光度值与细胞活力呈正相关。
1.2.4 Western blot实验 肝癌细胞HepG2、Huh-7、SK-HEP-1、Hep3b2.1-7和PLC/PRF/5培养至对数生长期时,1∶1传代。第2天早上用100 μmol/L COCl2预处理细胞4 h,接着用1 mmol/L二甲双胍孵育24 h后收集细胞提蛋白,BCA法测蛋白浓度。10%SDS凝胶电泳分析,上样量为40 μg。电泳结束后将凝胶上的蛋白通过转膜至PVDF膜,5%脱脂奶粉封闭液2 h。PBST洗3次,每次5 min,根据Marker标志减膜,按照抗体说明书稀释抗体,4℃孵育过夜。第2天早上从4℃冰箱取出孵育盒置于常温条件下30 min,回收一抗并用PBST洗涤3次,5 min/次,室温下孵育二抗1 h,洗涤3次后用凝胶成像系统曝光,检测肝癌细胞中NHE1、V-ATPase、HIF-1α、Glut1和CAXII蛋白的表达。
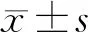
2 结果
2.1 衰老细胞株的筛选 肝癌HepG2、Huh-7、SK-HEP-1、Hep3b2.1-7和PLC/PRF/5细胞,经低浓度二甲双胍处理,SA-β-Gal染色试剂盒检测衰老标志物SA-β-Gal的表达。发现和对照组相比,实验组肝癌细胞HepG2、Huh-7和PLC/PRF/5在药物干预下更容易出现衰老表型(P<0.05),其中Huh-7细胞最为显著(P<0.01)。由于肝癌HepG2、Huh-7细胞衰老百分比较多,故接下来选择这两种细胞进行后续实验研究。见图1和表1。

图1 二甲双胍干预及衰老细胞株的筛选[SA-β-Gal染色(×200)]

表1 SA-β-Gal 阳性细胞数
2.2 细胞增殖能力检测 对SA-β-Gal染色试剂盒检测筛选出的肝癌HepG2和Huh-7细胞常规培养,经1 mmol/L二甲双胍处理,MTS实验检测药物治疗对这两种细胞增殖的影响。结果发现和对照组相比,实验组肝癌细胞增殖受到抑制(P<0.05),其中Huh-7细胞增殖速率显著降低(P<0.01),见表2。


项目HepG2Huh-7对照组1.18±0.201.24±0.17实验组0.98±0.171.02±0.12t值2.1603.121P值0.048 60.006 6
2.3 低氧条件下药物干预对蛋白表达的影响 在缺氧条件下与正常对照组相比,肝癌HepG2和Huh-7细胞经二甲双胍干预后,缺氧诱导因子-1α蛋白表达受到抑制,而GLUT1和CAXII蛋白两组相比无明显差异。此外,实验组肝癌细胞细胞膜质子泵V-ATPase和NHE1表达下调。见图2。

图2 Western blot 检测肝癌细胞微环境相关蛋白表达
3 讨论
据文献报道,2018年全球肿瘤统计数据显示:在世界范围内,肝癌发病率位居恶性肿瘤的第6位,致死率排第4位[12]。中国是肝癌高发区之一,每年大约有50%的新发病例发生在中国,且肝癌1~5年生存率从47%降低至10%[13]。目前对肝癌的治疗分为两大类,传统治疗和新兴治疗:传统治疗有手术治疗,但中晚期无适应症;放化疗,不良反应比较大且患者容易产生耐受。新兴治疗有分子靶向治疗,由于作用靶点有限且容易产生耐药性;生物免疫治疗靶向性强但作用单一;纳米材料等载药技术往往导致毒副作用和免疫排斥。因此,寻找性价比高且有效的治疗措施,阻断肿瘤细胞的恶性增殖,对提高肝癌患者生存率具有重要意义。
近年来研究发现通过药物能够诱导肿瘤细胞衰老从而抑制其增殖,衰老的细胞经免疫系统进行清除,这对于肿瘤的治疗具有巨大的意义,引起了科研人员的极大兴趣[14-15]。本课题组前期体外研究发现,低浓度二甲双胍通过激活AMPK信号通路诱导肝癌细胞衰老[16]。大量国内外研究证实肿瘤微环境影响肿瘤进展的多个方面,比如肿瘤细胞的增殖、侵袭转移和放化疗抗性等,其中肿瘤细胞所处酸性微环境扮演着重要的角色[17-18]。有学者研究报道,肿瘤细胞能通过上调V-ATPases和NHE蛋白表达等将胞内H+排除胞外,进而维持肿瘤细胞内PH碱性(pH≥7.4)、细胞外呈酸性(pH=6.5~7.0)的微环境[10-11]。本次实验结果发现:肝癌HepG2和Huh-7细胞经低浓度二甲双胍干预后,细胞的增殖受到明显抑制,且细胞衰老特异性标志蛋白SA-β-Gal表达升高。由于SA-β-Gal在pH=6.0的条件下表现活性,由此我们推测二甲双胍可能在肿瘤胞内pH调节中发挥重要作用。进一步Western blot蛋白印迹检测发现,低浓度二甲双胍治疗能够抑制HIF-1α的表达,这与前期动物实验研究结果相吻合[19]。而作为HIF-1α下游靶蛋白的GLUT1,其主要向肿瘤细胞内输送葡萄糖,以及参与调节肿瘤微环境酸碱度pH值的CAXII蛋白,以往的研究结果表明二甲双胍抑制其表达[19-20]。本次实验结果显示两组间没有差异,可能与所使用的二甲双胍浓度较低有关。最近我们的肝癌Huh-7细胞采用1 mmol/L二甲双胍处理,使用代谢组学GC-MS代谢流检测和数据分析,结果显示治疗组与对照组相比,糖酵解中丙酮酸和乳酸生成减少。以上数据提示二甲双胍处理导致肿瘤细胞内酸性物质合成减少。而本研究中我们还发现维持肿瘤细胞内外两侧pH值稳定的关键蛋白V-ATPases和NHE1蛋白表达下调,肝癌HepG2和Huh-7细胞呈现衰老样表型。据此我们推测:低浓度二甲双胍可能通过影响V-ATPases和NHE蛋白的活性降低肿瘤细胞内pH值促进其衰老,从而抑制肿瘤细胞的增殖,而酸性物质合成的减少有利于降低肿瘤细胞的侵袭转移能力。但在肝癌中,二甲双胍调节肿瘤微环境的具体方式和机制,目前还有待进一步的研究。
肝癌发病率和致死率一直居高不下,给家庭和社会带来沉重的负担,科研和临床工作者一直在努力寻找有效的治疗手段。然而由于肝癌发病隐匿,反复手术患者耐受性差,对放化疗不敏感,近年来兴起的的分子靶向治疗、纳米材料载药技术仅能在一定程度上抑制肿瘤的生长,但容易产生耐药及免疫排斥,总体疗效仍不尽如人意。只有掌握肿瘤细胞生长及转移所需微环境,才能更好地针对关键靶点进行干预抑制其增殖。二甲双胍是一种临床上经典降糖药物,其价格便宜,本课题组发现该药能够通过诱导肝癌细胞衰老抑制其增殖,通过改变微环境抑制肿瘤转移。该研究为今后利用诱导肝癌细胞衰老这种方式提高肝癌综合疗效提供了新的思路,为肿瘤患者的治疗带来了新的手段,具有十分重要的意义。
