沙利度胺对小鼠脾脏树突细胞TLR7/9介导的细胞因子分泌的影响
2020-01-08刘茂林RippleyBerryLeeSoyoeng
刘茂林,Rippley Berry,Lee Soyoeng
(1. 杭州师范大学 医学院,浙江 杭州 311121;2. 日本国立大阪大学 免疫学前沿研究中心,日本 大阪 565-0871)
沙利度胺(thalidomide, Thal)作为一种治疗免疫介导性疾病的免疫调节剂,被用于强直性脊柱炎(AS)、类风湿关节炎(RA)、白塞氏病(BD)等自身免疫性疾病(autoimmune disease, AID)的治疗[1-3]。研究表明[4],Thal能减少TNF-α及相关基因的表达,减少TNF-α诱导的NF-κβ活化,继而减弱免疫反应。树突状细胞(dendritic cells, DCs)在激发和控制获得性免疫反应中起关键作用,是启动、调控和维持免疫应答的中心环节,沟通固有免疫应答和适应性免疫应答的重要桥梁细胞。许多证据表明[5],DCs不仅是机体免疫应答的始动者,而且在诱导免疫耐受等方面发挥重要作用。DCs通过分泌细胞因子和趋化因子调节炎症反应,在系统性红斑狼疮(SLE)、RA、BD、特发性血小板减少性紫癜(ITP)、银屑病、哮喘等多种AID的发生发展过程中起重要调控作用[6-7]。有研究表明[5,8],DCs已成为免疫治疗的靶点细胞。本研究通过观察Thal对Toll样受体7/9(toll-like receptor 7/9, TLR7/9)介导的脾脏DCs分泌的AID相关细胞因子变化,探讨Thal对DCs免疫调节作用的影响。
1 材料和方法
1.1 实验动物 选用C57BL/6J小鼠12只,雄性,8周龄,体重20±2 g,购自日本CLEA股份有限公司。动物实验经日本国立大阪大学生物科学院动物保护和使用伦理委员会批准。
1.2 主要试剂和仪器 RPMI 1640 培养基购自Sigma公司。小鼠DCs分离盒、CD11c Micro Beads、免疫磁珠分选仪、分选柱购自德国Miltenyi Biotec公司。RNA RNeasy 购自Qiagen公司。小鼠白介素-6 (IL-6)、肿瘤坏死因子-α (TNF-α)、干扰素-α (IFN-α)引物购自Applied Biosystems公司。TLR9激动剂CpG-A、CpG-B购自Gene Design公司,TLR7激动剂咪喹莫特(Imiquimod)购自3M Health Care公司,Thalidomide购自Sigma公司。小鼠IL-6、TNF-α、IFN-α ELISA检测试剂盒购自Biolegend公司。ABI PRISM 7900 HT荧光定量PCR仪购自Applied Biosystems公司。
1.3 小鼠脾脏单个核细胞的制备 小鼠断颈处死,无菌取脾脏,PBS冲洗2次后,去除脾脏表面被膜。于220目金属滤网上,无菌注射器活塞反复研磨脾脏释放细胞,采用70 μm细胞过滤器过滤细胞液,收集细胞并加入PBS稀释至14 mL。
1.4 小鼠脾脏CD11c+树突状细胞的提取 采用免疫磁珠细胞分选(MACS)法收集小鼠脾脏CD11c+树突状细胞,按照试剂盒说明书步骤进行。细胞悬液(1×108个细胞)中加入0.25 μg小鼠Fc受体阻滞剂(CD16/CD32)单克隆抗体、100 μL CD11c微珠。通过MACS分选柱收集磁性标记细胞,所得脾脏CD11c+树突细胞用10 mL RPMI 1640培养基(5×105细胞/mL)重悬后备用。
1.5 脾脏CD11c+树突细胞实验分组 每孔100 μL 2.5×105个小鼠脾脏CD11c+树突细胞于5%CO2细胞培养箱,37℃孵育2 h,设置①不加细胞的质控孔(100 μL PBS,50 mg/mL Thal 1.5 μL)用于控制批间、批内标本检测结果的一致性,②Control组(100 μL 2.5×105个CD11c+树突细胞,PBS 200 μL), ③CpG-A组(100 μL 2.5×105个CD11c+树突细胞,1 μmol/L CpG-A 100 μL),④CpG-B组(100 μL 2.5×105个CD11c+树突细胞,1 μmol/L CpG-B 100 μL),⑤Imiquimod组(100 μL 2.5×105个CD11c+树突细胞,500 μg/mL Imiquimod 20 μL),⑥CpG-A+Thal组(100 μL 2.5×105个CD11c+树突细胞,1 μmol/L CpG-A 100 μL,50 mg/mL Thal 1.5 μL),⑦CpG-B+Thal组(100 μL 2.5×105个CD11c+树突细胞,1 μmol/L CpG-B 100 μL,50 mg/mL Thal 1.5 μL),⑧ Imiquimod+Thal组(100 μL 2.5×105个CD11c+树突细胞,500 μg/mL Imiquimod 20 μL,50 mg/mL Thal 1.5 μL),各组用PBS调整至300 μL,共同培养24 h。
1.6 酶联免疫吸附法(ELISA)检测细胞因子水平 采用ELISA试剂盒分别检测各组细胞上清液中IL-6、TNF-α、IFN-α水平,各组均设3个复孔,实验重复3次。
1.7 实时定量PCR检测 采用RNeasy试剂盒提取小鼠脾脏CD11c+树突状细胞的总RNA并进行反转录,所有操作按照试剂盒说明书进行。使用小鼠IL-6引物:5′-TGTGCAATGGCAATTCTGAT-3′,5′-GGTACTCCAGAAGACCAGAGGA-3′;TNF-α引物:5′-TGCCTATGTCTCAGCCTCTTC-3′,5′-GGTCTGGG CCATAGAACTGA-3′;IFN-α引物:5′-TGGTGCATGAGATGCTCCA-3′,5′-GCCGAGCCCTCTGTGCT-3′。以GAPDH为内参对照,定量PCR过程:50 ℃2 min,95 ℃10 min,95 ℃循环40次15 s,60 ℃1 min。IL-6、TNF-α、IFN-αmRNA相对表达量采用ΔΔCt法,实验重复3次。
1.8 统计学方法 采用SPSS18.0统计学软件,计量资料比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Thal对小鼠脾脏树突细胞表达IL-6的影响 单用TLR9激动剂CpG-A、CpG-B的CpG-A组、CpG-B组,单用TLR7激动剂的Imiquimod组的小鼠脾脏树突细胞IL-6 mRNA和IL-6表达量均高于对照组,差异均有统计学意义(P<0.05);CpG-A+Thal组、CpG-B+Thal组、Imiquimod+Thal组小鼠脾脏树突细胞IL-6 mRNA和IL-6表达量均分别低于CpG-A组、CpG-B组、Imiquimod组,差异均有统计学意义(P<0.05);见图1、图2。
2.2 Thal对小鼠脾脏树突细胞表达TNF-α的影响 单用激动剂的CpG-A组、CpG-B组和 Imiquimod组的小鼠脾脏树突细胞TNF-α mRNA和TNF-α表达量均高于对照组,差异均有统计学意义(P<0.05);CpG-A+Thal组、CpG-B+Thal组、Imiquimod+Thal组小鼠脾脏树突细胞TNF-α mRNA和TNF-α表达量均分别低于CpG-A组、CpG-B组、Imiquimod组,差异均有统计学意义(P<0.05);见图3、图4。
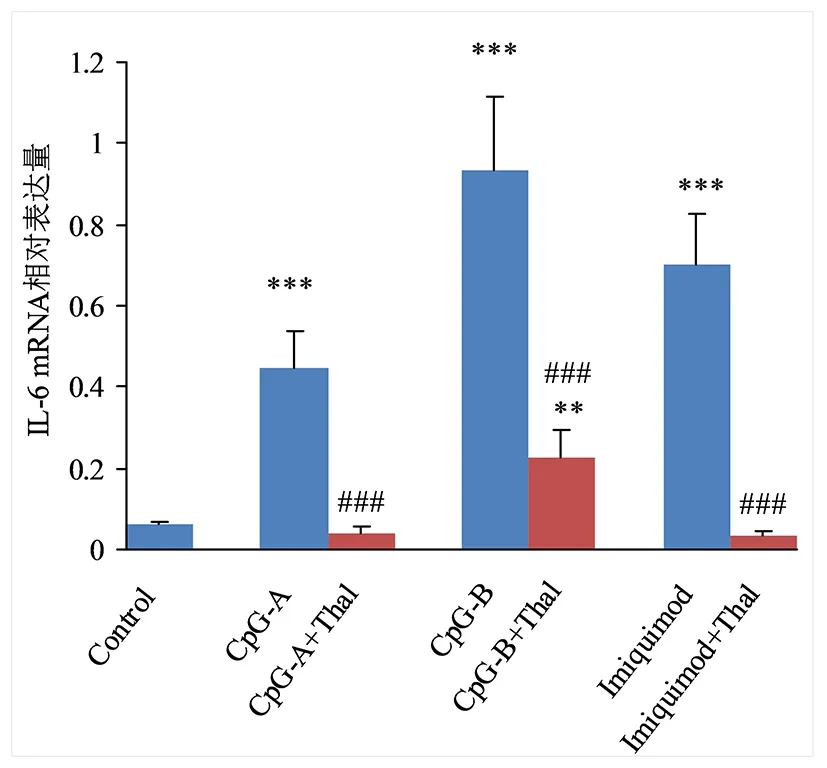
与Control组比较,**P<0.01,***P<0.001; 与各单用激动剂组比较,### P<0.001。图1 沙利度胺对小鼠脾脏树突细胞IL-6 mRNA表达的影响
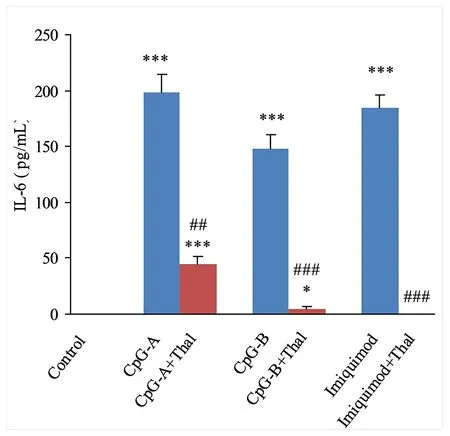
与Control组比较,*P<0.05,***P<0.001; 与各单用激动剂组比较,## P<0.01, ### P<0.001。图2 沙利度胺对小鼠脾脏树突细胞IL-6表达的影响
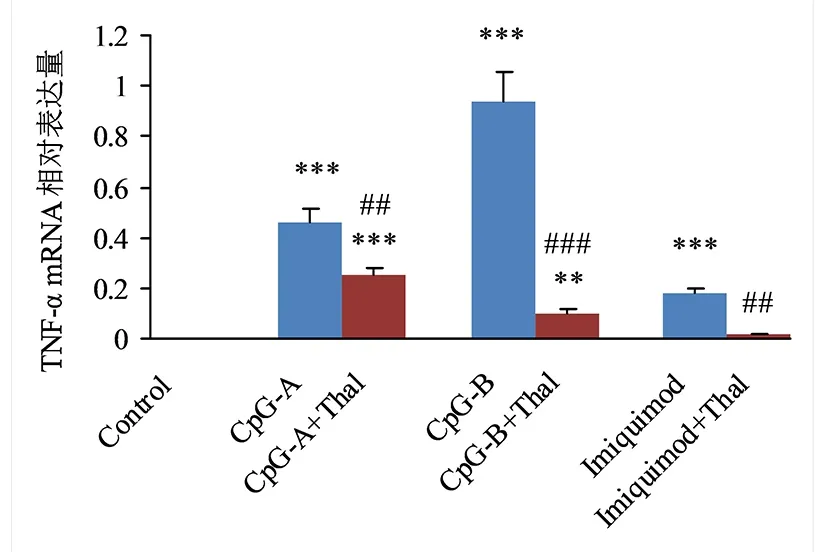
与Control比较,**P<0.01,***P<0.001; 与各单用激动剂组比较,## P<0.01, ### P<0.001。图3 沙利度胺对小鼠脾脏树突细胞TNF-α mRNA表达的影响
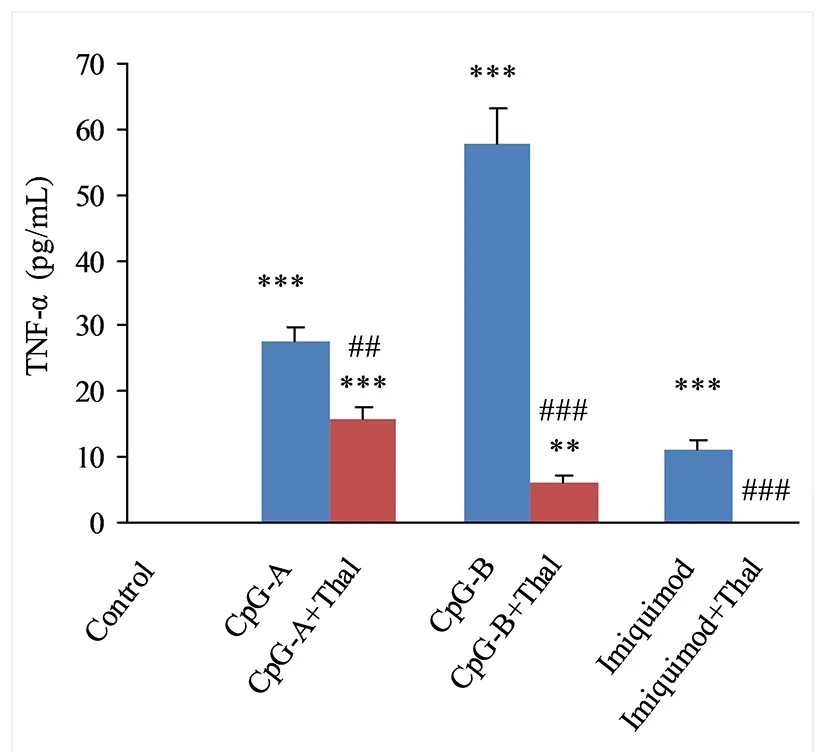
与Control组比较,**P<0.01,***P<0.001;与各单用激动剂组比较,## P<0.01, ### P<0.001。图4 沙利度胺对小鼠脾脏树突细胞TNF-α表达的影响
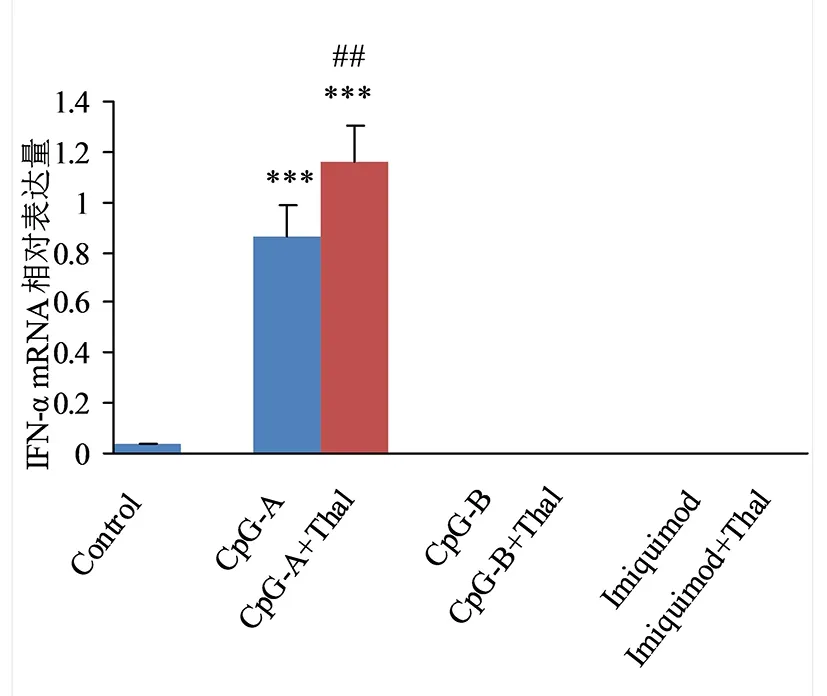
与Control组比较,***P<0.001; 与单用激动剂组比较,## P<0.01。图5 沙利度胺对小鼠脾脏树突细胞IFN-α mRNA表达的影响
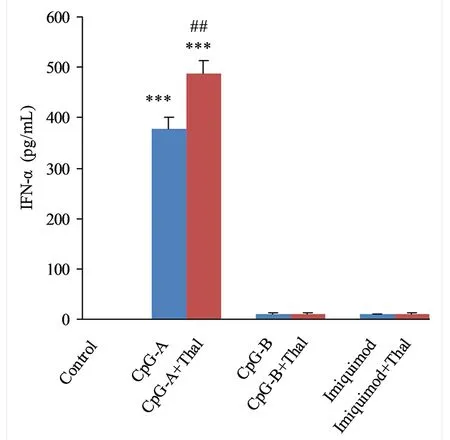
与Control组比较,***P<0.001; 与单用激动剂组比较,##P<0.01。图6 沙利度胺对小鼠脾脏树突细胞IFN-α表达的影响
2.3 Thal对小鼠脾脏树突细胞表达IFN-α的影响 单用激动剂的CpG-A组的小鼠脾脏树突细胞IFN-α mRNA和IFN-α表达量均高于对照组,差异均有统计学意义(P<0.05);CpG-A+Thal组小鼠脾脏树突细胞IFN-α mRNA和IFN-α表达量均高于CpG-A组,差异均有统计学意义(P<0.05);见图5、图6。
3 讨论
树突状细胞在免疫识别、免疫应答和免疫调控中发挥作用,决定着免疫应答的结果及强度,并在疾病的免疫治疗中有着深远的应用前景[5-6]。在树突状细胞各亚型中,CD11c+树突状细胞有刺激T细胞增殖以及分泌更多的IL-6、IL-10、TNF-α、IFN-α等炎性因子的作用,与AID发生发展密切相关[9]。树突状细胞表面的I型跨膜蛋白—Toll样受体(TLRs)是连接天然免疫和获得性免疫的关键分子,为细胞表面重要的模式识别受体。在机体获得性免疫中,TLRs家族成员中的TLR7、TLR8和TLR9高度同源,在细胞内涵体中起作用,结合其配体可识别微生物的核酸。TLR7可识别咪喹啉家族低分子量的Imiquimod等,TLR9可识别细菌的CpG-DNA,激活包括机体最强的抗原呈递细胞(antigen presenting cells, APC) 树突状细胞的免疫刺激特性,在树突状细胞成熟过程中起重要的调控作用[10]。
TLRs的激活及其介导的信号转导机制一直是研究的重点。在特定条件下, TLRs可在细胞表面异常高表达和过度激活, 除外源性配体外,还可识别一些内源性分子,甚至识别自身组织成分,引发机体功能紊乱,导致自身免疫性疾病。研究表明[11-14],TLRs参与许多慢性炎症和AID的发生发展。因此,TLRs 的激活必须受到严格的负调控,以保持免疫系统的稳定。随着对TLRs信号通路认识的逐步深入,基于TLRs及其信号通路为靶点的干预治疗成为研究的热点,为AID的治疗提供理论基础及新的药物靶点[14-15]。
细胞因子参与免疫细胞功能紊乱和自身免疫性疾病的病理进程。研究表明[16-19],包括IL-6、TNF-α、IFN-α在内的细胞因子,通过TLR7/TLR9信号通路激活的树突状细胞分泌,并参与类风湿性关节炎、系统性红斑狼疮等自身免疫性疾病的发生发展[20-21]。IL-6、TNF-α在类风湿性关节炎的发病机制中起着关键作用,导致滑膜发炎、血管生成增加和淋巴管减少;IFN-α能通过调控多种免疫细胞的分化影响免疫系统的功能进而促进系统性红斑狼疮的发生发展,通过干预IFN-α的活性有益于系统性红斑狼疮的控制,可能是治疗系统性红斑狼疮的新靶标。目前,细胞因子参与自身免疫性疾病是一个快速发展的生物学和临床研究领域,以细胞因子、受体和信号分子为治疗靶点的靶向制剂研究取得了较大进展。
沙利度胺及其衍生物是以镇静、胎儿致畸、抗血管生成和抗炎为特性的免疫调节药物(IMiD),通常用于治疗多发性骨髓瘤和骨髓增生异常综合征(MDS)等。IMiD也被用于治疗与汉森氏病/麻风病相关的炎症性皮肤病变。IMiD还在治疗自身免疫性疾病方面显示出应用前景,包括系统性红斑狼疮和炎性肠病[22]。本研究依据树突状细胞的TLRs激活机制体外选择Thal,分别与自身免疫性疾病细胞因子生成相关的TLR7/TLR9激动剂Imiquimod、CpG-A、CpG-B配对刺激小鼠脾脏树突状细胞,结果显示:与单用激动剂组比较,Thal配对组小鼠脾脏树突状细胞的IL-6和TNF-α的表达量均受到明显抑制,提示Thal对树突状细胞分泌的自身免疫性疾病相关炎性细胞因子具有较强的抑制作用。与细胞因子IL-6和TNF-α不同,仅CpG-A组小鼠脾脏树突状细胞的IFN-α表达增加,且Thal对IFN-α的分泌有协同增强作用。Ma等[23]在对免疫性血小板减少症(ITP)的研究中发现,Thal能恢复ITP患者骨髓间充质干细胞对树突状细胞的调控效应。Millrine等[24]的研究表明,Thal衍生物雷利度胺通过靶分子Rabex-5负调控TLRs介导的细胞因子Ⅰ型干扰素(IFN-Ⅰ)产生。以上研究结果提示Thal作为IMiD的作用有可能是通过对树突状细胞TLRs介导的细胞因子分泌的影响得以实现,Thal对自身免疫性疾病以及其他血液肿瘤疾病治疗的机制可能涉及树突状细胞TLRs介导的细胞因子的作用。后期的研究将以此为基础进一步展开,探讨Thal对树突状细胞TLRs信号通路靶点的干预作用,为自身免疫性疾病治疗提供理论依据。
综上所述,本研究初步探讨了免疫调节剂Thal对小鼠脾脏树突状细胞免疫功能的影响,Thal对自身免疫性疾病等疾病的治疗可能通过影响TLR7/9介导的树突状细胞分泌IL-6、TNF-α、IFN-α 的改变而产生作用。
