枯草芽孢杆菌HS09产芽孢发酵培养基的优化
2020-01-07陈俊煌
陈俊煌

摘 要:枯草芽孢杆菌HS09具备较好益生菌性能,已作为微生态菌剂应用于水产养殖业。为了提高菌株HS09产芽孢发酵水平,以芽孢产量为指标,通过单因素试验及正交试验对枯草芽孢杆菌HS09产芽孢发酵培养基的碳源、氮源进行筛选及优化,确定最佳发酵培养基。结果表明:影响枯草芽孢杆菌HS09芽孢产量的主次因素为玉米粉>硫酸铵>葡萄糖。枯草芽孢杆菌HS09产芽孢发酵优化培养基为葡萄糖10 g·L-1、硫酸铵8 g·L-1、玉米粉15 g·L-1、硫酸镁0.5 g·L-1、硫酸锰0.5 g·L-1、磷酸氢二钾1 g·L-1 、磷酸二氢钾2 g·L-1、碳酸钙3 g·L-1;以最佳产孢发酵培养基进行200 L发酵罐放大发酵,发酵有效菌落数可达4.3×109 cfu·mL-1,实现芽孢90%高转化率。该研究结果可为菌株工业化生产提供参考依据。
关键词:枯草芽孢杆菌;培养基;优化;正交试验
中图分类号:TQ920 文献标志码:A 文章编号:0253-2301(2020)10-0016-06
DOI: 10.13651/j.cnki.fjnykj.2020.10.03
Abstract: Bacillus subtilis HS09 has good probiotic performance and has been used as a microbial agent in aquaculture industry. In order to improve the spore-producing fermentation level of the strain HS09, with the spore yield as the index, the carbon and nitrogen sources of the fermentation medium of spore produced by Bacillus subtilis HS09 were screened and optimized by single factor tests and orthogonal experiments to determine the best fermentation medium. The results showed that the primary and secondary factors affecting the spore yield of Bacillus subtilis HS09 were in order as follows: corn flour, ammonium sulfate and glucose. The optimized fermentation medium of spore produced by Bacillus subtilis HS09 was as follows: glucose 10 g·L-1, ammonium sulfate 8 g·L-1, corn flour 15 g·L-1, magnesium sulfate 0.5 g·L-1, manganese sulfate 0.5 g·L-1, dipotassium phosphate 1 g·L-1, monopotassium phosphate 2 g·L-1, and calcium carbonate 3 g·L-1. The optimal spore-producing fermentation medium was used for the amplified fermentation in 200 L fermentation tank, and the effective clump count of fermentation could reach 4.3×109 cfu·mL-1, achieving a high conversion rate of 90% of spore. The results of this study could provide reference for the industrial production of the strains.
Key words: Bacillus subtilis;Culture medium;Optimization;Orthogonal experiment
枯草芽孢杆菌Bacillus subtilis是芽孢杆菌属的一种腐生细菌,由于发酵能够产生蛋白酶、α-淀粉酶、纤维素酶、β-葡聚糖酶、植酸酶、果胶酶等十几种酶[1],是重要的微生态益生菌。我国水产养殖业高速发展,但近年来水产养殖业在养殖密度和规模不断扩大的同时,也面临着日益严峻的食品安全问题。传统的抗生素虽然在治疗动物疾病、促进动物生长方面有明显优势,但其负面效应也日益突出,表现为病原微生物产生耐药性、不易降解等缺点,从而危害人类健康。因此,抗生素替代品益生菌、酶制剂等产品成为绿色饲料添加剂的热点[2-3]。微生态制剂作为抗生素的替代物之一,因其无毒副作用及不存在抗药性等优点,在养殖业中具有广阔的应用前景[4]。枯草芽孢杆菌是饲用微生态制剂的常用菌种之一[5],其对水产中的弧菌、大肠杆菌和杆状病毒等有害微生物有很強的抑制作用,能够有效预防水产动物肠炎、烂鳃等疾病;能够分解养殖池中的有毒有害物质,净化水质;同时具有较强的蛋白酶、脂肪酶、淀粉酶活性,能够促进饲料中营养素降解,使水产类动物对饲料的吸收利用更加充分;能够减少对虾病害发生,可以大大提高对虾产量,从而提高经济效益[6-8]。
为了便于运输、保存及应用,芽孢杆菌型微生态制剂通常加工为芽孢菌粉。枯草芽孢杆菌HS09具备较好的益生菌性能,常作为微生态菌剂应用于水产养殖业。为了提高产孢发酵水平,本研究进行枯草芽孢杆菌HS09培养基优化,以期降低生产成本,旨在为枯草芽孢杆菌微生态粉剂的工业化生产提供参考依据。
1 材料与方法
1.1 菌株
枯草芽孢杆菌HS09,由福建汇盛生物科技有限公司研发中心菌种室保藏。
1.2 培养基
(1)平皿培养基:酵母粉5 g,蛋白胨10 g,氯化钠10 g,琼脂20 g,水1000 mL,pH 7.2。
(2)种子培养基:酵母粉5 g,蛋白胨10 g,氯化钠10 g,水1000 mL,pH 7.2。
(3)碳源基础发酵培养基:酵母粉8 g,豆粕粉20 g,硫酸镁0.5 g,硫酸锰0.5 g,磷酸氢二钾1 g,磷酸二氢钾2 g,碳酸钙3 g,水1000 mL。
(4)氮源基础发酵培养基:葡萄糖10 g,硫酸镁0.5 g,硫酸锰0.5 g,磷酸氢二钾1 g,磷酸二氢钾2 g,碳酸钙3 g,水1000 mL。
1.3 试验方法
1.3.1 摇瓶发酵培养 从活化到期的枯草芽孢杆菌HS09平皿挑取2个单菌落接入种子培养基(100 mL/500 mL三角瓶)中,置于37℃,180 r·min-1摇床中培养16 h,按照体积5%的接种量移入发酵培养基(500 mL/2000 mL三角瓶)中,置于37℃,200 r·min-1摇床中培养24 h。
1.3.2 碳氮源单因素优化 (1)培养基碳源筛选:在碳源基础发酵培养基中,分别加入葡萄糖、糖蜜、蔗糖、玉米淀粉各10 g·L-1,初始pH 6.8条件下发酵培养,考察不同碳源对枯草芽孢杆菌HS09发酵有效菌数及芽孢产量的影响。(2)培养基氮源筛选:在氮源基础发酵培养基中,分别加入硫酸铵、酵母粉、蛋白胨、豆粕粉、玉米粉各20 g·L-1,初始pH 6.8条件下发酵培养,考察不同单一氮源对枯草芽孢杆菌HS09发酵有效菌数及芽孢产量的影响。(3)复合氮源的优化:在单一氮源试验结果的基础上进行复合氮源配比试验,复合氮源配比方案见表1,在初始pH值6.8条件下发酵培养,考察复合氮源对枯草芽孢杆菌HS09发酵有效菌数及芽孢产量的影响。
1.3.3 碳氮源正交优化 在碳氮源单因素优化基础上,选择葡萄糖、硫酸铵、玉米粉3个因素,设计L9(34)正交试验优化,L9(34)正交试验设计因素及水平见表2。
1.3.4 200 L发酵罐放大培养 从活化到期的枯草芽孢杆菌HS09平皿挑取8个单菌落接入种子培养基(500 mL/2000 mL三角瓶)中,置于37℃,200 r·min-1摇床中培养16 h,按照体积2%的接种量移入体积200 L发酵罐(装液量120 L)中,温度37℃,罐压0.04 Mpa,初始pH值6.8,搅拌转速和通气量控制方案如表3,发酵过程pH自然,培养24 h。每2 h取样检测,观察芽孢形成情况,当芽孢率达到90%即发酵完成,放罐。
1.3.5 发酵液菌数的测定 (1)发酵液有效菌落数(cfu·mL-1)测定:采用平板菌落计数法检测细菌总数;(2)发酵液芽孢数量测定:发酵液经80℃水浴加热15 min后,用稀释倒平板法检测芽孢的产量[9]。(3)发酵液芽孢率快速计算:采用血细胞计数板计算发酵液总菌数与芽孢数,芽孢数与总菌数的百分比,即发酵液芽孢率。
2 结果与分析
2.1 碳源对枯草芽孢杆菌HS09发酵的影响
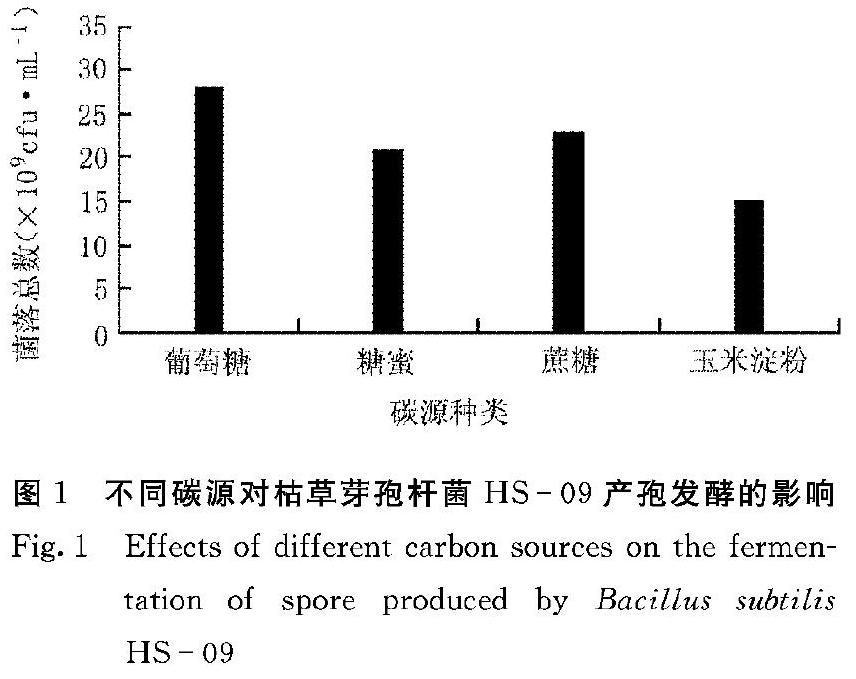
在碳源基础发酵培养基中,分别加入葡萄糖、糖蜜、蔗糖、玉米淀粉各10 g·L-1,考察不同碳源对枯草芽孢杆菌HS09菌落数及芽孢产量的影响。从图1可以看出,枯草芽孢杆菌对4种碳源都可以利用,但发酵后期菌体不易转为芽孢。其中以葡萄糖作为碳源使用时,菌落总数最高,达到2.8×109 cfu·mL-1。因此,选择葡萄糖作为枯草芽孢杆菌发酵的最优碳源。
2.2 氮源对枯草芽孢杆菌HS09发酵的影响
2.2.1 单一氮源优化 在氮源基础发酵培养基中,分别加入硫酸铵、酵母粉、蛋白胨、豆粕粉、玉米粉各20 g·L-1,考察不同氮源对枯草芽孢杆菌HS09菌落数及芽孢产量的影響。从图2可以看出,枯草芽孢杆菌发酵培养基中使用单一氮源,菌落总数整体不高,但不同氮源对枯草芽孢杆菌HS09菌落数及芽孢产量有明显区别。以豆粕粉作为氮源时,菌落总数最高;其中以硫酸铵和玉米粉作为氮源时芽孢转化率最好,分别达到80%和90%。
2.2.2 复合氮源优化 根据单一氮源试验结果,在氮源基础发酵培养基上,按照表1所列试验方案,对不同氮源进行复配,考察复合氮源对枯草芽孢杆菌HS09菌落数及芽孢产量的影响。从图3可以看出,使用复合氮源明显提高枯草芽孢杆菌菌落总数,其中以(硫酸铵10 g·L-1+玉米粉15 g·L-1)和(硫酸铵5 g·L-1+豆粕粉5 g·L-1+玉米粉15 g·L-1)两个组合菌落总数最高,均达到3.5×109 cfu·mL-1,芽孢转化率分别为90%和75%。因此,选择(硫酸铵10 g·L-1+玉米粉15 g·L-1)作为复合氮源,进行下一步正交试验。
2.3 正交试验优化
2.3.1 碳氮源正交试验优化 根据碳源、单一氮源、复合氮源试验结果,选取葡萄糖浓度为5 、10、15 g·L-1,硫酸铵浓度为2、5、8 g·L-1,玉米粉浓度为10、15、20 g·L-1为试验条件进行正交试验。以芽孢产量为指标,确定最优配比。从表4结果可知,影响枯草芽孢杆菌芽孢产量的主次因素是C>B>A,即玉米粉>硫酸铵>葡萄糖。枯草芽孢杆菌产芽孢培养基中最佳碳、氮源配比为A2B3C2,即葡萄糖10 g·L-1、硫酸铵8 g·L-1、玉米粉15 g·L-1。
2.3.2 验证试验结果 对2.3.1正交试验设计组合7(A3B3C2)和最优方案A2B3C2二者进行摇瓶试验验证,试验结果见表5。表5结果显示,两种方案芽孢产量相差不大,验证了最优方案(A2B3C2)是可行的。
2.4 200 L发酵罐放大发酵培养
在摇瓶优化的基础上,进行200 L发酵罐放大试验。发酵罐装液量120 L,温度37℃,罐压0.04 Mpa,初始pH 6.8,搅拌转速和通气量控制如表2,发酵过程自然pH,培养24 h。发酵过程中每2 h取样检测,记录pH、OD600、芽孢转化率,绘制发酵过程曲线,结果如图4。
从图4可见,在0~2 h枯草芽孢杆菌HS09处于适应期,菌液OD600值没有增长。随着发酵的进行,4 h开始OD600值快速增长,说明枯草芽孢杆菌HS09在4 h左右进入对数生长期,此时菌体大量繁殖,16 h后OD600值趋于稳定,枯草芽孢杆菌HS09菌体的生长进入稳定期。通过降低发酵通气量和搅拌转速,促进芽孢形成。芽孢在18 h左右开始形成,22 h芽孢大量形成,24 h芽孢转化率达到90%。发酵过程中pH自然,0~4 h阶段pH呈现先下降趋势,这是由于菌体在繁殖过程中分解有机物产酸;随后pH回升,这过程可能与氨基酸的降解产生铵根离子有关;6 h之后pH保持下降趋势,菌体处于大量繁殖的对数生长期引起的快速产酸有关,但pH基本保持在5.9以上;16 h后pH呈快速上升趋势,芽孢随之快速形成。试验验证了申烨华等[10]对芽孢杆菌发酵工艺的研究结果:参与合成伴孢晶体的酶最适pH为6.5~7.5。最终,枯草芽孢杆菌HS09在200 L发酵罐培养的发酵液有效菌落数为4.3×109 cfu·mL-1,芽孢转化率达到90%。发酵罐培养比摇瓶菌落数(3.4×109 cfu·mL-1)有较大提高,说明在发酵罐培养过程中体系溶氧更充足、更均匀,氧传递速度增加,促进菌体的大量积累。
3 结论与讨论
芽孢杆菌型微生态制剂通常是加工为芽孢菌粉,芽孢菌粉比菌体粉具备更好的抗逆性,在干燥加工、运输、保存过程损失较少,因此枯草芽孢菌发酵除了考察发酵的最终菌数,还必须考虑放罐前菌体能够大部分转化为芽孢。本研究结果表明,枯草芽孢杆菌HS09产芽孢培养基的组成对菌株的生长及芽孢形成有很大影响,尤其是培养基中的氮源。通过碳氮源的单因素试验、复合试验及正交优化,确定了枯草芽孢杆菌HS09产芽孢培养基的最佳碳源为葡萄糖(10 g·L-1)、最佳氮源为硫酸铵(8 g·L-1)与玉米粉(15 g·L-1)复合氮源。
在摇瓶优化的基础上,进行200 L发酵罐放大试验。发酵罐装液量120 L,温度37℃,罐压0.04 Mpa,初始pH 6.8,在发酵前期增加通气量及搅拌转速,有利于提高菌体产量;在发酵对数生长期后期,通过逐步降低通气量及搅拌转速,以促进芽孢转化。最适放罐时间24 h,发酵罐培养获得有效活菌数为4.3×109 cfu·mL-1,芽孢率90%,比摇瓶培养有效活菌数(3.4×109 cfu·mL-1)有明显提高,说明溶氧对枯草芽孢杆菌HS09的发酵培养有显著的影响。在提高枯草芽孢杆菌HS09有效菌落数上,可通过后期罐上培养将进行流加营养补料试验方案优化。枯草芽孢杆菌HS09具备较好益生菌性能,已作为微生态菌剂应用于水产养殖业。本研究结果可为枯草芽孢杆菌HS09工业化发酵提供了参考依据。
参考文献:
[1]马明,杜金华.枯草芽孢杆菌酶在工业生产中的应用[J].山东科学,2006,19(3):35-38.
[2]王利宾,孙利娜.枯草芽孢杆菌作用机制及其在養殖业中的应用研究进展[J].添加剂世界,2015(1):35-38.
[3]马光友,宋慧敏,熊玥,等.枯草芽孢杆菌粉剂生产工艺的研究[J].中国动物保健,2015,17(2):62-66.
[4]钟蔚.枯草芽孢杆菌微生态制剂制备工艺的研究[D].南京:南京农业大学,2013.
[5]孙笑非,孙鸣.一株枯草芽孢杆菌发酵培养基的优化[J].饲料研究,2009(2):68-69.
[6]王娇,曲朋,孙飞,等.弧菌颉颃菌的筛选及其在对虾养殖中的初步应用[J].中国畜牧兽医,2014,41(6):203-206.
[7]张洪沂.南美白对虾养殖系统中以弧菌为主要菌群的分子生态学研究[D].上海:上海海洋大学,2008.
[8]李军亮,杨奇慧,谭北平,等.低鱼粉饲料添加枯草芽孢杆菌对凡纳滨对虾幼虾生长性能、非特异性免疫力及抗病力的影响[J].动物营养学报,2019,31(5):2212-2221.
[9]郭夏丽,狄源宁,王岩.枯草芽孢杆菌产芽孢条件的优化[J].中国土壤与肥料,2012(3):99-10.
[10]申烨华,孙君,周茂林,等.苏云金芽孢杆菌HD1发酵工艺研究[J].西北大学学报,2001,31(5):396-398.
(责任编辑:林玲娜)
