有氧运动和白藜芦醇对非酒精性脂肪肝大鼠下丘脑Leptin-AMPK-mTOR通路相关蛋白的调节机制
2020-01-07刘倩倩侯改霞刘海涛
刘倩倩 侯改霞 刘海涛


摘 要:目的:研究有氧運动和(或)白藜芦醇干预对NAFLD大鼠下丘脑瘦素抵抗介导的AMPK-mTOR信号通路变化的相关机制。方法:健康雄性SD大鼠分为正常对照组(C)、NAFLD高脂组(H)、NAFLD高脂运动组(HE)、NAFLD高脂给予白藜芦醇组(HR)、NAFLD高脂运动给予白藜芦醇组(HRE),运动组进行游泳训练,给予白藜芦醇组按照45 mg/kg/day进行干预。大鼠于冰面上迅速剥离脑组织,分离下丘脑。ELISA方法检测下丘脑NPY水平,QRT-PCR检测下丘脑LP-Rb、SOCS3、PGC1α、mTOR、S6K1 mRNA表达;Western-blot方法检测下丘脑SOCS3、AMPKα、mTOR、S6K1的蛋白表达。结果:1)模型组大鼠下丘脑NPY水平出现明显上升;HR、HE、HRE组与H组相比,NPY显著的降低(P<0.01),其中HE组下降最为明显,HR次之,HRE组NPY水平趋近于正常对照组;2)模型各组大鼠的下丘脑SOCS3 mRNA的表达均出现了不同程度的增加;LP-Rb mRNA的表达H组与C组相比分别降低将近066倍(P<0.01);3)高脂模型组单纯运动引起了下丘脑AMPKα蛋白的高表达,改善效果明显优于联合干预组,但对下游mTOR、S6K1蛋白表达的抑制作用,联合干预组抑制效果明显的优于单一干预。结论:改善非酒精性脂肪肝大鼠中枢瘦素抵抗单纯就瘦素受体的表达而言,高脂模型组中单纯运动效果优于单纯给予Res或联合干预。
关键词:下丘脑;瘦素抵抗;NPY;AMPK-mTOR信号通路
中图分类号:G804.6 文献标识码:A 文章编号:1006-2076(2020)04-0074-08
Abstract:Objective: To study the mechanisms of exercise training and resveratrol intervention on the changes of AMPK-mTOR signaling pathway in the hypothalamic leptin resistance of NAFLD rats. Methods: Healthy male Sprague-Dawley rats were divided into normal control group (C), NAFLD high-fat group(H), NAFLD high-fat & exercise group(HE), NAFLD high-fat & resveratrol group(HR), NAFLD high-fat &exercise & resveratrol group(HRE). The exercise groups performed swimming training and the resveratrol groups were intervened according to 45 mg/kg/day. The rat was quickly stripped of brain tissue on the ice and the hypothalamus was isolated. The NPY level of hypothalamus was detected by ELISA. The expressions of LP-Rb, SOCS3, PGC1α, mTOR and S6K1 mRNA in hypothalamus were detected by QRT-PCR. SOCS3, AMPKα, mTOR and S6K1 protein expression were detected by Western-blot method. Results: 1) The NPY level of the hypothalamus in the model group increased significantly. Compared with the H group, the NPY was significantly decreased in the HR, HE, HRE group (P<0.01), and the HE group was the most obvious, followed by the HR. The NPY level in the HRE group approached the normal control group; 2) The expression of SOCS3 mRNA in the hypothalamus of all groups in the model group showed different degrees of increase; LP-Rb mRNA expression in the H group, decreased by nearly 0.66 times compared with the C group (P<0.01); 3) For the normal diet model group, 8 weeks of exercise training and combined Res intervention could significantly up-regulate the protein expression of AMPKαin hypothalamic. For high fat model group, simple exercise caused high expression of AMPKαproteins in the hypothalamus. The improvement effect was better than that of the combined intervention group, but the inhibition effect of downstream mTOR and S6K1 protein expression in combined intervention groups is obviously better than the single stem. Conclusion: To improve the central leptin resistance in rats with nonalcoholic fatty liver disease, the terms of expression of leptin receptor showed that, the effect of simply giving Res in the normal diet model group is better than the simple exercise or combined intervention; the simple exercise effect in the high fat model group is better than simply giving Res or joint intervention.
自运动周期开始分别进行为期8周的不负重游泳训练,第1周为适应性训练。第1天运动时间为10 min,以后每天递增10 min,游泳时间增加到60 min,从第2周开始维持此运动时间至9周结束。
1.4 样本采集
大鼠腹腔注射10%水合氯醛(剂量:0.35~0.40ml/kg bw)麻醉,腹主动脉取血后,迅速断头,置于冰上,快速取出完整的大脑组织,在冰面上剥离下丘脑,置于速冻管,存放在液氮中,待测。
1.5 检测指标
1.5.1 下丘脑神经肽
采用酶联免疫吸附法测定下丘脑神经肽NPY。
1.5.2 下丘脑相关基因的表达
实时荧光定量PCR检测:雷帕霉素靶蛋白(the mammalian target of rapamycin,mTOR)、核糖体蛋白激酶(ribosomal protein S6 kinases,S6K1)、过氧化物酶体增殖物激活受体γ辅助激活因子1α(peroxisome proliferator activated receptor-γ coactivator-1,PGC-1 α)、细胞因子信号转导抑制物3(suppressor of cytokine signaling 3,SOCS3)、瘦素长型受体LP-Rb的信使核糖核酸表达。
1.5.3 下丘脑mTOR通路相关蛋白的表达
SOCS3、AMPKα、mTOR、S6K1指标Western-blotting检测。实验步骤:样品匀浆测蛋白后,进行聚丙烯酰胺凝胶电泳,转移至PVDF膜上,封闭,加一抗(浓度分别为1 ∶ 500、1 ∶ 500、1 ∶ 1000、1 ∶ 500),4℃过夜。洗膜。加5 mL 1 ∶ 10 000稀释(稀释液含2%的脱脂奶粉)的羊抗鼠或兔二抗,37℃反应1 h。洗膜。先用纸巾把硝酸纤维膜上的PBS吸干,加入ECL化学发光试剂(试剂盒),完全浸透后,放于一胶片上,盖上保鲜膜,放入X射线暗盒,置于暗房。在暗房里打开暗盒,放入胶片,盖紧暗盒,10 s~30 s后打开暗盒,拿出胶片,在显影液中浸透晃洗,自来水洗,再置于定影液浸透晃洗。胶片拿出暗房后马上浸泡于自来水中,自然晾干。
1.6 数据处理
所有实验数据以均数±标准差(Mean±SD)表示。采用SPSS16.0统计学软件进行双因素方差分析。以P<0.05为显著性差异,P<0.01为极显著性差异。
2 实验结果
2.1 不同干预方式下NAFLD大鼠下丘脑NPY的变化
由表2可以看出,H组下丘脑NPY水平出现了较为明显的上升(P<0.01);HE组与C组相比,下丘脑NPY水平出现了明显的下降,差异具有显著性(P<005)。HR、HE、HRE组与H组相比,下丘脑NPY水平均出现了非常显著的降低(P<0.01),其中HE组下降最为明显,HR次之,HRE组NPY水平趋近于正常对照组。双因素方差分析结果显示,有氧运动和白藜芦醇对大鼠下丘脑NPY含量的影响具有主效应;有氧运动和白藜芦醇对大鼠下丘脑NPY含量的影响具有交互作用(P<0.01)。
2.2 不同干预方式下NAFLD大鼠下丘脑目的基因的变化
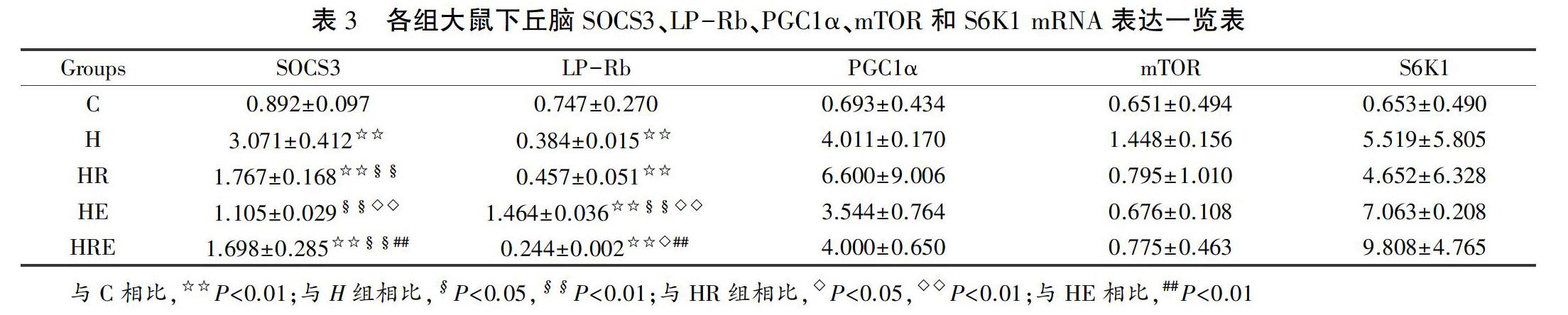
通过反转录,得到大鼠下丘脑脑细胞的cDNA,并通过相应的引物进行荧光实时定量PCR,利用SYBR GREEN Ⅰ染料法检测下丘脑组织SOCS3、LP-Rb、PGC1α、mTOR和S6K1基因mRNA的表达情况,将GAPDH作为内参。由表3可见,模型各组大鼠的下丘脑SOCS3 mRNA的表达均出现了不同程度的增加,H组增加了4.25倍,差异具有显著性(P<0.01),高脂模型组显示SOCS3 mRNA的表达以H组最高、HR组次之、且HRE组SOCS3 mRNA的表达高于HE组,差异具有显著性(P<0.05或P<0.01);LP-Rb mRNA的表达H组与C组相比,瘦素受体基因表达均出现了大幅下降,降低0.66倍,差异均具有非常显著性(P<0.01); HR、HE组LP-Rb mRNA的表达与C组相比,分别升高了近1.2和4.33倍,前者差异不明显,后者差异具有非常显著性(P<0.01);HE与HR相比,LP-Rb基因表达增加显著(P<0.01);HRE组与H组相比,变化无统计学意义。其他基因的mRNA表达水平也出现了不同程度的变化,变化无统计学意义。双因素方差分析结果显示,有氧运动和白藜芦醇对大鼠下丘脑组织SOCS3、LP-Rb基因mRNA表达的影响具有主效应(P<0.01);有氧运动和白藜芦醇对大鼠下丘脑组织SOCS3、LP-Rb基因mRNA表达的影响具有交互作用(P<0.01)。双因素方差分析结果显示,有氧运动和白藜芦醇对大鼠下丘脑目的基因的表达具有主效应;有氧运动和白藜芦醇对大鼠下丘脑目的基因的表达具有交互作用。
2.3 不同干预方式下大鼠下丘脑组织AMPK-mTOR相关蛋白表达的变化
各实验组大鼠下丘脑组织中SOCS3蛋白表达量的变化如下图1所示。与对照组C相比,模型组均出现SOCS3蛋白表达量下降的变化,变化程度虽有所不同,但均具有非常显著性(P<0.01),HE、HRE组较H组均出现了不同程度的蛋白表达减少(P<0.05)。AMPKα显示, H组AMPKα蛋白表达与C组相比,其表达呈显著下降,差异具有非常显著性(P<0.01);HE组蛋白表达呈现与H组相反的趋势,AMPKα蛋白表达呈上升趋势,其蛋白表達显著升高(P<0.01);HR、HRE与FC组相比,呈明显上升趋势,差异显著。各实验组大鼠下丘脑组织中mTOR蛋白表达量的变化如图1所示。与C组相比,HR、HE、HRE大鼠下丘脑组织中mTOR蛋白表达量水平与C组相比显著降低,差异具有非常显著性(P<001);H组mTOR蛋白表达量水平与C组相比升高,差异不具显著性;与H组相比,HR、HE、HER组大鼠下丘脑组织中mTOR蛋白表达量水平明显降低,差异具有显著性(P<0.01);HRE组与HR组相比,下丘脑组织中mTOR蛋白表达量水平明显降低,差异具有显著性(P<0.05)。 S6K1蛋白表达量结果显示,与对照组C相比,模型各组S6K1蛋白表达量均出现不同程度的上升,差异具有非常显著性(P<0.01);其中以H、HE组增长幅度最大,且HE组与H组相比增加更为明显(P<0.01);HR组S6K1蛋白表达量出现了显著的下降,差异具有非常显著性(P<001);HRE组S6K1蛋白表达出现了显著下降,与高脂各组相比其蛋白表达水平明显降低(P<0.01)。双因素方差分析结果显示,有氧运动和白藜芦醇对大鼠下丘脑目的蛋白的表达具有主效应;有氧运动和白藜芦醇对大鼠下丘脑目的蛋白的表达具有交互作用。
3 讨论
3.1 NAFLD大鼠下丘脑NPY在摄食和体重增长中的作用
下丘脑在大脑中的解剖位位于前脑底部,是神经内分泌的核心,是一个灰质实体。下丘脑在哺乳动物中的食欲调节中起着十分重要的作用,使机体维持正常体重和能量稳定,其主要由外侧区和内侧区组成。众所周知,生物体内存在着能量的正向平衡和负向平衡,当机体的分解代谢速率小于合成代谢速率,出现能量的正向平衡时才会出现个体体积的增大或体重的增加,下丘脑即是中枢神经系统中较早被发现的在机体的摄食调控中作用明显。研究发现,下丘脑的食欲调节作用是通过分泌多种与抑食、摄食相关的因子,建立较为全面的神经网络通路来起作用的。NPY是最为重要的下丘脑食欲促进因子之一,其分泌增多或在正常大鼠给予微量注射均可引起实验动物摄食活动的增加,在摄食量增加的同时引起机体代谢速率的减缓,使机体体脂含量增多。NPY主要来源于内侧区的弓状核(ARC)和内侧区的背内侧核(DMN)[7],且由于下丘脑的ARC无血脑屏障的保护,较易感知非酒精性脂肪肝大鼠所存在的较明显的外周组织的能量状态和摄食信号的变化,因此在本实验中,观察不同干预方式下SD大鼠下丘脑神经肽NPY的含量的变化情况,对于理解中枢神经特别是下丘脑在NAFLD过程中所起的作用有着十分重要的意义。由外周组织分泌的瘦素作为外周信号可以作用于下丘脑,作为一种外周作用于中枢神经的信使与神经肽的分泌关系密切。本实验通过研究发现,在NAFLD大鼠的形成过程中,由于机体出现了高瘦素血症,即瘦素抵抗,下丘脑可能是能过Leptin-ARC-NPY神经元活动感知机体的高瘦素水平,进而刺激ARC分泌NPY增多,而引起的SD大鼠摄食增多,体重增加,体脂含量增加,凡此种种又进一步恶化了NAFLD大鼠的脂肪蓄积的程度,使得NAFLD进一步加重。
3.2 不同干预对NAFLD大鼠下丘脑NPY水平的影响
王湘冀的研究显示[8],高脂饮食致肥胖的小鼠下丘脑NPY的基因和蛋白表达均明显高于正常对照组,提示高脂饮食可能引起下丘脑NPY的分泌增多,进而参于小鼠的肥胖过程。研究表明[9-10],中枢给予NPY可引起肥胖综合症,但NPY基因敲除后实验动物并未出现体重的下降和摄食量的减少,提示可能存在有复杂的中枢代偿机制。本研究的结果与前人的研究基本一致,模型组大鼠体征上出现了体重的明显增加,体脂含量的增多,且在外周模型组出现了不同程度的瘦素抵抗,在中枢水平上下丘脑NPY水平,模型组大鼠与对照组相比,下丘脑神经肽含量明显增加,LP-Rb mRNA水平显著下调,提示可能是由于中枢瘦素功能性受体的减少,引起中枢性瘦素抵抗,刺激下丘脑释放NPY增多。
白藜芦醇是一种较好的抗氧化剂,而且能够起到模拟限食的作用,Res有降血糖的作用[11-13]。白藜芦醇具有明显的神经保护作用,在清除脂氧自由基、超氧阴离子以及多种细胞信号转导途径中都有重要作用。鉴于白藜芦醇的中枢神经保护作用及其明显的热量限制功能,高脂模型组中,HR组下丘脑NPY水平较对照组有明显的下降,趋近于正常对照组,我们认为这一研究结果与Levin[14]的研究有相同之处,Levin在其研究中发现饮食限制会在一定程度上引起下丘脑NPY的升高,在高脂模型组由于其能量摄入过多,施加Res干预后,实验大鼠较为敏感的引起了下丘脑NPY水平的相应减少。在联合干预组也得到一定的证实,普食NAFLD和高脂NAFLD组的联合干预组其下丘脑NPY水平均趋近于正常对照组,表现出了一致的趋势,提示运动和Res联合作用可能平衡了机体的能量差异,使下丘脑NPY水平趋于正常。
3.3 不同干预对NAFLD中瘦素介导的mTOR信号通路下丘脑表达的影响
mTOR在中枢神经系统分布广泛,如下丘脑、皮层、海马结构等。正常生理状态下的能量调节过程非常复杂,mTOR信号通路参与此过程,有研究显示[15],大鼠饥饿一定时间后,下丘脑弓状核mTOR水平下降,这一情况在进食后得以改善,说明下丘脑mTOR状态与机体的能量情况息息相关。
研究[16-18]对leptin的作用通路众说不一。有人认为leptin的主要作用点在下丘脑的长型瘦素受体,通过Janus激酶(JAK)/ 信号传到及转录激活子(STAT)通路途径进行信号传导,影响多种神经内分泌激素分泌,从而起到对脂代谢的调节。也有研究表明,leptin的可以作用于下丘脑的短型瘦素受体,然后使胰岛素受体1(IRS-1)酪氨酸磷酸化,激活磷脂酰肌醇-3(PI3K),在cAMP的协同作用下激活蛋白激酶B(PKB),再通过对磷酸二脂酶3(PDE3)的调节影响细胞内cAMP的水平,进而调节肝细胞内的代谢。
SOCS3在瘦素的JAK/STAT信号转导中起负性调节的作用,同时瘦素又可诱导SOCS3的表达,反过来对自身形成一个负反馈调节,肥胖个体的高瘦素水平引起SOCS3的高表达,加重肥胖个体的瘦素抵抗。这一点在研究[19]中得以验证,用基因沉默技术将SOCS3沉默,发现JAK/STAT途径相关蛋白磷酸化增强,机体瘦素敏感性增加。Trenerry[20]在體实验中发现,在对大强度抗阻训练后老年人肌肉进行活检,发现其骨骼肌内的STAT3水平增加了23倍,而年轻人也增加了5倍,且同时升高的还有IL-6和SOCS3 mRNA水平,但SOCS3胞内蛋白水平是受到抑制的。谈艳等[21]发现通过8周中等强度的跑台运动和膳食干预,下丘脑的SOCS-3mRNA表达量无差异,运动组SOCS3蛋白表达量降低,与血清瘦素浓度低度相关,上调下丘脑中LP-Rb受体蛋白含量,使STAT3磷酸化水平增加,改善中枢型瘦素抵抗。本实验通过高脂高胆固醇饮食构建非酒精性脂肪肝大鼠,模型组大鼠体重明显增加、体脂含量增多,我们在实验中观察到,在中枢下丘脑出现出现了不同程度LP-Rb mRNA表达的下调,H组伴有瘦素信号传导通路中的负性调控因子SOCS3 mRNA表达的上调,表明NAFLD大鼠出现中枢性瘦素抵抗,下丘脑瘦素信号传导通路相关基因表达的变化,引起外周瘦素的中枢信号传导障碍,通过信号传导的级联效应,引起外周脂肪在肝脏这一非脂肪组织的异常蓄积,提示可能由于中枢性瘦素信号转导异常,在NAFLD的早期及后期恶性发展进程中发挥了重要作用。
实时荧光定量PCR检测了下丘脑瘦素受体LP-Rb的基因表达,发现H组与C组相比,出现了不同程度LP-Rb mRNA表达的下调,同时监测到H组瘦素信号传导通路中的负性调控因子SOCS3 mRNA表达的上调;实验结果显示,H组与C组相比mTOR、S6K1 mRNA表达同样出现上调;H组的Western-blot定量分析结果显示出与实时荧光定量PCR相同的变化趋势,H组的mTOR、S6K1蛋白表达与正常对照组(C)相比,出现了显著的长高趋势。但在各实验干预组,未见基因与蛋白表达变化出现这一同步现象。提示在非酒精性脂肪肝的形成过程中可能由于leptin抵抗的中枢效应,使下丘脑mTOR信号通路过度激活,正常的中枢能量调节功能失衡,致使外周脂肪组织和非脂肪组织(肝脏)脂质异常蓄积。
3.4 不同干预对NAFLD大鼠下丘脑AMPK-mTOR信号通路及其相关蛋白的影响
在下丘脑相关基因和蛋白表达中,我们发现高脂模型组给予白藜芦醇后即HR组NPY分泌明显減少,目前,关于有氧运动和(或)给予白藜芦醇对中枢神经mTOR信号通路的研究较少。研究表明[22],中枢给予不能氧化利用的2-脱氧-D-葡萄糖,模拟葡萄糖不足,能够刺激机体摄食增加,研究还表明,下丘脑腹内侧核葡萄糖敏感神经元中有K ATP通道,抑制通道活性,肝糖原合成减少,调节外周能量平衡。研究发现[23],大鼠下丘脑给予α-硫辛酸可抑制AMPK活性,同时体重减轻食物摄取减少。实验表明[24-25],二甲双胍、噻唑烷二酮、白藜芦醇可激活外周AMPK,可使机体胰岛素敏感性增强。动物实验研究表明,白藜芦醇能够模拟饮食限制的作用,引起高热卡饮食动物体重减少,而体重减少部分是由于调节脂肪代谢有关[26-27]。无论是长期积蓄量还是短期积蓄量,白藜芦醇在肝脏的积蓄量总是最多的,提示白藜芦醇可能对非酒精性脂肪肝的转归会有明显作用。我们在实验中发现,给Res使NAFLD大鼠瘦素受体mRNA表达升高,HR组SOCS3mRNA表达明显下降。与H组相比,HR组AMPK蛋白表达升高,活化的AMPK作用于TSC1/2复合体,引起TSC2激活,激活的TSC2抑制mTOR信号通路的活性,引起外周肝脏组织的胰岛素抵抗减轻,脂质异常蓄积状态有所改善。
对高脂模型组而言,其下丘脑瘦素受体的表达对运动更为敏感,相同强度的运动即可引起实验大鼠下丘脑瘦素受体基因表达的升高,并伴有SOCS3表达的下调,提示可能是由于高脂模型组的瘦素抵抗程度更为严重,对运动干预更敏感;研究发现,运动联合白藜芦醇干预改善非酒精性脂肪肝大鼠中枢瘦素抵抗单纯就瘦素受体的表达而言,高脂模型组中单纯运动效果优于单纯给予Res或联合干预。
研究结果表明,高脂模型组显示单纯运动引起了下丘脑AMPKα蛋白的高表达,改善效果明显优于联合干预组,但对下游mTOR、S6K1蛋白表达的抑制作用,联合干预组抑制效果明显的优于单一干预,提示在运动和给予Res干预非酒精性脂肪肝大鼠的中枢能量调控机制中,mTOR信号通路受上游AMPK的调控,但AMPK并不是mTOR信号通路唯一调控途径。实验结果表明,单纯运动对上游信号的调控作用更为明显,给予Res很可能是通过其他途径作用于mTOR信号通路,最终表现为在非酒精性脂肪肝大鼠中对mTOR信号通路的抑制联合干预效果优于单一干预,这一点在食欲调节肽中也有所验证,联合干预可明显减少下丘脑NPY的分泌,控制摄食,调控体重,进而改善非酒精性脂肪肝,联合干预效果较好。
4 结论
4.1 NAFLD中存在的肝脏脂质异常蓄积并不是单纯外周脂肪酸循环障碍,其中涉及中枢瘦素受体表达下降,引起的中枢型瘦素抵抗,反射性地引起下丘脑的摄食中枢分泌较多的摄食因子NPY,由中枢到外周引起了恶性的脂质循环,在肝脏表现出肝脏的异常蓄积,形成非酒精性脂肪肝。
4.2 运动训练和给予Res联合干预可明显抑制下丘脑mTOR、S6K1的蛋白表达,联合干预优于单纯运动或给予Res,但机制不同:研究显示单纯运动对上游信号AMPK、TSC1、TSC2的激活作用更为明显,给予Res很可能是通过其他途径作用于mTOR信号通路,最终表现为在非酒精性脂肪肝大鼠中对mTOR信号通路的抑制联合干预效果优于单一干预。
参考文献:
[1]King P J. The hypothalamus and obesity[J]. Curr Drug Targets, 2005, 6(2):225-240.
[2]Wang P, Zhang G. Hypothalamic AgRP neurons and the regulation of appetite and body weight:A review (in Chinese)[J]. Chin Sci Bull, 2018(63):3059-3069.
[3]Benani A,Troy S,Carmona M C,et al. Role for mitochondrial reactive oxygen species in brain lipid sensing:redox regulation of food intake[J]. Diabetes,2007,56(1):152-160.
[4]Leloup C,Magnan C,Benani A,et al. Obesity in C57Bl/6J mice is characterized by adipose tissue hypoxia and cytotoxic T-cell infiltration[J]. Int J Obes(Lond),2008,32(3):451-463.
[5]Betley J N, Xu S, Cao Z F H, et al. Neurons for hunger and thirst transmit a negative-valence teaching signal[J]. Nature, 2015(521):180-185.
[6]Chen Y, Lin Y C, Kuo T W, et al. Sensory detection of food rapidly modulates arcuate feeding circuits[J]. Cell, 2015(160):829-841.
[7]Buckwalter JB,Hamann J J,Clifford P S. NeuropeptideY1 receptor vasoconstriction in exercising canine skeletal muscles[J]. Appl Physiol,2005,99(6):2115-2120.
[8]王湘冀.肥胖小鼠下丘脑NPY、AGRP的变化及其与瘦素的关系[D].长沙:中南大学,2011.
[9]Bray GA, Tartaglia LA:Medicinal strategies in the treatment of obesity[J].Nature,2000,404(6778):672-677.
[10]Branco T, Tozer A, Magnus C J, et al. Near-perfect synaptic integration by NaV1.7 in hypothalamic neurons regulates body weight[J].Cell,2016(165):1749-1761.
[11]Wu L, Zhang Y, Ma X, et al. The effect of resveratrol on FoxO1 expression in kidneys of diabetic nephropathy rats[J]. Mol Biol Rep, 2012, 39(9):9085-9093.
[12]Xu Y, Nie L, Yin Y G, et al. Resveratrol protects against hyperglycemia -induced oxidative damage to mitochondria by activating SIRT1 in rat mesangial cells[J]. Toxicol Appl Pharmacol, 2012, 259(3):395-401.
[13]王軍力.运动训练和白藜芦醇改善2型糖尿病骨骼肌胰岛素信号通路障碍和脂代谢异常SIRT1机制研究[D].广州:华南师范大学,2011.
[14]Levin BE, Dunn-Meynell AA. Chronic exercise lowers the defended body weight gain and adiposity in diet-induced obese rats[J].Am J Physiol Regul Integr Comp Physiol,2004,286(4):771-778.
[15]Cota D, Proulx K, Smith KA, et al. Hypothalamic mTOR signaling regulates food intake[J].Science, 2006(312):927-930.
[16]李晓环,邹宁.瘦素信号转导与瘦素抵抗研究进展[J].中国儿童保健杂志,2009,17(2):179-183.
[17]John W Apolzan and Ruth B S Harris, ‘Rapid Onset and Reversal of Peripheral and Central Leptin Resistance in Rats Offered Chow, Sucrose Solution, and Lard., Appetite, 2012 Diet-induced obesity causes severe but reversible leptin resistance in arcuate melanocortin neurons[J].Cell Metabolism,2012,5(3):181-194.
[18]Enriori, P. J., Sinnayah, P., Simonds, S. E., Garcia Rudaz, C., & Cowley, M. A.Leptin action in the dorsomedial hypothalamus increases sympathetic tone to brown adipose tissue in spite of systemic leptin resistance[J].Journal of Neuroscience,2011,31(34):12189-12197.
[19]Dunn S, Bjomholm M,Bates SH, et al. Feedback inhibition of leptin receptor/Jak2 signaling via Tyrll38 of the leptin receptor and suppressor of cytokine signaling 3[J]. Mol Endoc,2005,19(4):925-938.
[20]Trenerry M K, Carey K A, Ward A C, et al.Exercise-induced activation of STAT3 signaling is increased with age[J].Rejuvenation Res,2008,1(4):717-724.
[21]谈艳,陈文鹤,郭黎,等.运动、膳食干预对瘦素抵抗大鼠中枢受体后信号通路作用机制的研究[J].体育科学,2011,31(4):57-66.
[22]Cota D, Proulx K, Seeley RJ. The role of CNS fuel sensing in energy and glucose regulation[J]. Gastroenterology,2007(132):2158-2168.
[23]Parikh H, Carlsson E, Chutkow WA, et al. TXNIP regulates peripheral glucose metabolism in humans[J]. PLoS Med,2007,4(5):e158.
[24]Hui ST, Andres AM, Miller AK, et al. Txnip balances metabolic and growth signaling via PTEN disulfide reduction[J]. Proc Natl Acad Sci USA,2008,105(10):3921-3926.
[25]Li XN, Song J, Zhang L, et al. Activation of the AMPK-FOXO3 pathway reduces fatty acid-induced increase in intracellular reactive oxygen species by upregulating thioredoxin[J]. Diabetes,2009,58(10):2246-2257.
[26]Baur JA, Sinclair DA.Therapeutic potential of resveratrol:the in vivo evidence[J].Nat Rev Drug Discov, 2006(5):493-506.
[27]Ingram DK, Zhu M, Mamczarz J, Zou S, Lane MA, Roth GS.Calorie restriction mimetics:an emerging research field[J]. Aging Cell,2006(5):97-108.
