围手术期自体血回收分离机制备富血小板血浆和自体凝血酶的研究
2020-01-07郑少强张文杰何锡强赵尧平
郑少强,张文杰,何锡强,周 雁,赵尧平,王 庚
(北京积水潭医院麻醉科,北京 100035)
富血小板血浆(platelet-rich plasma,PRP)是全血经离心分离后获得的血小板(platelet,PLT)浓缩物,是自体源性血液制品。PRP含有生理浓度数倍的PLT,因制备方法不同,其可能含有高浓度白细胞(white blood cell,WBC)、生长因子和纤维蛋白原等[1-2]物质。大量研究表明,围手术期应用PRP有益于患者康复[3-6]。术前采集自体PRP,术中必要时予以回输,可改善患者凝血功能,减少术中、术后出血及异体用血量[5,7-9]。PRP的激活产物包括富血小板凝胶(platelet-rich gels,PRG)和PRP释放物或提取物。已有证据表明,局部使用PRG可减少术后引流量,加快切口恢复,促进组织修复,从而改善骨折不愈合、肌肉韧带损伤、骨性关节炎、难愈创面患者的预后[5-6,10-12]。可见,安全、经济、有效、可操作性强的PRP及PRG制备方法对PRP能否在临床广泛应用十分重要。但市售PRP制备设备存在耗材价格昂贵的问题,不利于临床推广使用。而自体血回收分离机设置为分离模式,可将患者全血进行分离制备PRP。本研究旨在验证围手术期使用自体血回收分离机制备PRP的可行性及有效性,并探索制备自体凝血酶,及用自体凝血酶激活PRP制备PRG的方法。
1 资料与方法
1.1一般资料 选取2018年10月至2019年1月在北京积水潭医院行单侧全髋关节置换术的30例患者作为研究对象,按照随机数字法分为观察组和对照组,各15例。 纳入标准:①年龄>18岁,体重>60 kg,性别不限;②因髋关节骨性关节炎,行单侧全髋关节置换术;③美国麻醉医师协会分级Ⅰ~Ⅲ级;④术前无贫血(血红蛋白>120 g/L,血细胞比容>35%),PLT>150×109/L,无PLT功能障碍,凝血功能正常。排除标准:①严重肺、心、肾、肝等功能异常,凝血功能异常;②术前高热及贫血;③不能配合或其他原因不能行全髋关节置换术;④不愿配合或拒绝参加研究。两组患者的性别、年龄等一般资料比较差异无统计学意义(P>0.05),具有可比性,见表1。本研究经北京积水潭医院伦理委员会批准,患者均签署知情同意书。
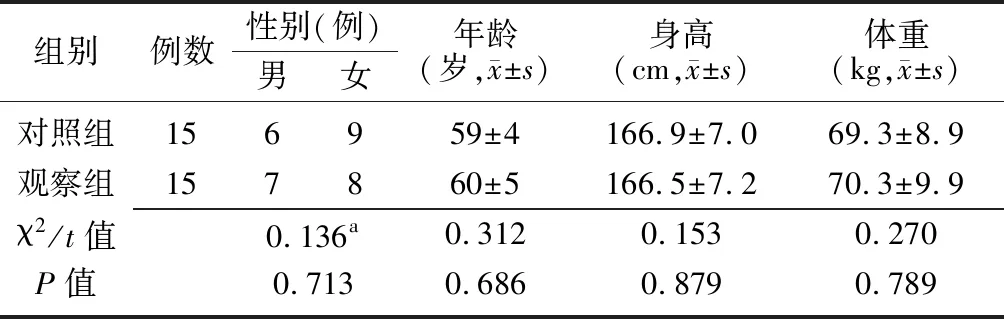
表1 两组行单侧全髋关节置换术患者的一般资料比较
对照组:患者在术前30 min使用自体血回收分离机制备PRP,制备成功后,使用10%葡萄糖酸钙激活PRP;观察组:患者在术前30 min使用自体血回收分离机制备PRP,制备成功后,将制得的PRP 1.5 mL用于制备自体凝血酶,使用自体凝血酶激活自身PRP以制备PRG;PRP:富血小板血浆;PRG:富血小板凝胶;a为χ2值,余为t值
1.2试验设备及材料 血液回收分离机(美国血液技术公司,型号:cell saver 5+)、一次性使用血细胞分离器(美国血液技术公司,规格261、244)、电热恒温水浴锅(上海精宏实验设备有限公司,型号:DK-S22)、微型低速离心机(杭州奥盛仪器有限公司,型号:AS-4K-1069)、水平震荡仪(常州荣华制造有限公司,型号:TY-80B)、EP管、一次性使用无菌注射器[美国BD (Becton,Dickinson and Company)公司,规格2 mL、5 mL、10 mL]、医用三通(德国贝朗医疗有限公司生产,型号:409511CN)。
1.3试验方法 所有患者均在术前30 min使用自体血回收分离机制备PRP。制备成功后,观察组将制得的PRP 1.5 mL用于制备自体凝血酶,使用自体凝血酶激活自身PRP以制备PRG;对照组使用10%葡萄糖酸钙激活PRP。除激活物不同外,两组的其他激活条件均相同。患者于手术当天进入手术室后建立无创血压检测、脉搏氧饱和度监测、心电图监护和静脉通路,输入乳酸钠林格液500 mL,Allen试验阴性后,行桡动脉穿刺置管,连接动脉测压装置。采血前取动脉血行血气分析,测定pH值、动脉血二氧化碳分压、动脉血氧分压、血红蛋白、血细胞比容等。
1.3.1PRP分离 按血液回收分离机操作规程安装离心杯、分离管路、储血袋等耗材,使用枸橼酸钠注射液预充管路抗凝。主机选择分离模式,将采血端连接动脉,开始运行,分离出贫血小板血浆、PRP及红细胞,分别进入相应储存袋。采血过程中输注羟乙基淀粉130/0.4氯化钠注射液300~500 mL,严密监测患者生命体征,无创血压监测选择连续测压模式。当患者出现血流动力学明显变化(血压、心率变化范围超过基础值20%)或有相关不适主诉时,停止采血,并予以记录。采血完成后,再次取动脉血行血气分析,测定pH值、动脉血二氧化碳分压、动脉血氧分压、血红蛋白、血细胞比容等,开始麻醉手术。取PRP 2 mL送检,检测PLT及WBC含量。将分离出的PRP置于水平震荡仪振荡保存,振荡频率为60 次/min,振幅5 cm。
1.3.2自体凝血酶制备 参照Franco等[13]制备自体凝血酶的方法,取PRP 1.5 mL与10%葡萄糖酸钙溶液0.5 mL置入EP管混匀,37 ℃水浴15 min,水浴结束后,900×g离心10 min后,使用注射器接16 G 针头吸出EP管上层物质,即为自体凝血酶。
1.3.3PRP凝胶制备 观察组将4 mL PRP与 1 mL 凝血酶分别置入注射器,通过医用三通匀速推注混匀,喷入容器。对照组使用同样方法将4 mL PRP与1 mL 10%葡萄糖酸钙混合。混合结束时开始计时,每隔1分钟观察PRP是否聚集成半固体凝胶,若聚集凝集,将容器倾斜至60°,观察PRP是否流动;若3 min时不聚集,则之后每隔3分钟观察1次, 记录凝集时间。若PRP与激活物混合30 min后仍未聚集,停止观察,记为未凝集。
1.3.4自体血回输 依据输血原则,术中必要时将分离出的贫PLT血浆、红细胞及剩余PRP回输。术野回收自体血也根据输血原则在必要时予以输注。

2 结 果
所有患者在采血过程中血流动力学无明显变化,无相关不适主诉,均完成采血及PRP制备。30例患者的平均采血量为(316±34) mL,制备PRP(33±7) mL;与采血前相比,采血后血红蛋白下降(8.1±1.4) g/L,血细胞比容下降(4.8±0.9)%。两组患者的PRP生成量、PLT基础值、PRP中PLT含量及富集度、WBC基础值、PRP中WBC含量及富集度比较差异无统计学意义(P>0.05),见表2。观察组将PRP与5%葡萄糖酸钙混合物水浴离心后制得自体凝血酶(图1a),将其与PRP混合后,可发生聚集形成PRG(图1b),其中12例2 min时凝集成凝胶,3例3 min时凝集,容器倾斜至60°不流动;对照组PRP与5%葡萄糖酸钙混合后30 min后均无凝集,容器倾斜至60°液体流动。
3 讨 论
PRP是全血经离心分离后获得,由于全血中红细胞、WBC、血浆、PLT等血液成分比重不同,故将全血进行离心时,各种血液成分会进行分离,分为红细胞、贫血小板血浆及PRP,PRP即据此原理制造。随着PRP在临床中的广泛应用,各类商用PRP制备套装层出不穷。大多数商用套装机器主体及耗材需分别购买,机器安装需独立空间[14]。自体血回收分离机为PRP制备装置的一种,其同时具备制备PRP和术野自体血回收的功能。对于因预计术中出血量大而使用术野自体血回收的患者,自体血回收分离机仅在血液回收耗材基础上增加成分血储存袋,更改主机工作模式即可完成PRP制备。而其他类型设备需单独设立空间安装,故自体血回收分离机在围手术期可一机两用,节约手术室空间;同时管路共用,可节省成本,减轻患者经济负担。目前公认的PRP的“富血小板”标准,需要PRP中的PLT浓度高于生理全血浓度至少4倍才能达到有效治疗浓度[15-16]。根据含WBC数量的多少,PRP可分为富白细胞PRP和贫白细胞PRP,其中富白细胞PRP中的WBC可释放出递质,诱导多种细胞黏附和聚集,从而具有更好的抗炎作用,更利于组织修复。目前,研究已证实自体血回收分离机制备PRP的效果[7-8]。本研究对自体血回收分离机制备的富白细胞PRP进行检验,其PLT和WBC含量均超过全血4倍,满足后续自体凝血酶及PRG制备所需条件。
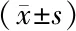
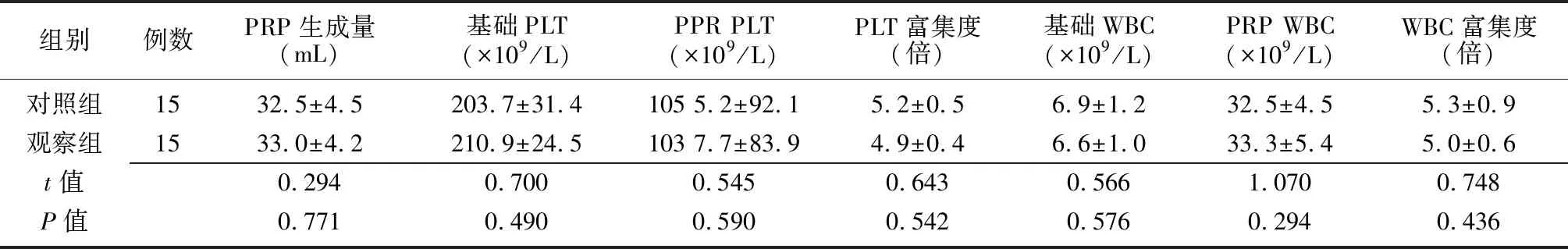
组别例数PRP生成量(mL)基础PLT (×109/L)PPR PLT (×109/L)PLT富集度(倍)基础WBC(×109/L)PRP WBC(×109/L)WBC富集度(倍)对照组1532.5±4.5203.7±31.4105 5.2±92.15.2±0.56.9±1.232.5±4.55.3±0.9观察组1533.0±4.2210.9±24.5103 7.7±83.94.9±0.46.6±1.033.3±5.45.0±0.6t值0.2940.7000.5450.6430.5661.0700.748P值0.7710.4900.5900.5420.5760.2940.436
对照组:患者在术前30 min使用自体血回收分离机制备PRP,制备成功后,使用10%葡萄糖酸钙激活PRP;观察组:患者在术前30 min使用自体血回收分离机制备PRP,制备成功后,将制得的PRP 1.5 mL用于制备自体凝血酶,使用自体凝血酶激活自身PRP以制备PRG;PRP:富血小板血浆;PRG:富血小板凝胶;PLT:血小板;WBC:白细胞
PRP通过激活PLT,向周围环境释放其颗粒内容物,发挥促生长及炎症抑制作用。PLT被激活后会释放多种内容物,包括刺激细胞增殖、合成与代谢的生长因子(血小板源性生长因子、转化生长因子-13、血管内皮生长因子、表皮生长因子等)。同时,PLT还会释放一些炎症反应抑制因子,抑制由白细胞介素-1β引起的炎症反应,使细胞不受炎症反应的损伤,如γ干扰素、白细胞介素-1受体拮抗剂、可溶性肿瘤坏死因子受体Ⅰ和Ⅱ、白细胞介素-10 、白细胞介素-4和白细胞介素-13等。除上述生长因子及炎症因子外,PLT还会释放纤维蛋白原,纤维蛋白原聚合为纤维蛋白,形成具有一定强度和黏附性、肉眼可见的网状凝胶,即PRG。在聚合过程中,纤维蛋白原参与凝血、收缩创面,为修复细胞增殖提供生物支架,对损伤愈合有促进作用[16-18]。体外应用时PRP必须激活后使用;当作为组织包埋媒介或止血剂时PRP也需要激活。其激活方法有加入氯化钙或凝血酶,同时加入氯化钙和凝血酶以及物理方法等,目前最常用的方法为添加牛凝血酶和氯化钙[5-6,19-20]。但这种方法制备的PRG存在一定风险:牛凝血酶的添加会导致凝血因子Ⅴ、Ⅺ抗体形成,并有发生严重凝血紊乱的可能性,甚至会威胁生命[21-22]。目前,国内动物来源凝血酶成品价格较高,其用于人体有过敏、排异等风险,且用于关节腔内或深部组织注射的安全性尚未完全证实。有文献报道,可使用PRP制备自体凝血酶[13]。本研究在PRP中加入5%葡萄糖酸钙经水浴、离心制得自体凝血酶,并进一步成功将PRP激活形成凝胶,证实了自体凝血酶制备及激活PRP的可行性。使用自体凝血酶激活PRP,不仅避免了过敏与排异的可能,免除异种生物制剂进入关节腔的风险,还可降低医疗成本。
未激活PRP呈液态,其局部用于创面或手术切口内,会在重力作用下流向最低位置,与创面接触时间短,无法充分发挥作用。PRP与激活剂混合后,凝集为PRG,流动性降低,附着于创面,延长作用时间。而激活剂与PRP混合后短时间内凝集形成PRG,可保证PRG与创面的作用时间。若激活剂作用于PRP形成PRG所需时间过长,则PRP可能在未形成PRG时即因重力作用离开创面,无法保证PRG有效成分充分发挥作用。本研究在激活剂与PRP混合观察30 min后即停止,其不足之处为5%葡萄糖酸钙可能在超过30 min后激活PRP形成PRG而未被观察到,但即使可激活,其临床应用意义不大。
综上所述,围手术期利用自体血回收分离机制备自体PRP具有可行性,PRP中的PLT可达到治疗水平。同时,使用PRP水浴离心制备自体凝血酶,进一步激活制备PRG方法可行,且简便经济。
