粘质沙雷氏菌膜结合葡萄糖酸脱氢酶的分离纯化及其酶学特性
2020-01-07王贝贝李昊聪孙文敬崔凤杰王大明钱静亚齐方辉
王贝贝,李昊聪,孙文敬,2,*,崔凤杰,2,王大明,钱静亚,2,齐方辉
(1.江苏大学食品与生物工程学院,江苏 镇江 212013;2.江莫省德兴市百勤异VC钠有限公司,江莫 德兴 334221;3.江南大学生物工程学院,江苏 无锡 214122)
粘质沙雷氏菌(Serratia marcescens)为杆状兼性厌氧的革兰氏阴性菌,广泛存在于土壤、水体、植物、动物与人体肠道等环境中,是一种临床上常见的机会致病菌[1-2]。同时,粘质沙雷氏菌又是一种具有广阔应用前景的微生物资源,能够利用多种可再生碳源发酵生产许多高附加值的工业产品[3-6]。其中,利用粘质沙雷氏菌转化葡萄糖为2-酮基葡萄糖酸(2-ketogluconic acid,2KGA)的研究已有较多文献报道[7-9]。2KGA是杂环化合物合成、区域选择性和立体选择性化学反应中的基础材料[10],目前大量用于食品抗氧化剂D-异抗坏血酸及其盐类的工业生产中[11-15]。
粘质沙雷氏菌属于氧化细菌,其细胞质膜上存在着与呼吸链相连的葡萄糖直接氧化系统[16-17]。该系统由膜结合的吡咯喹啉醌依赖性葡萄糖脱氢酶(glucose dehydrogenase,GDH)[18-19]和膜结合的黄素腺嘌呤二核苷酸依赖性葡萄糖酸脱氢酶(gluconate dehydrogenase,GADH)[20-22]组成。在细胞的周质空间中,GDH催化氧化来源于培养环境的葡萄糖为葡萄糖酸,而后GADH催化氧化葡萄糖酸为2KGA[23-24]。
作为氧化细菌葡萄糖代谢过程中一种重要的酶,多年来有关膜结合GADH的纯化与酶学特性研究受到相关学者的关注。到目前为止,分离纯化的膜结合GADH均来源于氧化细菌,如假单胞菌(Pseudomonas)[20-22]、克雷伯氏菌(K l e b s i e l l a)[22]、醋酸杆菌(Acetobacter)[22]、葡萄糖酸杆菌(Gluconobacter)[25-26]、欧文氏菌(Erwinia)[27]、沙雷氏菌[28]等。相关研究结果表明,微生物来源的膜结合GADH均具有3 个亚基。其中:大亚基(脱氢酶亚基)为黄素蛋白,分子质量为64.0~68.0 kDa;中亚基(细胞色素C亚基)含有细胞色素C,可能参与呼吸链中的电子传递,分子质量为45.0~52.5 kDa;小亚基的功能尚不明确,分子质量为15.5~22.0 kDa。尽管微生物来源的膜结合GADH结构组成相似,但酶学性质(如最适反应温度、最适反应pH值)存在较大的差异。
粘质沙雷氏菌JUIM03是本实验室从土壤中筛选的2KGA高产菌株,有望应用于工业生产中。本研究以粘质沙雷氏菌JUIM03为材料,利用Triton X-114相分离法[29-30]提取膜蛋白,然后分离纯化其中的GADH。在此基础上,考察纯化的膜结合GADH的酶学性质,了解环境因子对其催化活性的影响,以期为粘质沙雷氏菌2KGA生物合成的过程优化与控制提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
粘质沙雷氏菌(Serratia marcescens)JUIM03,由本实验室筛选保藏。
1.1.2 培养基
斜面培养基:蛋白胨10.0 g/L,牛肉膏5.0 g/L,NaCl 5.0 g/L,琼脂粉20.0 g/L,pH 7.0。
菌种扩大培养基:葡萄糖22.0 g/L,玉米浆粉5.0 g/L,尿素2.0 g/L,KH2PO42.0 g/L,MgSO4·7H2O 0.5 g/L,轻质CaCO31.0 g/L,pH 7.0。
1.1.3 试剂
Triton X-114、Triton X-100、2,6-二氯靛酚(2,6-dichloroindophenol,DCIP)、吩嗪硫酸甲酯(phenazine methosulfate,PMS)、改良型Bradford法蛋白质浓度测定试剂盒、DEAE-Sepharose Fast Flow填料生工生物(上海)股份有限公司;5×Protein十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)Loading Buffer、Premixed Protein Marker(Low) 宝生物工程(大连)有限公司;2KGA钙盐标准品 江莫省德兴市百勤异VC钠有限公司;考马斯亮蓝G250 国药集团化学试剂有限公司;其他试剂均为国产分析纯试剂。
1.2 仪器与设备
TGL-18M型台式高速冷冻离心机 上海卢湘仪离心机仪器有限公司;L5型紫外-可见分光光度计 上海仪电分析仪器有限公司;BILON98-IIIDL型超声波细胞破碎仪、YC-1型层析冷柜 上海比郎仪器有限公司;1260 Infinity高效液相色谱仪 美国Agilent公司;LPC-201型自动中低压层析系统 北京众益中和生物技术有限公司;Amicon-Ultra-15超滤管(MWCO30kDA)美国Milipore公司;Hydroxyapatite Fast Flow预装柱(5 mL)、PowerPac Basic型电泳仪、GelDocTMXR+型凝胶成像仪 美国Bio-Rad公司。
1.3 方法
1.3.1 粘质沙雷氏菌膜结合GADH的分离纯化
1.3.1.1 菌体细胞的培养与超声破碎
从斜面中挑取活化的粘质沙雷氏菌JUIM03,接种于菌种扩大培养基(500 mL三角瓶的培养基装量为50 mL)中,30 ℃、265 r/min的条件下振荡培养20 h,然后8 000 r/min离心10 min回集菌体,并用无菌水洗涤2 次。将回集的菌体细胞悬浮于含有10 g/L TritonX-114和150 mmol/L NaCl的10 mmol/L的Tris-HCl缓冲液(pH 7.4)中,调整细胞浓度至OD650nm为45.0左右,随后在4 ℃、900 W的条件下超声破碎细胞60 min,并对细胞的破碎效果进行镜检观察。
1.3.1.2 Triton X-114相分离法提取膜蛋白
在4 ℃、12 000 r/min条件下离心细胞破碎液30 min,弃去沉淀。将上清液置于37 ℃的水浴中保温15 min,然后在25 ℃、12 000 r/min条件下离心5 min,使两相分离(上层为水相,下层为去污剂相,膜蛋白溶解于去污剂相中)并分别回集。方回集的水相中添加TritonX-114至10 g/L,4 ℃下搅拌15 min至混合均匀,然后重复上述的两相分离步骤。将3 次两相分离得到的去污剂相合并,加入4 ℃的磷酸盐缓冲液(phosphate buffered saline,PBS)定容至离心所得上清液的原体积,4 ℃搅拌15 min,然后置于37 ℃水浴中保温15 min,25 ℃、12 000 r/min离心5 min,使两相分离。取去污剂相继续加入4 ℃的PBS,再次进行两相分离,最后得到的去污剂相作为粘质沙雷氏菌膜结合GADH的粗酶液。
1.3.1.3 膜结合GADH的分离纯化
参照文献[22]的方法对粗酶液进行盐析,回集硫酸铵饱和度为25%~45%之间的沉淀组分。将盐析得到的沉淀物悬浮于含有1 g/L TritonX-100、5 mmol/L MgCl2·6H2O和10 mmol/L D-葡萄糖酸钠的10 mmol/L的磷酸钾缓冲液(pH 6.0,以下简称为缓冲液A)中并透析过夜。4 ℃、12 000 r/min条件下离心透析液5 min,然后将上清液上样至已用缓冲液A平衡过的DEAE-Sepharose Fast Flow阴离子交换柱(1.2 cm×60 cm)中,并依次用缓冲液A、含有0.1 mol/L KCl的缓冲液A、含有0.3 mol/L KCl的缓冲液A和含有0.5 mol/L KCl的缓冲液A洗脱,分部回集洗脱组分并测定其蛋白浓度和GADH活性。合并DEAE-Sepharose层析过程中回集的具有GADH活性的洗脱组分,超滤浓缩后用含有5 mmol/L MgCl2·6H2O和10 mmol/L D-葡萄糖酸钠的10 mmol/L的磷酸钠缓冲液(pH 7.0,以下简称为缓冲液B)透析,再上样至经缓冲液B平衡过的Hydroxyapatite预装柱(5 mL)中。上样结束后,依次用缓冲液B、含有5 mmol/L MgCl2·6H2O和10 mmol/L D-葡萄糖酸钠的100 mmol/L的磷酸钠缓冲液(pH 7.0)、含有1 g/L TritonX-100、5 mmol/L MgCl2·6H2O和10 mmol/L D-葡萄糖酸钠的150 mmol/L的磷酸钠缓冲液(pH 7.0)进行洗脱,然后分部回集洗脱组分。超滤浓缩具有GADH活性的洗脱组分,保存于-20 ℃备用。
1.3.2 粘质沙雷氏菌膜结合GADH的酶学性质分析
1.3.2.1 反应温度对膜结合GADH催化活性的影响及热稳定性分析
保持酶促反应的其他条件不变,考察反应温度对酶活力的影响,确定膜结合GADH的最适反应温度。将最适反应温度下样品的酶活力定义为100%,以此计算其余温度下样品的相对酶活力。
将纯化的膜结合GADH置于不同的温度下保温处理一定时间,然后迅速冷却并在最适反应温度下测定其残留的酶活力。将未经保温处理的样品在相同条件下的酶活力定义为100%,以此计算不同保温处理条件下样品的相对酶活力。
1.3.2.2 反应pH值对膜结合GADH催化活性的影响及pH值稳定性分析
保持其他反应条件不变,考察反应pH值对酶活力的影响,确定膜结合GADH的最适反应pH值。将最适反应pH值下样品的酶活力定义为100%,以此计算其余pH值条件下样品的相对酶活力。
将纯化的膜结合GADH与不同pH值的磷酸氢二钠-柠檬酸缓冲液(McIlvaine缓冲液)混合均匀,4 ℃处理16 h,然后在pH 6.0的反应体系中测定各个处理样品的酶活力,考察膜结合GADH的pH值稳定性。将测得的处理样品的最高酶活力定义为100%,以此计算其余pH值处理下样品的相对酶活力。
1.3.2.3 金属离子对膜结合GADH催化活性的影响
配制含有不同浓度、不同种类金属离子的酶促反应体系,保持其他反应条件不变,在pH 6.0、最适反应温度下考察金属离子对酶活力的影响。将未经金属离子处理的样品在相同条件下的酶活力定义为100%,以此计算不同浓度、不同种类金属离子处理样品的相对酶活力。
1.3.2.4 变性剂和乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)对膜结合GADH催化活性的影响
将纯化的膜结合GADH分别加入含有不同浓度的脲、巯基乙醇、SDS和EDTA的反应体系中,保温处理1 h,然后在最适反应温度下测定各个样品的残留酶活力。将未经变性剂和EDTA处理的样品在相同条件下的酶活力定义为100%,以此计算不同处理下样品的相对酶活力。
1.3.2.5 有机溶剂对膜结合GADH催化活性的影响
配制含有不同浓度、不同种类有机溶剂的酶促反应体系,以不添加任何有机溶剂的反应体系为对照,保持其他反应条件不变,在最适反应温度下考察有机溶剂对酶活力的影响。
1.3.2.6 有机酸对膜结合GADH催化活性的影响
配制含有不同浓度、不同种类有机酸的酶促反应体系,以不添加任何有机酸的反应体系为对照,保持其他反应条件不变,在最适反应温度下考察有机酸对酶活力的影响。
1.3.2.7 膜结合GADH的底物特异性
分别利用相同浓度的不同碳源替代D-葡萄糖酸钠作为酶促反应体系中的底物,在最适反应条件下测定膜结合GADH的催化活性。将D-葡萄糖酸钠作为底物时的酶活力定义为100%,以此计算不同底物条件下膜结合GADH的相对酶活力。
1.3.2.8 膜结合GADH的Km值和Vm值
在pH 6.0、25 ℃的条件下,测定膜结合GADH催化氧化不同浓度D-葡萄糖酸钠的反应初速度。利用Lineweaver-Burk双倒数作图法,计算膜结合GADH的米氏常数Km和最大反应速度Vm。
1.3.3 分析方法
1.3.3.1 膜结合GADH的酶活力测定
参照Matsushita等[22]的方法进行测定。反应体系(3.0 mL):10 mmol/L DCIP 0.1 mL,3 mmol/L PMS 0.1 mL,1.0 mol/LD-葡萄糖酸钠0.1 mL,100 mmol/L磷酸钾缓冲液(pH 6.0)1.0 mL,适量的膜结合GADH和蒸馏水。酶活力单位(U)的定义:25 ℃条件下,在上述反应体系中,每分钟还原1.0 μmol DCIP或者氧化1.0 μmolD-葡萄糖酸钠所需要的酶量。比活力的定义:每毫克蛋白所具有的酶活力。
1.3.3.2 蛋白质的测定与SDS-PAGE分析
参照文献[18]方法。
1.3.3.3 膜结合GADH大亚基中黄素腺嘌呤二核苷酸的预测
参照Shinagawa等[25]的方法进行预测。
1.3.3.4 膜结合GADH中细胞色素C的定性分析
参照Shinagawa等[28]的方法,将纯化得到的膜结合GADH于0.1 mol/L的磷酸钾缓冲液(pH 7.0)中透析过夜,调整其蛋白质量浓度为0.1 mg/mL左右。方酶液中加入适量的D-葡萄糖酸钠或铁氰化钾,使膜结合GADH呈还原型或氧化型。以0.1 mol/L的磷酸钾缓冲液(pH 7.0)为对照,分别测定还原型或氧化型膜结合GADH在波长400~600 nm的吸回光谱。
1.3.3.5 膜结合GADH催化氧化D-葡萄糖酸所形成的产物分析
反应体系:32 mmol/LD-葡萄糖酸,16 mmol/L轻质CaCO3,0.1 mmol/L PMS和适量纯化膜结合GADH酶液,用蒸馏水定容。反应条件为30 ℃、24 h。在反应液中加入5 g/L的活性炭,75 ℃搅拌脱色20 min;抽滤除去不溶物,减压(-0.096 MPa)浓缩滤液至无色结晶出现;4 ℃结晶4 h,过滤得到反应产物;真空干燥,获得无色粉末状样品,即为提取的反应产物。将适量的2KGA(钙盐)标准品和反应产物分别溶解于0.01 mol/L的KH2PO4溶液(pH 3.0),经0.22 μm滤膜过滤,备用,进行高效液相色谱(high performance liquid chromatography,HPLC)分析。HPLC采用Hypersil SAX色谱柱(4.6 mm×150 mm,5 μm);流动相0.01 mol/L KH2PO4(pH 3.0);流速1.0 mL/min;紫外检测器;检测波长216 nm;柱温30 ℃;进样量5 μL。
2 结果与分析
2.1 粘质沙雷氏菌膜结合GADH的分离纯化
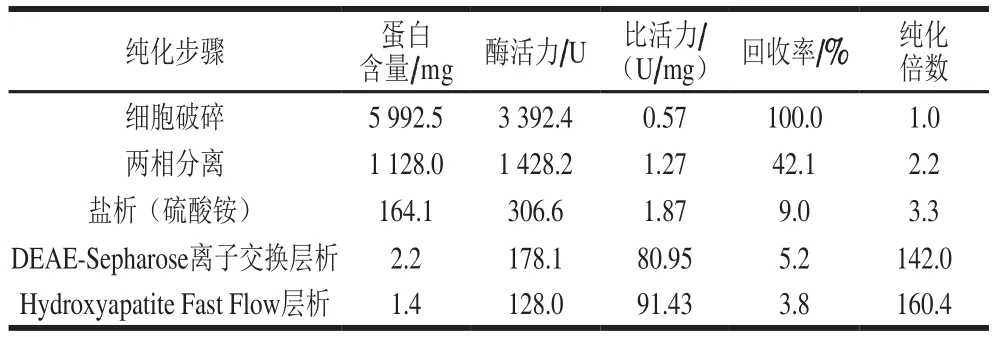
表1 粘质沙雷氏菌膜结合GADH的纯化Table 1 Summary of puri fication procedures of membrane-bound GADH from S. marcescens

图1 粘质沙雷氏菌膜结合GADH的DEAE-Sepharose离子交换层析Fig. 1 DEAE-Sepharose ion-exchange chromatography of membranebound GADH from S. marcescens

图2 粘质沙雷氏菌膜结合GADH的Hydroxyapatite柱层析Fig. 2 Hydroxyapatite chromatography of membrane-bound GADH from S. marcescens
粘质沙雷氏菌膜结合GADH的分离纯化结果如表1所示。Triton X-114相分离法是一种有效的膜蛋白提取方法。通过水相与去污剂相的分离,大部分的亲水性蛋白被去除,膜结合GADH被纯化了2.2 倍,且具有较高的回回率。在利用盐析从提取膜蛋白中分离纯化GADH的过程中,硫酸铵饱和度为25%~45%时,沉淀的蛋白具有很高的GADH活性,而从其他饱和度下的沉淀物中基本检测不到GADH活力。经过盐析处理后,膜结合GADH被进一步纯化到3.3 倍,同时除去了膜蛋白中的Triton X-114。利用DEAE-Sepharose Fast Flow阴离子交换层析纯化盐析得到膜蛋白时,用含有0.1 mol/L KCl的缓冲液A洗脱的组分具有较高的GADH活性,其最大比活力为88.95 U/mg(图1)。经过阴离子交换纯化后,膜结合GADH的比活力提高至80.95 U/mg,纯化倍数增加至142.0 倍。利用Hydroxyapatite Fast Flow层析对经过阴离子交换处理的膜蛋白进行纯化的过程中,用含有1 g/L TritonX-100、5 mmol/L MgCl2·6H2O和10 mmol/L D-葡萄糖酸钠的150 mmol/L的磷酸钠缓冲液(pH 7.0)洗脱的组分具有较高的GADH活性,其最大比活力为103.25 U/mg(图2)。经过上述纯化,获得了比活力为91.43 U/mg的粘质沙雷氏菌膜结合GADH,其最终的纯化倍数为160.4,回回率为3.8%。
2.2 粘质沙雷氏菌膜结合GADH的结构分析
2.2.1 膜结合GADH的SDS-PAGE分析

图3 粘质沙雷氏菌膜结合GADH的SDS-PAGE分析Fig. 3 SDS-PAGE analysis of membrane-bound GADH from S. marcescens
从图3可以看出,经盐析处理后,大部分的杂蛋白被除去;经DEAE-Sepharose阴离子交换层析后,具有GADH活性的洗脱液中的杂蛋白进一步减少;经Hydroxyapatite层析后,SDS-PAGE的凝胶上显示出3 条明显的条带,分别对应的分子质量大约为65.0、45.0、23.0 kDa。上述结果表明,来源于粘质沙雷氏菌JUIM03的膜结合GADH由3 个亚基组成,即65.0 kDa的大亚基(脱氢酶亚基)、45.0 kDa的中亚基(细胞色素C亚基)和23.0 kDa的小亚基,与来源于其他氧化细菌[20-22]的膜结合GADH在亚基组成上一致。
2.2.2 膜结合GADH大亚基中黄素腺嘌呤二核苷酸的预测
参照Shinagawa等[25]的方法,对纯化的粘质沙雷氏菌膜结合GADH进行SDS-PAGE分离,然后将未染色的分离胶置于紫外光下,在对应大亚基(脱氢酶亚基)的条带位置可以观察到荧光出现,说明纯化的膜结合GADH大亚基中应该含有黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)。用10%的三氯乙酸对纯化的膜结合GADH进行处理,然后对其进行SDS-PAGE分离,再将未染色的分离胶置于紫外光下,仍能在对应大亚基条带的位置观察到荧光出现,说明FAD与大亚基之间应该是以共价键紧密结合的,即FAD在膜结合GADH中以辅基而不是辅酶的形式存在。
2.2.3 膜结合GADH中细胞色素C的定性分析
还原型的细胞色素C在可见光区具有特征性的吸回光谱,在波长550~555、520~525 nm和415~420 nm处有3 个吸回峰,即α吸回峰、β吸回峰和γ吸回峰。膜结合GADH中含有细胞色素C,其还原型的吸回光谱中具有典型的细胞色素C吸回峰;同时,因为膜结合GADH中含有FAD,属于黄素蛋白,其还原型在450 nm区域的吸光度明显低于其氧化型的吸光度[28]。

图4 纯化的粘质沙雷氏菌膜结合GADH的吸收光谱Fig. 4 Absorption spectra of purified membrane-bound GADH from S. marcescens
从图4可以看出,该酶还原型的吸回光谱中有3 个吸回峰,分别处于419、520、554 nm的位置,且其在450~500 nm区域内的吸光度明显低于其氧化型的吸光度,可以认为本研究纯化的膜结合GADH是含有细胞色素C的黄素蛋白。
2.2.4 膜结合GADH催化氧化D-葡萄糖酸所形成产物分析
2KGA是由膜结合的FAD依赖性GADH催化葡萄糖酸形成的产物[31]。从粘质沙雷氏菌JUIM03纯化的膜结合GADH催化氧化D-葡萄糖酸所形成的产物在HPLC中的保留时间为4.382 min,与2KGA钙盐标准品在HPLC中的保留时间4.287 min一致(图5),说明本研究所纯化的膜结合GADH可能是FAD依赖性GADH。
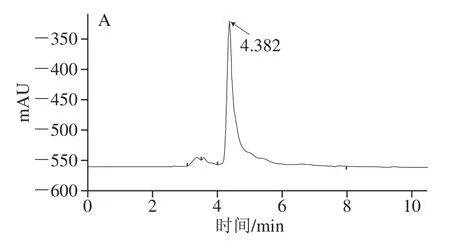
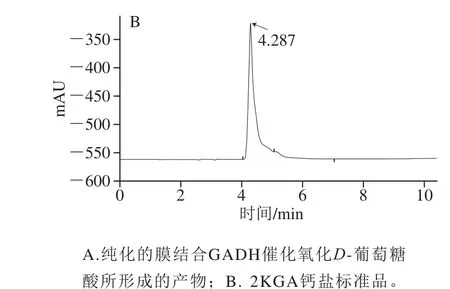
图5 膜结合GADH催化氧化D-葡萄糖酸所形成的产物的HPLC分析Fig. 5 HPLC analysis of the products formed from D-gluconic acid under the catalysis of membrane-bound GADH
2.3 粘质沙雷氏菌膜结合GADH的酶学性质
2.3.1 膜结合GADH的最适反应温度和热稳定性
在20~40 ℃的范围内,粘质沙雷氏菌JUIM03膜结合GADH的催化活性随着反应温度的升高而增大,在温度达到40 ℃时活性最大;当反应温度高于40 ℃时,酶活力迅速下降,在60 ℃时几乎无法检测到膜结合GADH活力(图6)。粘质沙雷氏菌JUIM03膜结合GADH的最适反应温度为40 ℃,明显高于来源于2KGA工业发酵常用的假单胞菌的膜结合GADH最适反应温度(30 ℃)[20-22],从侧面预示了沙雷氏菌和假单胞菌2KGA合成对温度条件的不同要求。

图6 温度对膜结合GADH催化活性的影响Fig. 6 Effect of temperature on membrane-bound GADH activity
30 ℃保温45 min,粘质沙雷氏菌JUIM03膜结合GADH活力没有变化;40 ℃保温45 min,酶活力降低了30%左右;50 ℃保温30 min,酶活力降低了80%以上;60 ℃保温15 min,酶活力完全丧失(图7)。

图7 膜结合GADH的热稳定性Fig. 7 Thermal stability of membrane-bound GADH from S. marcescens
2.3.2 膜结合GADH的最适反应pH值和pH值稳定性
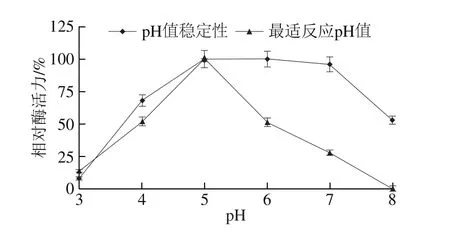
图8 pH值对膜结合GADH催化活性和稳定性的影响Fig. 8 Effect of pH on membrane-bound GADH activity and stability
如图8所示,反应体系的pH值从3.0升至5.0的过程中,膜结合GADH的催化活性呈上升趋势;反应体系的pH值从5.0升至8.0的过程中,酶的催化活性逐步降低直至完全失活。因此,该酶最适反应pH值为5.0。将纯化的膜结合GADH置于pH 5.0~7.0的缓冲液中处理16 h后,其酶活力没有发生明显的变化; 在pH值低于5.0或高于7.0的缓冲液中对膜结合GADH进行处理,都会导致其酶活力的明显下降。
2.3.3 金属离子对膜结合GADH催化活性的影响
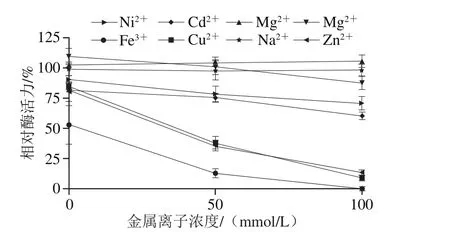
图9 金属离子对膜结合GADH催化活性的影响Fig. 9 Effect of metal ions on membrane-bound GADH activity
从图9可以看出,膜结合GADH活力基本不被Na+影响;Mg2+对该酶的催化活性略有促进作用;低浓度的Mn2+对酶活力略有促进作用,而随着浓度的增加又会抑制酶活力。Ni2+、Cd2+、Fe3+、Cu2+和Zn2+对膜结合GADH的催化活性均有抑制作用,且浓度越高抑制作用越强。其中,100 mmol/L的Fe3+、Cu2+或Zn2+均可使膜结合GADH活力丧失85%以上,甚至可完全抑制其活力。
2.3.4 变性剂和EDTA对膜结合GADH催化活性的影响
脲和EDTA对膜结合GADH的催化活性基本没有影响,而巯基乙醇和SDS对膜结合GADH的催化活性均有抑制作用。10 mmol/L的巯基乙醇可使该酶活力下降30%左右;10 mmol/L的SDS可使该酶活力丧失90%左右(表2)。
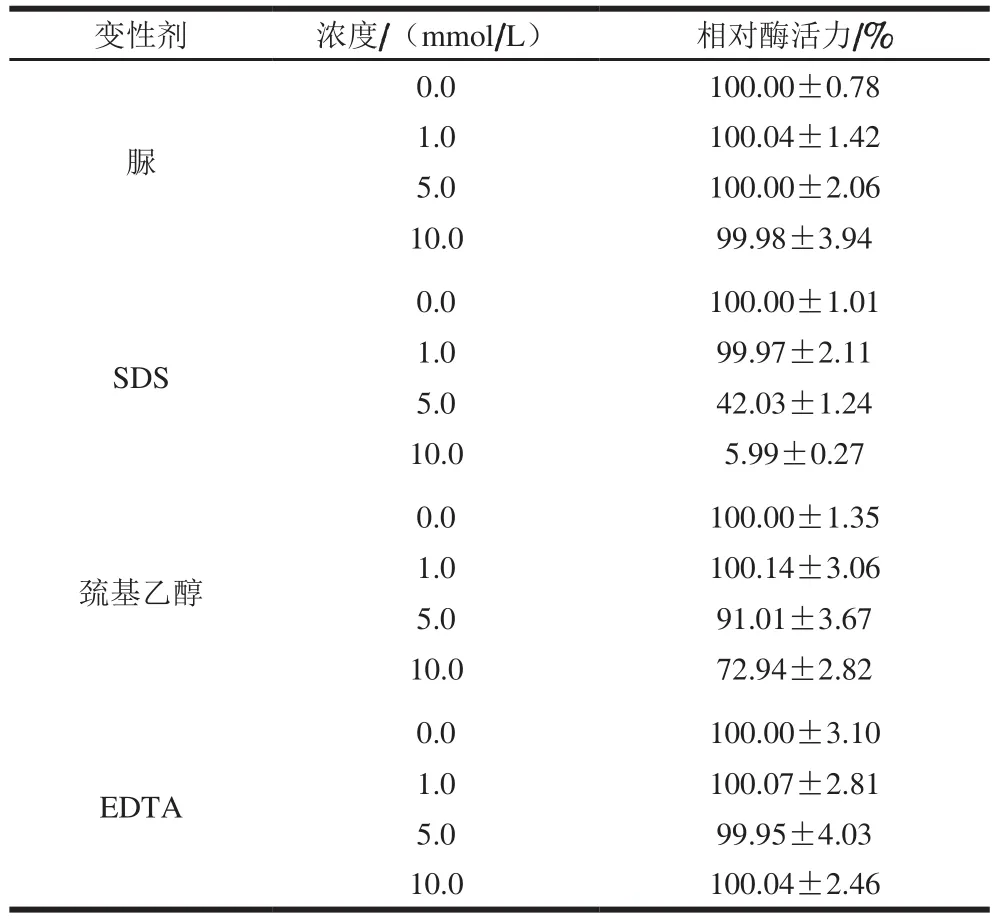
表2 变性剂和EDTA对膜结合GADH催化活性的影响Table 2 Effects of denaturants and EDTA on membrane-bound GADH activity
2.3.5 有机溶剂对膜结合GADH催化活性的影响
有机溶剂通过降低酶分子周围介质的极性、增加酶分子周围环境的疏水性而影响酶活力。如图10所示,甘油对膜结合GADH的催化活性没有影响,而甲醇、丙酮、异丙醇和乙醇对其具有明显的抑制作用。在反应体系中有机溶剂体积分数为15%的条件下,甲醇或丙酮可使膜结合GADH的催化活性丧失80%左右,异丙醇可使其催化活性丧失90%左右,乙醇几乎能够完全抑制该酶的催化活性。
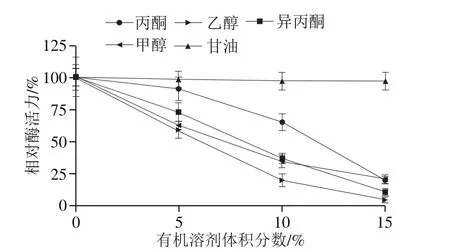
图10 有机溶剂对膜结合GADH催化活性的影响Fig. 10 Effect of organic solvents on membrane-bound GADH activity
2.3.6 有机酸对膜结合GADH催化活性的影响
乙醇酸、乙醛酸和2KGA对膜结合GADH的催化活性几乎没有影响,而低浓度的草氨酸或草酸能对膜结合GADH的催化活性产生强烈的抑制作用(表3)。15 mmol/L的草酸可使膜结合GADH活力降低30%左右,5 mmol/L的草氨酸可使膜结合GADH活力降低90%以上。
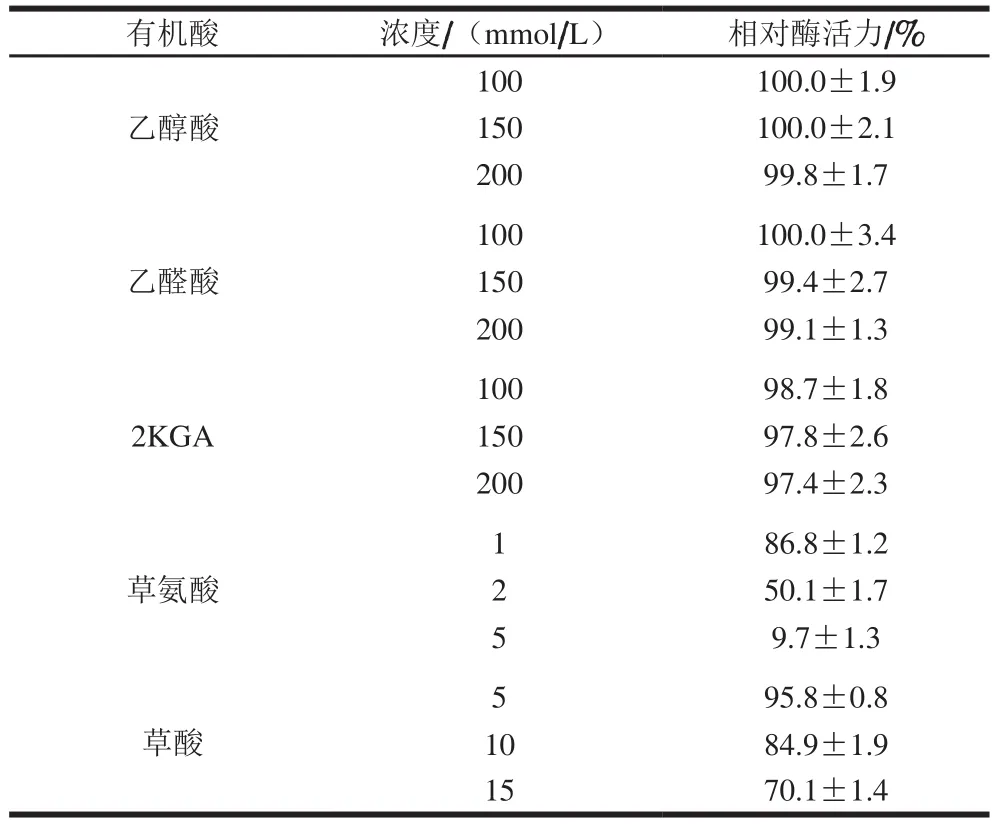
表3 有机酸对膜结合GADH催化活性的影响Table 3 Effect of organic acids on membrane-bound GADH activity
2.3.7 膜结合GADH的底物特异性
以2KGA、DL-苹果酸、L-抗坏血酸、酒石酸、柠檬酸、D-山梨醇、D-果糖、D-半乳糖、D-木糖、D-葡萄糖、D-麦芽糖、D-甘露醇或L-阿拉伯糖代替D-葡萄糖酸钠作为酶活力测定体系中的底物时,检测不到膜结合GADH的催化活性。只有以D-葡萄糖酸钠作为底物时,膜结合GADH才具有催化活性。因此,粘质沙雷氏菌膜结合GADH具有严格的底物特异性。
2.3.8 膜结合GADH的Km值和Vm值
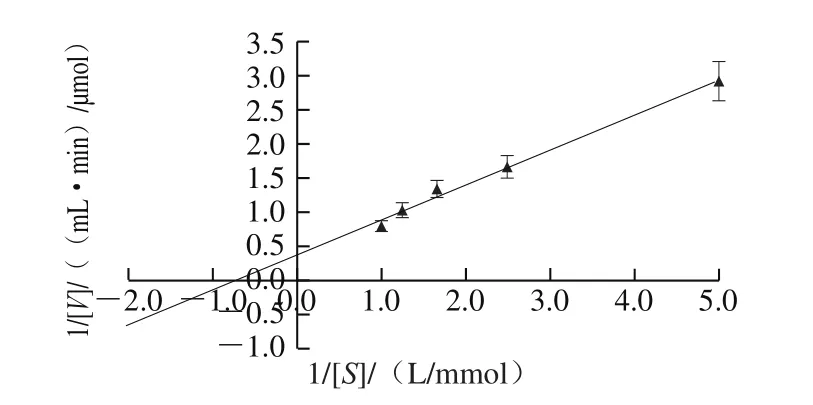
图11 双倒数法测定膜结合GADH的米氏常数Fig. 11 Km determination of membrane-bound GADH by Lineweaver-Burk plot
从图11可以看出,在25 ℃、pH 6.0的条件下,反应速率与底物D-葡萄糖酸浓度之间存在线性关系,其拟合方程为y=0.508 6x+0.381 8(R2=0.992 8),由此计算得到的Km值为1.33 mmol/L,最大反应速率Vm为2.62 μmol/(mL·min)。
2.3.9 不同微生物来源的膜结合GADH比较
微生物来源的膜结合GADH均具有严格的底物特异性,即只有在D-葡萄糖酸作为底物时才具有催化活性。在结构和酶学特性上,不同微生物来源的膜结合GADH存在一定差异,主要反映在亚基的分子质量、酶的最适反应温度、酶的最适反应pH值和反应动力学参数Km等方面(表4)。

表4 不同微生物来源的膜结合GADH的性质Table 4 Properties of membrane-bound GADHs from various microorganisms
3 结 论
本研究以2KGA高产菌株粘质沙雷氏菌JUIM03为材料,利用Triton X-114相分离法提取其膜蛋白,经硫酸铵分级沉淀、DEAE-Sepharose阴离子交换层析和Hydroxyapatite层析步骤,获得了比活力为91.43 U/mg的粘质沙雷氏菌膜结合GADH,其最终的纯化倍数为160.4 倍,回回率为3.8%。
SDS-PAGE分析表明,从粘质沙雷氏菌JUIM03中纯化的膜结合GADH由3 个亚基组成,其分子质量分别为65.0、45.0、23.0 kDa左右,与来源于其他氧化细菌的膜结合GADH在亚基组成上是一致的。另外,纯化的膜结合GADH的大亚基含有FAD,且FAD以辅基的形式与大亚基共价结合。可见光区吸回光谱分析结果表明,还原型的纯化产物具有还原型细胞色素C的特征性吸回光谱,因此可以认为所纯化的膜结合GADH是含有细胞色素C的黄素蛋白。HPLC分析表明,纯化的膜结合GADH催化氧化D-葡萄糖酸所形成的产物为2KGA,进一步说明了所纯化的膜结合GADH是FAD依赖性GADH。
酶学性质研究结果表明,粘质沙雷氏菌JUIM03膜结合GADH的最适反应温度为40 ℃,最适反应pH值为5.0,在30 ℃以下、pH 5.0~6.0的条件下较为稳定;该酶具有严格的底物特异性,只有在D-葡萄糖酸作为底物时才具有催化活性,其Km值为1.33 mmol/L,Vm为2.62 μmol/(mL·min);一些金属离子(如Fe3+、Cu2+和Zn2+)、有机溶剂(乙醇、异丙醇、甲醇和丙酮)、变性剂(SDS和巯基乙醇)以及有机酸(草氨酸和草酸)对膜结合GADH的催化活性具有明显的抑制作用。
该研究结果为粘质沙雷氏菌2KGA生物合成的过程优化与控制提供了一定的理论依据,同时也对2KGA酶法生产工艺的开发具有潜在的借鉴作用。
