盐胁迫对厌氧氨氧化污泥脱氮性能及其胞外聚合物特性的影响❋
2020-01-07刘晓朋季军远
张 倩,刘晓朋,张 旭,洪 波,季军远❋❋
(1.中国海洋大学环境科学与工程学院,山东 青岛 266100;2.齐鲁交通服务开发集团有限公司,山东 济南 250000)

高盐为工业废水常见特征,如味精生产废水、制革废水、稀土冶炼废水、海产品加工废水等。高盐会破坏微生物的细胞膜和菌体内酶系统,对微生物的生长代谢产生抑制或导致其死亡[4]。微生物是废水生物处理工艺高效稳定的根本,耐盐型功能菌的获取成为厌氧氨氧化工艺成功应用于高盐工业废水脱氮治理的关键。相关研究得出海洋系统中存在丰富的厌氧氨氧化菌,为最理想的耐盐型厌氧氨氧化菌源。冯莉等[5]通过接种胶州湾底泥,采用厌氧序批式反应器(Anaerobic sequencing batch reactor,ASBR)反应器经192天成功富集培养出海洋厌氧氨氧化菌(Anaerobic ammonium oxidizing bacterium,AnAOB)。厌氧氨氧化菌为自养菌,生长速率缓慢,细胞产率低,直接从海洋中获取可工程应用的功能菌难以实现。鉴于已存在较为广泛的淡水型厌氧氨氧化菌源,对其逐步盐度驯化提高其耐盐性成为获取的最佳途径。国内外研究者[6-8]开展了盐度对淡水型厌氧氨氧化工艺性能及菌群结构影响研究,盐度对工艺稳定性产生影响,厌氧氨氧化菌经盐驯化后其耐盐型增强,优势菌群相应变化。
ANAMMOX工艺耐盐驯化调控模式的不同直接影响其对高盐的耐受性,影响工艺脱氮效能。Chen等[9]研究了不同管理策略的高盐环境下厌氧氨氧化反应器的性能;邓雄文等[10]考察了定盐浓度(18 g·L-1)逐步提升氮负荷调控模式对厌氧氨氧化工艺脱氮性能影响,得出此盐度下工艺对负荷的承载力减弱,负荷提升难度大,且反应器性能恢复时间长;陆慧锋[11]研究考察了高、低负荷下盐度驯化效果,得出低负荷条件下逐步提升盐度的驯化模式较高负荷条件下盐度驯化效果优,低负荷下驯化可加快厌氧氨氧化菌对高盐的适应,更利于获取高效耐盐功能菌群的结论。而至今对低负荷下盐驯化对AnAOB中胞外聚合物(Extracellular polymeric substances,EPS)特性影响研究较少。EPS在促进微生物聚集体形成、提升反应器污泥浓度,提高污染物去除以及抵抗冲击负荷等方面发挥着重要作用。Ma等[12]的研究表明,厌氧氨氧化菌的EPS含量随盐度提升而增加;Xing等[13]研究表明,盐度冲击引起AnAOB的EPS总量较原来增加2.58倍;Liu等[14]的研究表明,EPS产生量少的微生物具有较差的耐盐性。微生物可通过分泌更多EPS增强其对渗透压的抵抗能力,抵御高盐对功能微生物活性的抑制[15]。研究较优驯化模式(低负荷下盐度驯化)下盐胁迫对AnAOB中EPS特性影响可阐明AnAOB对盐度的刺激响应过程,进一步明晰ANAMMOX工艺应用于高盐含氮废水脱氮过程的特征变化。基于此,本文开展了低容积负荷下盐胁迫对厌氧氨氧化污泥EPS特性影响研究,以期为工艺的应用提供理论依据和技术支撑。
1 材料与方法
1.1试验装置
本试验采用上流式厌氧污泥床(Upflow anaerobic sludge blanket,UASB)反应器作为试验装置(见图1),反应器由有机玻璃制成,呈圆柱状,总容积为3.5 L,有效容积为1.4 L,其中反应区内径6 cm,高度为50 cm。废水经由蠕动泵连续泵入反应器底部进水口,经反应区中厌氧氨氧化污泥降解且经三相分离器分离后,通过上部出水口外排。反应过程所产生的气体从反应器顶部排气孔排出。试验过程中通过恒温水浴维持反应器工作温度为(35±1) ℃,反应器外裹黑布以避免光照的不利影响。
1.2 接种污泥
试验所用厌氧氨氧化絮体污泥取自山东某污水处理厂剩余污泥脱滤液厌氧氨氧化脱氮处理装置,SS为16.6 g·L-1,VSS为10.0 g·L-1,VSS/SS为0.60。UASB反应器污泥接种量为1.2 L。
1.3 试验废水
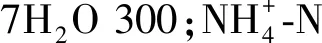
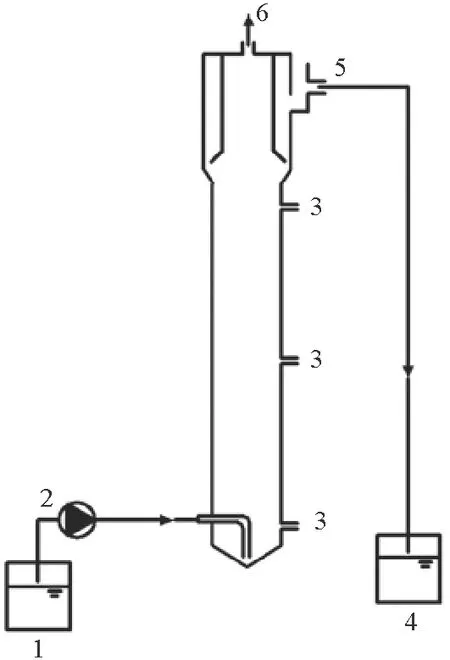
(1.进水箱Influent tank;2.蠕动泵Peristaltic pump;3.取样口Sample ports;4.出水箱Effluent tank;5.出水口Effluent outlet;6.排气口Biogas。)
图1 试验装置示意图
Fig.1 Schematic diagram of experimental equipment
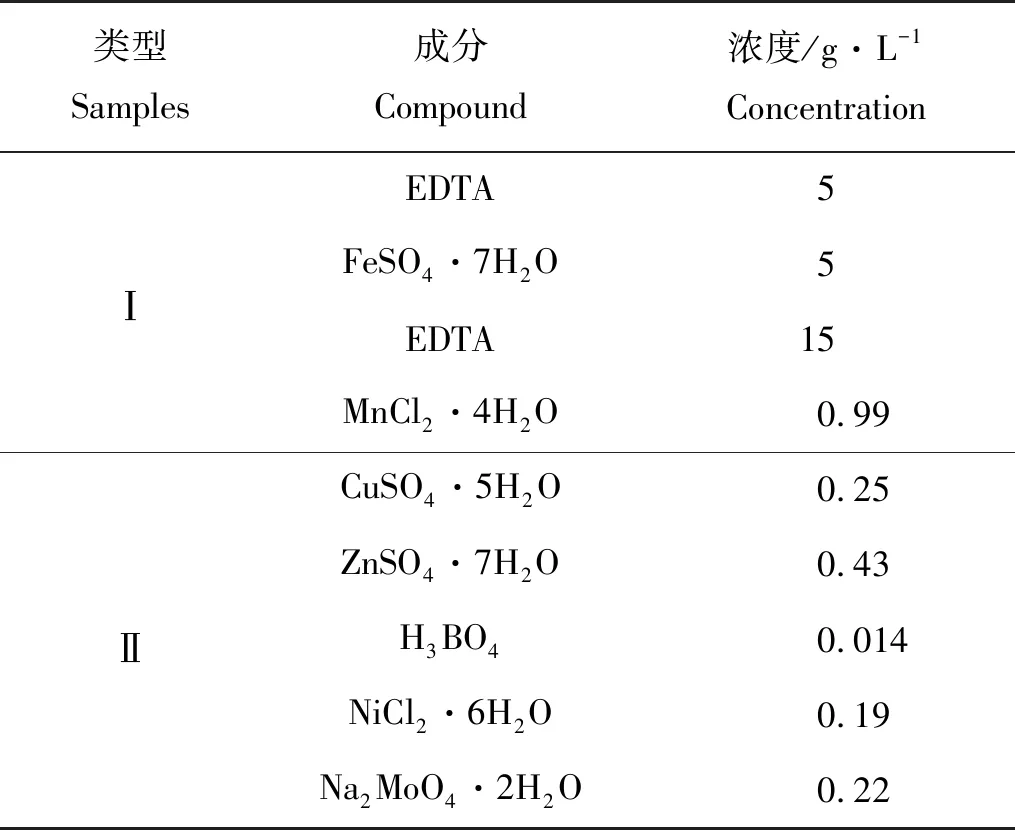
表1 微量元素组成Table 1 Composition of trace elements
1.4 分析项目及测定方法
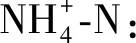
胞外聚合物(EPS)提取与测定:参照Wang等[17]的方法分层提取松散型胞外聚合物(Loosely bound EPS,LB-EPS)与紧密型胞外聚合物(Tightly bound EPS,TB-EPS)。采用硫酸-蒽酮比色法[18]测定多糖(Polysaccharide,PS)含量,采用改进的Folin-酚试剂法[19]测定蛋白质(Protein,PN)的含量。
三维荧光光谱[20-21](Three-dimensional excitation-emission matrix fluorescence spectroscopy,3D-EEM):采用荧光光度计(F-4600,Hitachi,Japan)测定样品中LB-EPS和TB-EPS的三维荧光光谱。激发波长(Ex)和发射波长(Em)的扫描范围分别为200~450和240~550 nm,扫描间隔为5 nm,扫描速度采用1 200 nm/min。用超纯水作为空白样品校正水的拉曼散射。
红外光谱[20-21](Fourier transform infrared spectroscopy,FTIR):将经-35 ℃下冷冻干燥处理后的LB-EPS和TB-EPS与干燥的溴化钾(KBr)粉末按1∶100比例研磨混合并压制成半透明薄片,利用傅里叶变换红外光谱仪(Tensor 27,Bruker Optics,Germany)在400~4 000 cm-1波数范围内测定其红外光谱。
2 结果与讨论
2.1 盐胁迫下ANAMMOX工艺脱氮性能
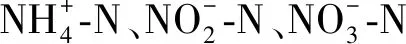
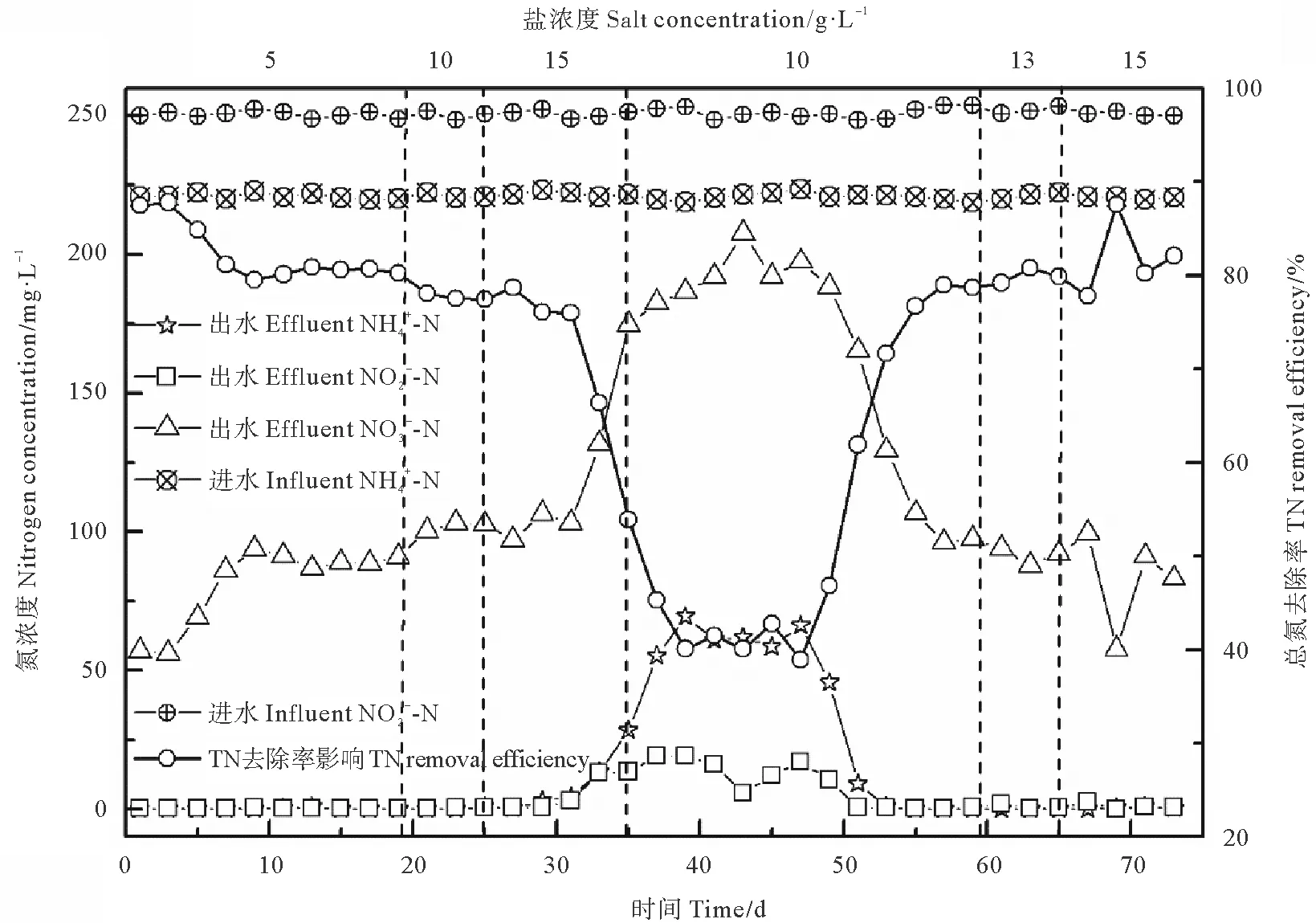
图2 盐浓度对出水浓度及TN去除率的影响Fig.2 The effect of salinity on the effluent concentration of and the TN removal efficiency
试验维持反应器氮容积负荷(Nitrogen loading Rate,NLR,kg·(m3·d)-1)恒定((0.47±0.02) kg·m-3·d-1)。不同盐浓度条件下ANAMMOX工艺氮去除负荷(Volume substrate nitrogen removal rate,NRR,kg·(m3·d)-1)及化学计量比见图3。由图可知,盐浓度为5 g·L-1阶段(第1~19天),氮去除速率(NRR)相较于无盐工况下NRR(0.40 kg·m-3·d-1)呈轻微下降,为0.38 kg·m-3·d-1;当盐浓度提升至10 g·L-1后(第20~25天),NRR维持稳定,为0.36 kg·m-3·d-1;自第26天起,盐浓度提升至15 g·L-1(第26~35天),反应器脱氮性能出现恶化,NRR急剧下降,由0.36降至0.25 kg·m-3·d-1;第36天起,将盐浓度由15 g·L-1降低至10 g·L-1,以期恢复反应器脱氮性能,NRR仍继续恶化,降至0.18 kg·m-3·d-1,从第48天开始,盐浓度对ANAMMOX菌抑制作用减弱,NRR开始稳步增加,至第59天时NRR已升至0.36 kg·m-3·d-1,已恢复至抑制作用前NRR值。之后分两阶段(13和15 g·L-1)提高盐浓度,NRR基本维持稳定,为0.37 kg·m-3·d-1,此盐浓度下对ANAMMOX抑制作用大大减弱,功能菌已呈现相应的耐盐性。
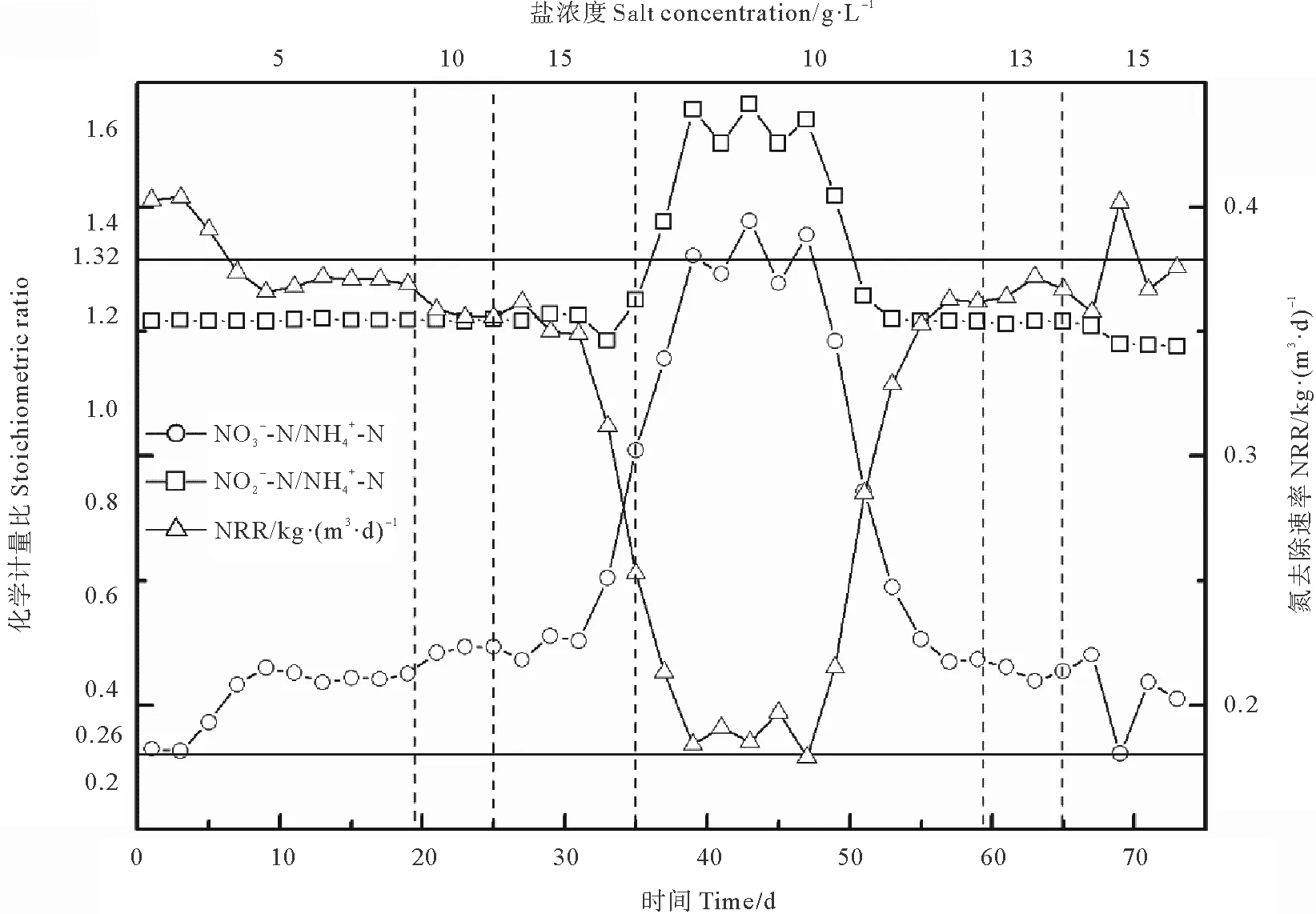
图3 盐浓度对NRR及化学计量比的影响Fig.3 Effect of salinity on NRR and stoichiometric ratio
2.2 盐胁迫下胞外聚合物含量及特性
不同盐浓度下ANAMMOX污泥中EPS含量及组分特征见图4。由图可知,随盐浓度提升污泥中EPS含量逐渐增加。在盐浓度分别为0、5、10、15 g·L-1时,EPS含量分别为8.00、8.91、9.68、13.35 mg·g-1VSS,各盐浓度工况下EPS含量相较于无盐工况下分别增加了11.3%、21.0%、66.9%,随盐浓度不断提升,其抵御盐胁迫而分泌产生的EPS含量与盐浓度成正相关(R2=0.86)。各盐浓度工况下EPS分层组成中,均以TB-EPS为主,TB-EPS占比分别为92.2%、81.6%、71.1%、79.9%,相较于无盐工况,盐浓度会降低TB-EPS占比。在盐浓度分别为0、5、10、15 g·L-1时,在LB-EPS中PN/LB-EPS值分别为64.5%、82.8%、74.6%和85.9%,在TB-EPS中PN/TB-EPS值分别为90.6%、95.6%、91.1%和87.2%,各分层EPS中均以PN为主,表明蛋白质在厌氧氨氧化微生物对盐胁迫应答过程中起关键作用,与ANAMMOX中EPS相关研究结论一致[24]。分析单一组分含量,在盐浓度分别为0、5、10、15 g·L-1时,总蛋白含量分别为6.91、8.58、8.36和11.61 mg/(g VSS),总多糖的含量分别为1.09、0.62、1.33、1.74 mg/(g VSS),总蛋白的含量显著增加,而总多糖含量仅有轻微增加,这与杨明明等[20]的研究结果相似。
图4 盐浓度对LB-EPS和TB-EPS、PN和PS含量的影响Fig.4 Effect of salinity on LB-EPS and TB-EPS content and PN and PS
2.4 盐胁迫下EPS荧光特性
图5为不同盐浓度下LB-EPS和TB-EPS三维荧光光谱图。表2为不同盐浓度下LB-EPS和TB-EPS中各组分三维荧光光谱参数。由图5可知,不同盐浓度下各EPS中共出现4个荧光峰,分别为荧光峰A(220~240 nm/335~340 nm)、荧光峰B(275~295 nm/335~340 nm)、荧光峰C(270~275 nm/440~445 nm),其中荧光峰A和荧光峰B均存在于各盐浓度工况的LB-EPS、TB-EPS中。参考相关文献可确定荧光峰A为芳香族蛋白类物质,荧光峰B为色氨酸蛋白类物质,荧光峰C为富里酸类物质[25]。盐浓度分别为0、5、10、15 g·L-1时,LB-EPS与TB-EPS组分均以蛋白质组分为主,且蛋白质主要组成为芳香族蛋白类和色氨酸蛋白类(峰A和峰B)。LB-EPS中,盐浓度为5 g·L-1工况较无盐工况,芳香族蛋白类物质(峰A)强度较色氨酸蛋白类物质(峰B)峰强度明显增强,结合图4可知,5 g·L-1盐浓度下LB-EPS中PN含量较无盐下大幅增长主要由芳香族蛋白类物质引起。5与10 g·L-1盐浓度下,色氨酸蛋白类物质(峰B)峰强度接近或略高于芳香族蛋白类物质(峰A),但当盐浓度为15 g·L-1时,色氨酸蛋白类物质(峰B)峰强度明显低芳香族蛋白类物质(峰A),且同时出现富里酸类物质,表明15 g·L-1盐浓度已影响AnAOB生长,造成功能菌分解,此过程可能将色氨酸蛋白类物质转化为富里酸类物质[20];而同样盐浓度下,TB-EPS荧光图谱中并未出现峰C,表明此盐浓度仅使外层EPS(LB-EPS)通过组分调整应答盐胁迫影响,尚未引起内层EPS(TB-EPS)中组分发生改变,但具体机理仍需进一步研究。结合TB-EPS三维荧光图谱与TB-EPS中PN、PS含量分析(见图4)可得,5 g·L-1盐浓度下TB-EPS中PN含量增长主要由色氨酸蛋白类物质引起。相同盐浓度下LB-EPS与TB-EPS荧光强度对比可得,EPS 中组成主要以TB-EPS为主,且各分层EPS的组成成分均主要为类蛋白物质,与前面的实验结果一致(见图4)。
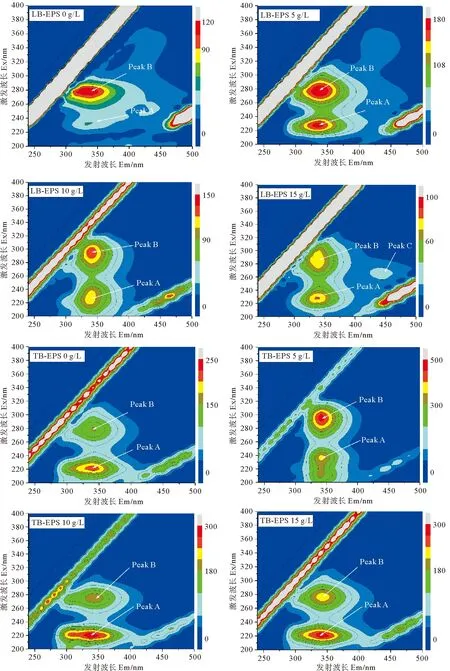
图5 不同盐浓度下LB-EPS和TB-EPS的三维荧光光谱Fig.5 Three-dimensional fluorescence spectra of LB-EPS and TB-EPS under different salinities
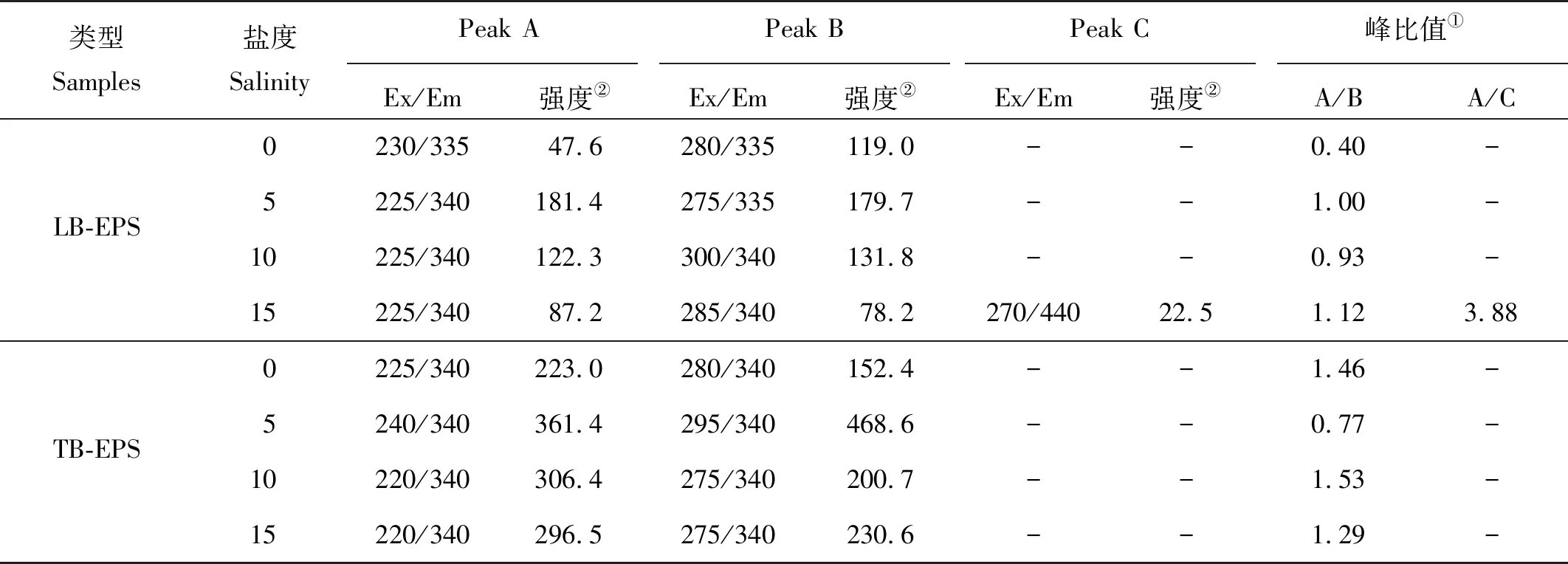
表2 不同盐浓度下LB-EPS和TB-EPS的荧光光谱参数Table 2 Fluorescence spectral parameters of LB-EPS and TB-EPS at different salinities
Note:①Peak ratio;②Intensity
由表2可知,在LB-EPS中,相较于无盐工况,峰A在盐浓度为5、10、15 g·L-1工况下其发射波长(Em)均发生5 nm红移,激发波长(Ex)均发生5 nm蓝移;峰B在盐浓度为5 g·L-1时激发波长发生5 nm蓝移,在盐浓度为10、15 g·L-1时其发射波长均发生5 nm红移,而激发波长分别发生25 nm红移(10 g·L-1)与5 nm红移(15 g·L-1)。在TB-EPS中,相较于无盐工况,峰A在盐浓度为5、10、15 g·L-1时其发射波长未产生移动,但激发波长分别发生15 nm红移(5 g·L-1)与5 nm蓝移(10、15 g·L-1);峰B在盐浓度为5、10、15 g·L-1时其发射波长未产生移动,但激发波长分别发生15 nm红移(5 g·L-1)与5 nm蓝移(10、15 g·L-1),其变化趋势与峰A一致。研究表明,波长移动与EPS中各成分的结构变化密切相关,其中波长红移与含羰基取代基、羟基、烷氧基、氨基和羧基含量增加相关联,而波长蓝移则与芳香酯基减少,芳香环数下降,共轭键数的降低和羰基、羟基和氨基的减少直接相关[21]。荧光峰波长及峰强度的变化说明各层EPS中的组分构成及组分结构随盐浓度变化而发生改变。
2.5 盐胁迫下分层EPS官能团特性
为探究不同盐浓度胁迫下LB-EPS和TB-EPS官能团组成特性,分别对LB-EPS和TB-EPS样品进行傅里叶红外光谱分析,结果如图6。各盐浓度下从波数3 462~613 cm-1共有6个主要的吸收峰,其波数分别为3 462~3 418 cm-1、2 382~2 380 cm-1、1 636~1 634 cm-1、1 414~1 410 cm-1、1 283~1 279 cm-1、644~613 cm-1。其中,3 462~3 418 cm-1处的吸收峰主要与多糖类化合物羟基和蛋白质类物质氨基的伸缩振动有关[21];2 382~2 380 cm-1处主要代表O=C=O的伸缩振动;1 636~1 634 cm-1处的吸收峰是由蛋白质酰胺I物质引起,主要与蛋白质酰胺I的二级结构中的β-折叠中的C=O伸缩振动密切相关[27];1 414~1 410 cm-1处的吸收峰是由蛋白质类物质羧基中的C—O与COO键的伸缩振动形成的[21];1 283~1 279 cm-1附近的吸收峰是由蛋白质酰胺 III 处 C—N 伸缩振动引起的[27];900~600 cm-1属于指纹区,存在与氨基酸和核酸相关的振动峰[27],LB-EPS、TB-EPS红外分析同样表明,其中存在多种类型的蛋白质及不同的蛋白质二级结构,其官能团主要为O—H、N—H、C=O、C—N。
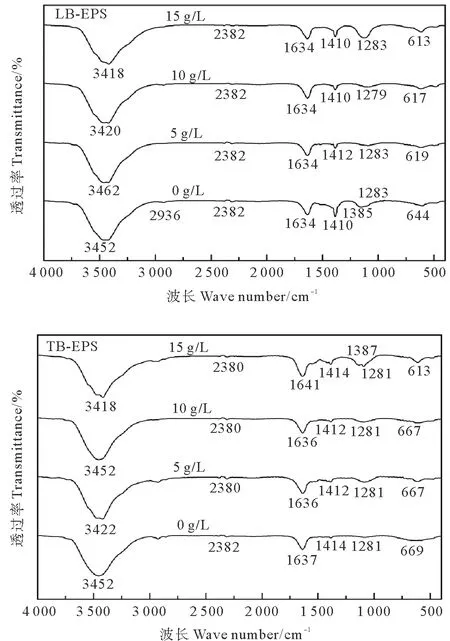
图6 不同盐浓度下LB-EPS和TB-EPS的红外光谱Fig.6 Infrared spectra of LB-EPS and TB-EPS under different salinities
随盐浓度由0 g·L-1提升至15 g·L-1,LB-EPS中3 452 cm-1波数处的吸收峰逐步偏移至3 418 cm-1,TB-EPS中相应波数的吸收峰也发生了类似的偏移,其主要由多糖类化合物中的羟基和蛋白类物质中的氨基引起,但具体主导物质及官能团尚无法确定,需进一步分析研究。LB-EPS中,随盐浓度增加,波数为2 936 cm-1处的吸收峰逐渐消失,代表烷烃有机物和多糖分子中的C-H的伸缩振动逐渐消失。在盐浓度为15 g·L-1工况下,波数为1 283 cm-1的吸收强度明显增加,表明LB-EPS中PN含量变化增加致使蛋白质酰胺 III 处 C—N 伸缩振动加强;同时此盐浓度工况下,TB-EPS中明显出现波数1 387 cm-1处的吸收峰,其是由甲基的伸缩振动引起的,可能为高盐胁迫下功能微生物在应答过程中TB-EPS中物质结构发生一定程度改变,形成含甲基官能团类物质。不同盐浓度工况下,LB-EPS和TB-EPS的红外光谱都发生了一定程度的变化,这表明盐胁迫将影响LB-EPS和TB-EPS中的官能团组成与数量。
3 结论
(2)盐浓度提升引起ANAMMOX污泥中EPS含量及组成、EPS中蛋白质含量与构成、EPS中功能团组成特性产生相应的应答,以抵御高盐对功能微生物的不利影响,从而稳定ANAMMOX工艺脱氮性能。
