藻际可培养细菌对雨生红球藻生长和虾青素积累的影响❋
2020-01-07刘发龙王巧晗李景玉宫庆礼
李 芸,刘发龙,王巧晗,2❋❋,刘 岩,2,李景玉,2,宫庆礼,2
(1.海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003;2.中国海洋大学水产学院,山东 青岛 266003)
自然环境中,微藻与细菌之间的相互作用非常复杂。以微藻为研究对象的正面作用中,藻际某些细菌可以通过提供营养[1]、维生素[2]、植物激素[3]、螯合剂[4]、或挥发性有机化合物[5],创造有利的生长环境[6]等方式来促进微藻生长;反面作用:细菌通过与微藻竞争营养物质[6],产生毒素[7],产生抑制微藻生长的物质[8]等方式抑制藻体生长。此外,一些细菌虽然在培养前期可以促进微藻生长,但到培养后期最终会通过多种方式杀死它们的微藻宿主[9-11]。因此,细菌群落对提升或降低微藻的生产力有潜在作用。所以确定哪些细菌具有正面或负面影响,以及其在藻际细菌群落中是否占据优势地位是非常重要的。假设可以将培养体系中细菌对微藻生长的积极影响扩大,消除细菌对微藻的消极影响,并且结合物理化学方法优化微藻生物量生产,可能会大大提高微藻生产力,具有较强的经济意义。
目前已有研究显示巴西固氮螺菌(Azospirillumbrasilense)可以促进小球藻(Chlorellavulgaris)的生长[12];根瘤菌属(Rhizobiumsp.)能促进莱茵衣藻(Chlamydomonasreinhardtii)、小球藻和布氏藻(Brucellabraunii)的生长[13]等。目前关于雨生红球藻藻际细菌的研究甚少,藻际细菌的研究大多集中在大型藻类(比如海带及紫菜)、赤潮藻类[14-18],以及一小部分饵料微藻[19-20],所以关于雨生红球藻藻际细菌多样性及菌群结构可查阅的文献及研究进展也非常有限;另外,混合营养条件下的研究更是少之又少。其中张怀瑾[21]从自养培养的雨生红球藻藻际分离得到一株橘红色的戈登氏菌株(Gordoniaterrae),研究发现该菌株能够合成胡萝卜素,其提取物也有较强的抗氧化性,且耐高温,推测其可能参与雨生红球藻的虾青素合成途径,具有巨大的研究价值。探究雨生红球藻藻际细菌多样性,获得对雨生红球藻生长的有益微生物,并且利用有益微生物来促进雨生红球藻绿色阶段细胞数量的增加或者提高雨生红球藻红色阶段的虾青素积累量,对雨生红球藻养殖具有巨大的应用前景和经济意义。本实验采用培养分离法,利用细菌LB培养基分离了乙酸钠兼养条件下雨生红球藻藻际细菌,探究了雨生红球藻藻际可培养细菌的多样性,并利用16S rDNA测序方法对分离细菌鉴定;将筛选到的细菌液体培养,分别将细菌菌液按照一定的浓度与处于活跃期的藻种共培养,确定单一细菌对雨生红球藻生长及虾青素积累的影响。试图利用藻际细菌来提高雨生红球藻生物量生产或提高虾青素含量。
1 实验材料
1.1 藻种及培养条件
本实验所使用的藻种为雨生红球藻(Haematococcuspluvialis),为中国海洋大学藻类学与藻类养殖研究实验室保存藻种。其长期在本实验室光照培养箱中于锥形瓶培养;培养条件如下:
①绿色阶段:培养温度:23 ℃;光照强度:60 μmol·m-2·s-1;光暗周期:14 h∶10 h;光源:日光灯。
②红色阶段:培养温度:26 ℃;光照强度:120 μmol·m-2·s-1;光暗周期:24 h∶0 h;光源:日光灯。实验所用雨生红球藻培养基为MCM培养基[22];pH调节为6.99~7.03。
1.2 细菌培养基及培养条件
分离纯化雨生红球藻藻际细菌使用淡水LB培养基培养[23];固、液态培养基分置于28 ℃恒温培养箱,28 ℃、180 r/min摇床培养条件下培养。
1.3 试剂药品
抗生素类:氯霉素、庆大霉素、氨苄青霉素、卡那霉素、链霉素均购于北京索莱宝科技有限公司;有机溶剂及培养基药品:甲醇、乙酸、二甲基亚砜、氢氧化钠以及配制MCM培养液所需的试剂均购于国药集团化学试剂有限公司;配制细菌通用培养基的试剂均购于Sigma-Aldrich公司。
2 实验方法
2.1 雨生红球藻藻际细菌的分离纯化
将长期在乙酸钠混合营养条件下培养且处于对数生长期的藻种,按照1∶10 的比例接种于含有270 mL灭菌MCM培养液的500 mL锥形瓶中,设置3个重复。根据藻液实际浓度稀释一定的倍数,分别吸取100 μL均匀涂布在提前倒好的无菌LB固体培养基上,置于28 ℃的恒温培养箱,待长出菌落,及时挑取单菌落于新的LB固态培养基上,多次纯化直至分离到纯种菌落,且达到鉴定质量。
2.2 细菌鉴定
2.2.1 试剂盒法提取细菌DNA 将纯化好的菌株接种于LB液体培养基,28 ℃,180 r/min 恒温摇床培养24 h,8 000 r/min 离心5 min收集菌体。采用Bacterial DNA Kit试剂盒法提取各细菌DNA。
2.2.2 PCR扩增 以提取的细菌DNA为模板,采用细菌16SrDNA序列通用引物27F(5′AGAGTTGATCCTGGCTCAG3)和1492R(5′TACGGTTACCTTGTTACGACTT3′)进行PCR扩增。
2.2.3 琼脂糖凝胶电泳及菌株测序 PCR扩增结束后,利用琼脂糖凝胶电泳,来检测扩增结果。成功扩增的PCR产物随后交由北京华大基因有限公司进行测序。将公司测序返回的16S rDNA序列在NCBI上进行BLAST搜索。将鉴定出的细菌序列上传至NCBI网站,并获得登陆号。
2.3 纯种雨生红球藻的获得
本实验中我们利用各抗菌谱抗生素联合处理雨生红球藻藻液,结合固态培养基纯化获得纯种雨生红球藻。通过查找常用抗生素抗菌谱,选择的抗生素种类为:链霉素、卡那霉素、庆大霉素、氨苄青霉素。用超纯水配制好10 g/L的抗生素母液,并采用抽滤方式除菌。4种抗生素同时分别添加(100~1 000 μg/mL;每100 μg/mL为一个梯度)处理雨生红球藻藻液(共10个处理组,每个浓度设置3个重复)。将扩种的纯种雨生红球藻培养数代以消除抗生素影响后,以培养6 d、状态较好的雨生红球藻为藻种,收集离心并用灭菌培养液洗涤3次,重新悬浮在培养液中作为藻菌共培养的藻种。
2.4 细菌保种
接种纯化好的单一菌株菌落,于装有灭菌LB液体培养液的250 mL锥形瓶中,摇床培养24 h后(T:28 ℃;转速:180 r/min);采用甘油与细菌菌液1∶1的比例保种于1.5 mL保种管中,并置于-80 ℃保存。
2.5 藻菌共培养菌种处理
分别取100 μL保种的菌液于装有灭菌的LB液体培养液的250 mL锥形瓶中摇床培养24 h,用灭菌的50 mL离心管收集菌液并离心,去掉滤液,并用灭菌MCM培养液洗涤3次,重新用新鲜MCM培养液悬浮备用。
2.6 藻菌共培养
于含265 mL灭菌培养液的500 mL锥形瓶中,分别加入30 mL重新悬浮的藻种,然后分别加入5 mL重新悬浮OD600值为0.50左右(接种浓度为104cfu/mL)的菌液。对照组不加悬浮菌液以5 mL灭菌MCM培养液代替,各处理均设置3个重复。接种完成后,同时置于绿色阶段培养条件下培养。将培养至第10天的雨生红球藻转移至红色阶段条件下培养,每天取样在光学显微镜下观察藻细胞变红情况。每天定点摇瓶3次,随机交换锥形瓶位置,以避免藻细胞贴壁、沉降以及由于光照不均造成的误差。
2.6.1 藻细胞密度的测定 在接种后第1天,每天取4 mL藻液于5 mL离心管中(取样前要充分摇匀藻液,以免取样不均所造成的误差),用灭菌的MCM培养液将藻液稀释合适的倍数,取100 μL稀释后的藻液于0.1 mL的浮游植物计数框中,在放大×100倍的光学显微镜下对藻细胞计数,每个样品计数3次,以减少计数过程中出现的误差。
2.6.2 藻液pH测定 在接种后第1天,每天取4 mL藻液于5 mL离心管中(取样前要充分摇匀藻液,以免取样不均所造成的误差)。利用Accumet.Fisher Scientific pH计测定藻液pH值。
2.6.3 叶绿素含量测定 每隔一天分别取4 mL藻液于10 mL离心管中离心,去除上清液。采用甲醇比色法测定[24]藻液叶绿素含量变化。
2.6.4 虾青素含量测定 待镜检雨生红球藻细胞完全变红后,分别取4.5 mL藻液于10 mL离心管中离心去上清液,绿色阶段培养结束后,每天取样显微镜下观察藻细胞变红情况。待对照组藻细胞完全变红后,采用分光光度法测定藻液虾青素含量[24]。
2.7 统计分析
所有数据表示为每个处理37个重复测量的代表性数值。通过计算标准偏差来检查结果的可靠性。使用软件IBM SPSS Statistics 22 单因素方差分析。通过方差分析(ANOVA)方法评估平均值的差异,确定数据是否符合方差齐性以及正态分布,结果差异显著性进行Duncan检验,使用excel软件作图。
3 结果
3.1 藻际细菌的分离与鉴定
在乙酸钠兼养雨生红球藻藻际中共分离到8株细菌,分别编号为DBQ、HS、BTH、DBB、XBL、HB、FH、JH。分离到的细菌表观特征如表1所示,照片如图1所示。根据北京华大基因公司的测序结果,分别将8株细菌16S rDNA序列在NCBI网站上进行BLAST比对,编号为DBQ、HS、BTH、DBB、XBL、HB、FH、JH的菌株分别于Pseudomonassp.,Methylobacteriumsp.、Chryseobacteriumsp.、Bacillussp.、Paracoccsusp.、Planctopirushydrillae、Rhodobactervinaykumarii、Brevundimonasvesicularis的16S rDNA序列具有最高的相似性。将8株细菌16S rDNA序列与其相近的细菌的16S rDNA序列构建的系统发育树如图2所示。将8株细菌16S rDNA的序列上传至NCBI网站,获得登陆号分别为MK675106、MK675107、MK675109、MK675110、MK675111、MK660006、MK660007、MK660008。
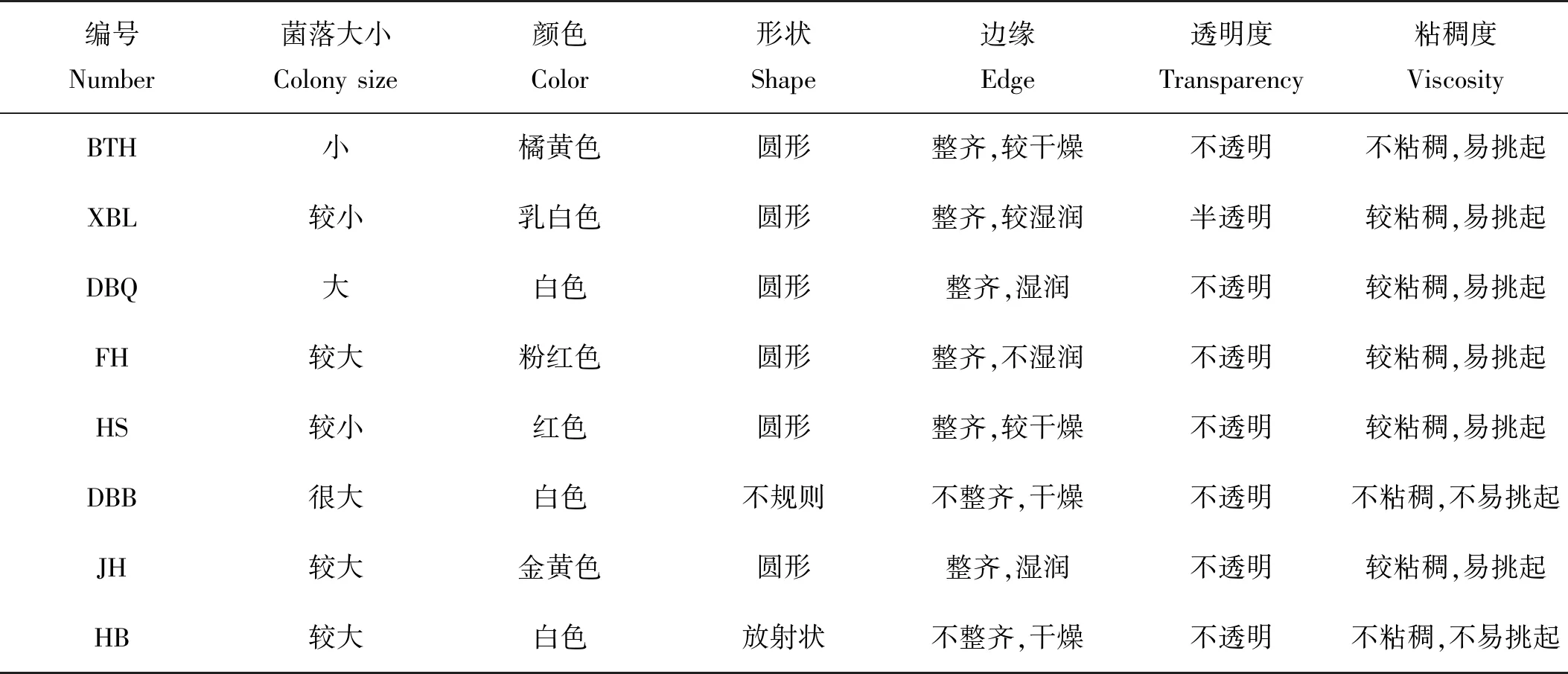
表1 藻际细菌表观特征Table 1 The apparent characteristics of bacteria in the phycospherea

图1 藻际细菌照片Fig.1 The picture of the bacterial in the phycospherea
3.2 抗生素处理雨生红球藻
将不同浓度梯度的4种抗生素组合溶液与处于对数期兼养培养的雨生红球藻一同接种于灭菌MCM培养液中处理培养3~5 d。每天摇瓶多次,以使抗生素与藻细胞充分接触。处理结束,将用抗生素处理过的藻液接种于无菌的MCM培养液中培养5~7 d,并利用添加乙酸钠的MCM固态培养基来检测除菌效果。最终在链霉素、卡那霉素、庆大霉素、氨苄青霉素分别为600 μg/mL的联合抗生素组合处理条件下,获得纯种雨生红球藻藻落。并将纯种藻种逐级扩种培养。
3.3 单一细菌的添加对雨生红球藻细胞密度的影响
如图3所示。接种当天即第0天的细胞密度不予测定,以避免藻细胞减少产生的不利影响。因XBL实验组在培养过程中很早就出现细胞沉降,而且藻细胞聚集在一起被细菌菌膜包裹,计数时存在太大误差,因此只统计了剩余7个处理组以及对照组的细胞密度变化情况。
由图可以看出在绿色阶段培养过程中,尽管藻细胞计数存在波动,但随培养时间延长而不断上升。第1~5 d,藻细胞密度增加幅度较大;培养后期增长较为缓慢;第9天大部分实验组的藻细胞密度达到最大,第10天有稍微下降的趋势,原因可能是随着培养时间的增加,藻细胞贴壁的现象严重以及藻细胞出现沉降,导致细胞计数时存在误差。细胞密度由最初接种密度约为2.50×104cells/mL,在HS处理组的第9天获得最高细胞密度,为3.65×105cells/mL。培养第1~7天,除DBQ、HB及FHS处理组外,其他各处理组均对藻细胞密度的增加表现出促进作用;但在培养结束时仅有HS、DBB 2个处理组中的藻细胞密度大于对照组(C),且仅有HS处理组第9天细胞密度显著高于对照组,其他处理组促进效果并不显著。DBQ处理组在10 d的培养过程中,密度显著低于对照组以及其他处理组;其他处理组中藻细胞密度低于对照组,但与对照组差异并不显著。在细胞计数时观察到,处理组中藻细胞比较容易聚集在一起,不同于对照组大部分藻细胞都分散存在,也是处理组在计数时存在较大误差的原因。
3.4 单一细菌对雨生红球藻藻液pH的影响
图4是各实验组在培养过程中藻液pH变化情况。实验开始时,培养体系pH为6.97~7.03。经过10 d的培养,对照组pH最高达到9.36左右,其他处理组也都达到9.00左右的高pH。培养前期pH上升幅度较大,该时间段也对应了藻细胞生长的对数期,所以通过pH的变化情况也可以从侧面反映雨生红球藻的生长分裂能力。第7~10天,pH变化幅度较小,甚至有下降的趋势,其也对应了实验组中细胞密度增加缓慢的现象,说明雨生红球藻已进入稳定生长期。而且各实验组的pH除在第3~5天有显著差异外,其余时间pH差异不显著,特别是在培养结束时。因总培养体积有限所导致的取样体积有限是导致pH测定过程中误差较大的原因,另外实验操作中也存在一定误差。
3.5 单一细菌对雨生红球藻叶绿素含量的影响
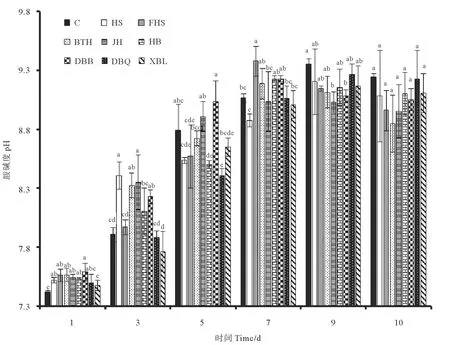
图5是各实验组在培养过程中藻液叶绿素含量变化情况。因培养初期藻细胞密度较低,所以从接种后的第3天开始每隔1 d取样测定,到培养后期每天取样测定叶绿素含量。由图可以看出在培养期间的藻液叶绿素含量变化与藻细胞密度有一定的相似性。第3天,各实验组的叶绿素含量无显著差异。第6~8天,除HB、DBQ、XBL处理组外其余各处理组中的叶绿素含量均大于对照组,但与对照组并无显著差异。第3~8天,各实验组叶绿素含量都呈现逐渐上升的趋势,在这段时期,细胞密度增加是导致叶绿素含量上升的主要因素;第8~10天,除对照组、DBQ处理组外,其他实验组都呈现不变及下降的趋势。另外,第9~10天,添加菌液的处理组叶绿素含量降低幅度普遍高于对照组。在藻液叶绿素测定过程中,因培养总体积不大,导致每天进行叶绿素测定时取样体积较小,及添加菌液的处理组在培养中后期藻细胞聚集在一起,导致取样不均匀都是导致藻液叶绿素含量测定时出现较大误差的原因。

图2 8株藻际细菌系统发育树Fig.2 The phylogenetic tree of 8 strains of bacteria in the phycosphere

(图中不同字母间表示差异显著(P<0.05)。Data with different letters at the same column mean significant difference between each other (P<0.05).)
图3 藻菌共培养雨生红球藻细胞密度
Fig.3 The cell density ofHaematococcuspluvialisin co-culture of algae and bacteria
(图中不同字母间表示差异显著(P<0.05)。Data with different letters at the same column mean significant difference between each other (P<0.05).)
图4 藻菌共培养雨生红球藻藻液pH
Fig.4 The pH value ofHaematococcuspluvialisin co-culture of algae and bacteria
(图中不同字母间表示差异显著(P<0.05)。Data with different letters at the same column mean significant difference between each other (P<0.05).)
图5 藻菌共培养雨生红球藻藻液叶绿素含量
Fig.5 The chlorophyll content ofHaematococcuspluvialisin co-culture of algae and bacteria
3.6 单一细菌对雨生红球藻虾青素积累的影响
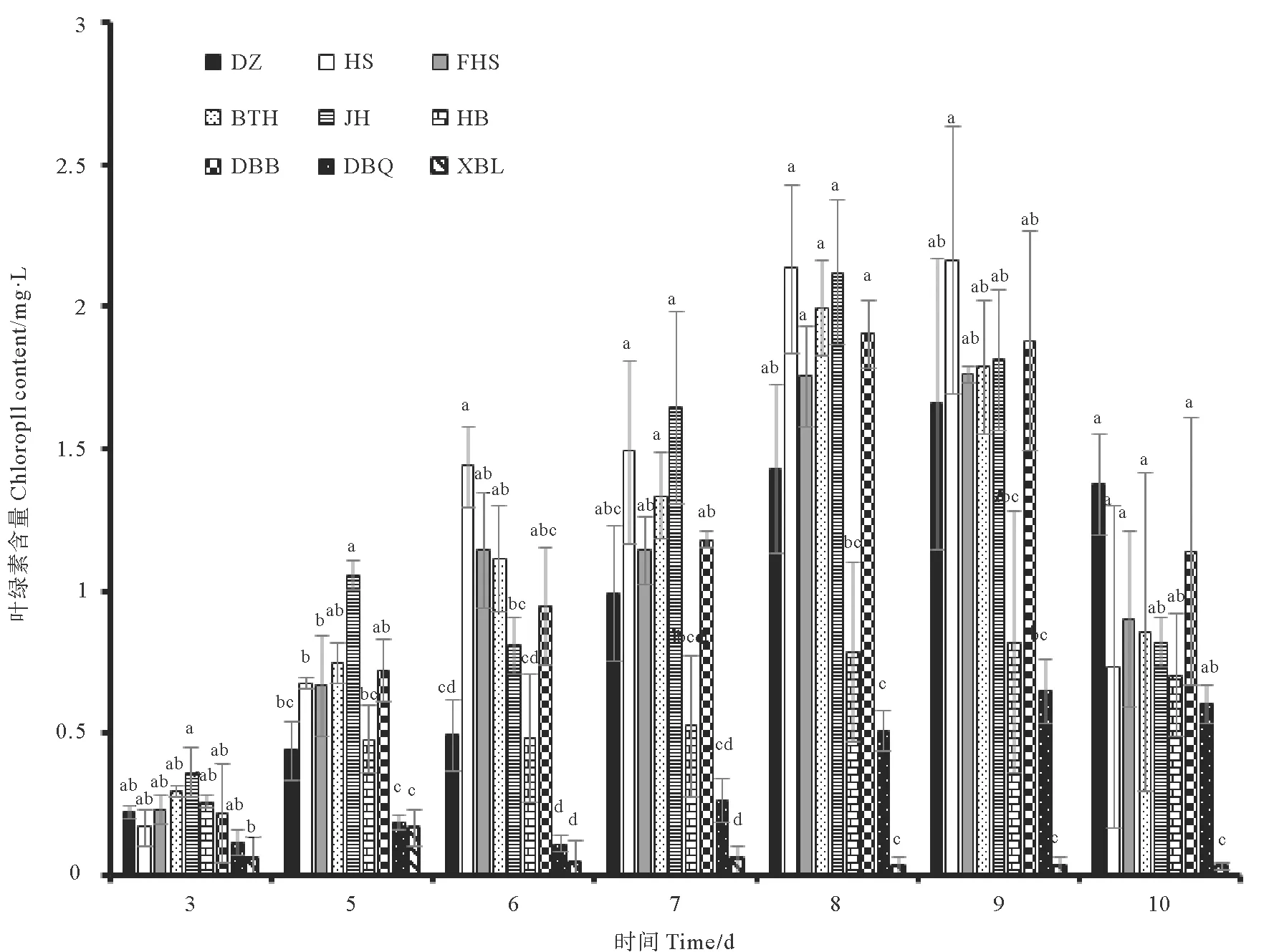
图6是单一细菌对雨生红球藻藻液及单个藻细胞虾青素含量的影响。雨生红球藻经过绿色阶段的培养,藻细胞增加到一定数目,通过改变培养条件,以加快藻细胞中虾青素的积累速率。实验发现,对藻细胞密度增加有一定促进作用的处理组中,仅有HS处理组略高于对照组,但差异并不显著,虾青素含量分别为44.35和43.84 mg/L。其他处理组藻液虾青素含量或显著低于对照组或与对照组无显著差异。DBQ处理组虽细胞密度显著低于对照组,但该处理组藻液虾青素含量与对照组并无显著差异。通过计算单个藻细胞虾青素含量,发现DBQ处理组单个藻细胞虾青素含量显著高于对照组及其他处理组,因此DBQ菌液的添加的虽然不会促进藻细胞密度的增加,但是对于单个藻细胞虾青素积累来说有一定的优势。其他处理组单个细胞虾青素含量显著低于对照组或与对照组无显著差异。
4 讨论
现阶段由于培养条件的限制,大多数异养细菌不能人为培养。有研究表明,我们仅能培养自然环境中占比不到1%的微生物[25-26]。但在本实验中利用传统培养方法获得了8株藻际细菌,不仅探究了乙酸钠兼养下雨生红球藻藻际可培养细菌的多样性,也为探究其对雨生红球藻生长和虾青素积累的影响提供了物质基础。从藻际细菌种类来看,乙酸钠兼养条件下的藻际可培养细菌种类丰富,相比张怀瑾在自养培养的雨生红球藻藻际分离到1株藻际细菌的结果[21],本实验中乙酸钠的添加是分离到藻际细菌种类较多的最大原因。乙酸钠的添加不仅为藻细胞提供了异养营养的碳源,同时也为藻际细菌的生长繁殖提供了营养。分离到的藻际细菌以变形菌门(Proteobacteria)为主,该菌门也在很多海洋微藻藻际被分离到[17,27-29],虽然雨生红球藻为淡水微藻,其与海水细菌种类同源性还是较大的。另外,分离过程中拟杆菌门(Bacteroidetes)的Chryseobacteriumsp.是优势菌株,该菌株也是在自然环境中分离比较频繁的细菌种类[30-31]。另外,有许多研究表明Paracoccussp.、Pseudomonassp.中的某些菌株具有降解有机污染物的能力[32-34]。
目前来说,获得纯种微藻的方法有很多。利用单一的除菌方法往往效果不佳,局限性较大,导致纯化效率不高。本实验中我们结合韩吉昌等[35]提供的无菌微藻获得方法,采用应用广泛的抗生素处理法结合平板划线法来获得纯种藻株。在藻菌共培养实验中,发现有2株菌株(DBB、HS)对藻细胞密度增加有促进作用,其分别属于厚壁菌门(Bacteroidetes)、变形菌门。对于有些细菌在培养前期促进藻细胞密度增加,而在培养后期抑制藻细胞生长的现象,很可能是因为培养前期各营养元素较为充足,并且异养细菌与藻细胞的营养方式有一定的互补作用,因此会加快藻细胞密度增加;而到培养中后期,由于各营养元素消耗殆尽,细菌很可能会与藻细胞争夺微量元素或者其他物质,因此会出现抑制作用;另一方面,因为分离的细菌菌株大部分会积累色素,随着体系中细菌密度的增加,很可能对藻细胞产生遮光作用,会影响藻细胞对光能的利用效率;最后体系中细菌的大量繁殖,会产生菌膜,对藻细胞的自由运动以及分裂产生阻碍作用,会加速藻细胞老化。另外,培养后期较高的pH值也许是限制雨生红球藻细胞密度增加的另一个因素。
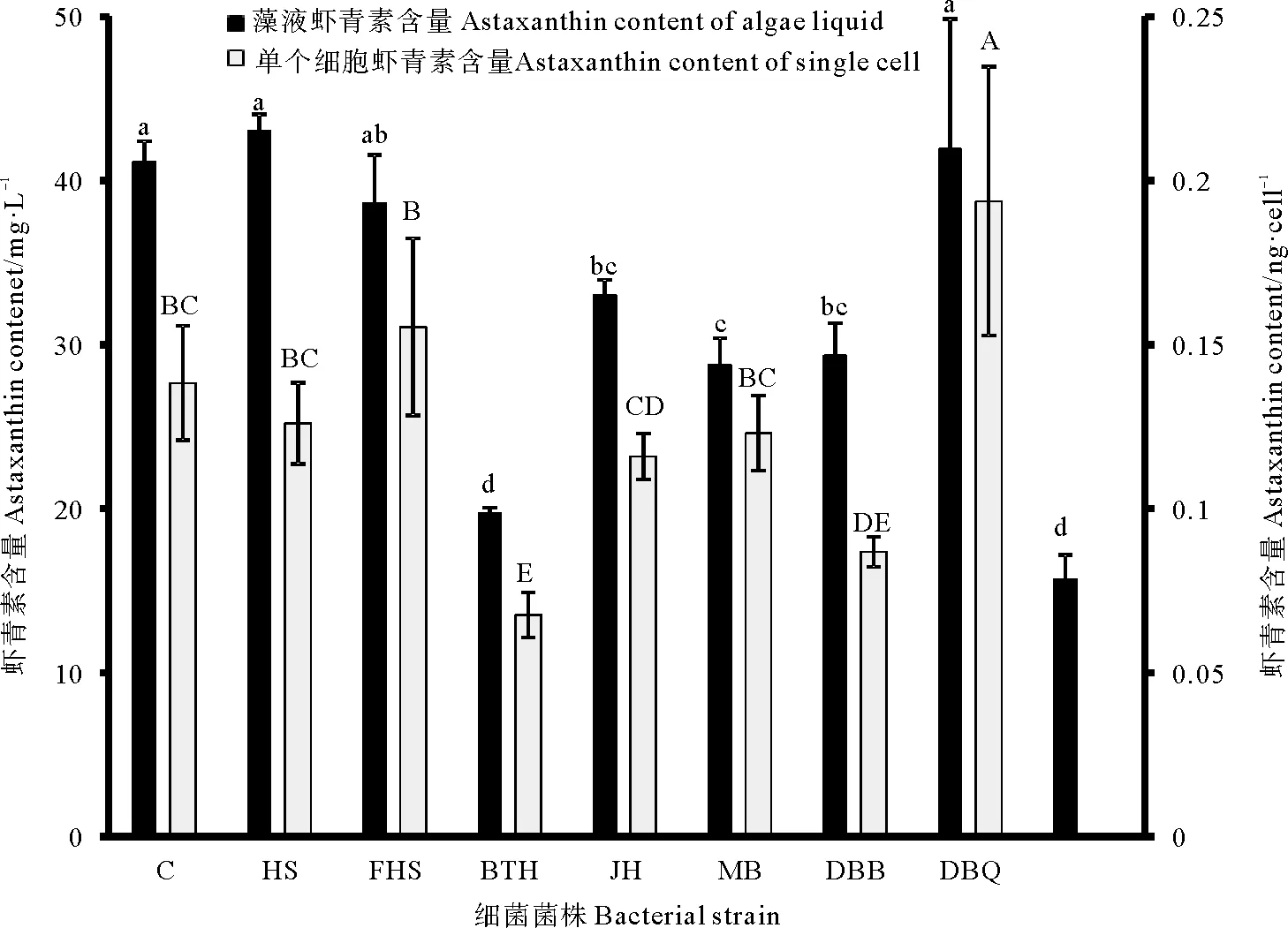
(图中不同字母间表示差异显著(P<0.05)。Data with different letters at the same column mean significant difference between each other (P<0.05).)
图6 藻菌共培养雨生红球藻藻液及单个细胞年虾青素含量
Fig.6 The astaxanthin content ofHaematococcuspluvialisliquid and single cell in co-culture of algae and bacteria
绿色阶段10天培养过程中pH上升幅度较大,一方面说明雨生红球藻对培养体系中pH的缓冲作用较差,同时说明藻细胞对碱性培养环境的耐受度较高。王璇等人的研究中发现培养过程中藻液pH的变化与营养盐浓度的变化存在一定的相关性[36],另外在该研究中在绿色阶段第 7 天后,pH 的升高放缓的现象[36]与本研究结果较为相似。各实验组pH在接种后1~5 d显著增加,这可以通过硝酸盐代谢来解释[37]:雨生红球藻细胞的不断生长繁殖使得MCM培养液中的硝酸盐被转移到雨生红球藻细胞中,其中硝酸盐通过硝酸还原酶和亚硝酸还原酶催化的两个还原反应被还原成铵;同时,在这些还原反应中会产生OH-和H2O,由硝酸盐转化为铵产生的OH-将释放到培养基中,是导致pH升高的重要原因。也有研究显示外源碳乙酸钠的添加也是导致藻液pH较高的原因,但Pang等[38]的实验中,添加1.33 g/L乙酸钠培养的雨生红球藻藻液在培养结束后稳定在8.50左右,远远低于本实验结束时9.30的pH。猜测,藻株及其他培养条件存在差异是出现巨大差异的原因。绿色阶段后期藻液中CO2溶解度增加是藻液pH有下降趋势的原因,因培养后期,藻液中营养元素已经消耗殆尽,藻细胞光合作用强度下降,导致藻液中CO2浓度升高,其次菌液的添加使得处理组细菌可能会大量繁殖,也会产生一部分CO2使得藻液CO2溶解度增加。
处于绿色阶段的雨生红球藻细胞中主要色素组成为叶绿素、β-胡萝卜素、叶黄素;红色阶段雨生红球藻细胞中虾青素含量会大幅度上升,还会出现角黄素以及海胆酮等次生胡萝卜素[39-42]。藻液叶绿素含量的变化趋势大体符合细胞密度变化趋势,说明藻液叶绿素浓度在一定程度上可以反映藻细胞密度及细胞活力。本实验中培养第8天后,各实验组中叶绿素浓度的停滞及下降预示着藻细胞生长受到胁迫,比如培养体系中pH过高、营养元素消耗殆尽等,使得藻细胞内的叶绿素向其他色素转变,虾青素开始积累。对于有些处理组中叶绿素含量降低幅度高于对照组的现象,一定程度上说明藻际细菌的添加会加快藻细胞由绿色阶段向红色阶段的转变速率,即藻际细菌的添加可能会抑制藻细胞的活力。如林伟等[43]发现,除菌后的球等鞭金藻及小球藻不易老化,更容易保持悬浮状态;回加细菌于除菌藻,藻细胞容易下沉附底。
大量研究显示雨生红球藻在胁迫条件下,例如高温、高光照、营养盐缺乏等条件,细胞内会大量积累虾青素[44]。对藻细胞密度增加有一定促进作用的 HS、DBB处理组,并不能显著提高藻液虾青素含量。对藻细胞密度增加有显著抑制作用的DBQ处理组反而能显著提高单个藻细胞虾青素含量,DBQ处理组中单位藻细胞虾青素含量较高的原因是复杂的,尤其细菌的存在会使得培养液的组分及其物质循环变得更加复杂[45]。本实验中DBQ处理组显著抑制雨生红球藻生长所造成的胁迫环境对藻细胞虾青素积累是有利的,推测原因可能是DBQ的添加促进了藻细胞内的虾青素合成途径[46],比如DBQ有可能会产生合成虾青素的前体物质[46],或者促进化学反应中酶活性加快虾青素积累[48],导致单位细胞内虾青素含量较高。本实验结果也充分说明想要提高雨生红球藻虾青素产量,绿色阶段生物量的积累和红色阶段单位藻细胞的虾青素积累效率都是必要的。因此可以考虑在雨生红球藻绿色阶段结束后,添加DBQ菌株的菌液,以达到促进单个藻细胞中虾青素积累的效果。
5 结语
本实验在乙酸钠混合营养条件下,分离了8株雨生红球藻藻际细菌。经过16S rDNA鉴定发现其分别属于Pseudomonassp.、Methylobacteriumsp.、Chryseobacteriumsp.、Bacillussp.、Paracoccussp.、Planctopirushydrillae、Rhodobactervinaykumarii、Brevundimonasvesicularis。在单一细菌与雨生红球藻共培养实验在,发现Methylobacteriumsp.、Bacillussp.能够促进绿色阶段雨生红球藻藻细胞密度的增加,Pseudomonassp.对于增加单位细胞虾青素含量具有一定优势。
