茯茶多糖提取工艺优化及其体外抗氧化和对益生菌生长的影响
2020-01-07汪梦雯刘文婷任雪宁
汪梦雯,刘文婷,任雪宁,郑 雪,胡 松,杨 苗,夏 飞
(陕西科技大学 食品与生物工程学院,陕西 西安 710021)
0 引言
茯茶是一种后发酵黑茶,具有降血脂、减肥、抗氧化和抗腹泻等[1-3]功效.以黑毛茶为原料经过毛茶筛分、汽蒸、渥堆、压制成型、发花、干燥和成品包装等工艺制成[4].“金花菌”是茯茶发酵中的优势菌群,是一种无毒无害,符合安全标准要求,并对人体健康有益的菌群[5-7].茯茶中的活性多糖具有降血压、降血脂、抗肿瘤、保肝护肝、抗氧化、调节肠道微生态等生物活性[8,9].多糖的多种生物活性,引起很多研究者的关注.目前认为多糖可通过多种途径调节人体的新陈代谢,一是通过清除活性氧(Reactive Oxygen Species,ROS)维持机体自由基平衡以达到抗氧化防御;其次可通过影响肠道菌群调节和改善胃肠道微环境,达到防治腹泻的作用.此外,也可通过调节益生菌来激活吞噬细胞,提高机体免疫力.然而,目前茯茶多糖的抗氧化活性及其对益生菌生长的影响作用还尚未完全阐释清楚.
从茯茶中有效提取茯茶多糖环节是限制其开发利用的瓶颈.目前,茯茶多糖通常采用热水浸提、酸碱浸提、酶和超声波辅助浸提等方法[10].由于茯茶多糖为水溶性多糖,且热水浸提法操作简单、成本较低,因此该方法是提取茯茶多糖最常采用的一种方法.然而,由于提取原料的差异,多糖得率往往不高、提取过程较长.采用超声辅助处理可促进细胞壁破碎,胞内多糖溶出,从而提高多糖得率以及缩短提取时间.合理结合热水浸提和超声处理提取茯茶多糖的工艺目前仍需进行探索.
为探索茯茶多糖最佳提取工艺及茯茶多糖的体外抗氧化和对益生菌生长规律的影响.本研究通过优化浸提时间、超声时间、超声功率和料液比四个因素,对超声辅助热水浸提法提取茯茶多糖工艺进行优化,并探讨茯茶多糖的体外抗氧化活性和对肠道益生菌生长的规律的影响.从而为茯茶功效的研究和高附加值茯茶多糖食品开发奠定基础.
1 材料与方法
1.1 实验材料
1.1.1 原料及菌种
市售茯茶,实验室保藏菌种:乳酸乳球菌(Lactococcuslactis),戊糖片球菌(Pediococcuspentosaceus),凝结芽孢杆菌(Bacilluscoagulans),屎肠球菌(EnterococcusFaecium)均为本研究室保存.
1.1.2 主要试剂和培养基
葡萄糖、蛋白胨、牛肉膏、酵母菌粉、吐温80、柠檬酸二胺、磷酸氢二钾、乙酸钠、硫酸镁、硫酸锰、无水乙醇、95%乙醇、丙酮、浓硫酸、苯酚,以上试剂均为分析纯.
采用MRS培养基[11],其中加入2%的琼脂即为MRS固体培养基.
1.1.3 主要仪器
紫外可见分光光度计(SP-752PC),上海光谱仪器有限公司;立式压力蒸汽灭菌器(LS-C50L),上海博迅医疗生物仪器股份有限公司;冷冻干燥机(CTFD-10S),青岛永合创信电子科技有限公司;数控超声波清洗器(KQ-300VDB),昆山市超声仪器有限公司;旋转蒸发仪(RE-52A),上海亚荣生化仪器厂.
1.2 实验方法
1.2.1 茯茶多糖提取工艺单因素实验设计
以茯茶多糖得率为考察指标,分别考察浸提时间、超声时间、超声功率和料液比四个因素对茯茶多糖得率的影响.在浸提温度为100 ℃条件下:分别选取浸提时间[12]为30 min、60 min、90 min、120 min和150 min,固定超声时间为20 min,超声功率300 W,料液比为1∶30;超声时间[13]为10 min、20 min、30 min、40 min、50 min,固定浸提时间为90 min,超声功率为300 W,料液比为1∶30;超声功率[12]为180 W、210 W、240 W、270 W和300 W,固定超声时间为20 min,浸提时间为90 min,料液比为1∶30;料液比[14]为1∶10、1∶20、1∶30、1∶40和1∶50,固定超声时间为20 min,超声功率为300 W,浸提时间为90 min.提取的茯茶多糖进行冷冻干燥,茯茶多糖的含量测定采用苯酚-硫酸法进行[15].
1.2.2 响应面实验设计
在单因素实验的基础上,以浸提时间、超声时间、液料比为自变量,利用Design Expert.V8.0.6软件进行三因素三水平Box-Behnken中心组合实验设计,如表1所示.

表1 茯茶多糖响应面试验因素与水平
1.2.3 茯茶多糖体外抗氧化活性
将提取的茯茶多糖配制成1 mg/mL的母液,并稀释至0.1 mg/mL、0.2 mg/mL、0.3 mg/mL、0.4 mg/mL、0.5 mg/mL、0.6 mg/mL,备用.分别测定茯茶多糖的总还原力[16]、DPPH自由基清除率[17]、超氧阴离子清除率[12]和羟基自由基清除率[18],每个样品重复测定三次,以同浓度的Vc作为阳性对照.
1.2.4 茯茶多糖对益生菌生长的影响
将乳酸乳球菌(L.lactis),戊糖片球菌(P.pentosaceus),凝结芽孢杆菌(B.coagulans)和屎肠球菌(E.faecium)在MRS固体培养基上活化后,接入液体MRS培养基,制备种子液.
将茯茶多糖添加至液体培养基中,使其质量浓度分别为0 mg/mL、1 mg/mL、2 mg/mL、3 mg/mL、4 mg/mL、5 mg/mL.分别接入2 mL四种待测菌种子液,进行生长曲线的测定.菌液在37 ℃恒温摇床培养,每隔2 h取菌液,用紫外分光光度计测定培养液在600 nm波长处的吸光度值.以培养时间为横坐标,以OD值为纵坐标,分别绘制四菌株在不同茯茶多糖浓度时的生长曲线.以未加入茯茶多糖的培养基为对照组.
1.3 统计分析
每个试验重复三次,结果表示为Means±SD,采用ORIGIN(Origin Pro V 9.0)作图.采用Design-Expert.V8.0.6软件进行方差分析,显著水平为P<0.05,极显著水平为P<0.01.
2 结果与讨论
2.1 单因素实验结果
2.1.1 浸提时间对茯茶多糖得率的影响
单因素筛选浸提时间结果表明,多糖得率随浸提时间延长呈现先增加后下降的趋势(图1(a)).这是因为浸提时间过长可能会导致其他物质溶出,影响茯茶多糖的得率[19,20].在90 min时茯茶多糖得率达到最大值,为3.59%.因此选择最佳浸提时间为90 min.
2.1.2 超声时长对茯茶多糖得率的影响
超声时长对茯茶多糖得率的影响如图1(b)所示.随着超声时间的增加,茯茶多糖得率呈先增加后下降的趋势.这可能是由于超声时间过长导致茯茶多糖结构发生破坏而使茯茶多糖得率下降[13].当超声时长为30 min时,茯茶多糖得率最高可达3.20%.因此最佳超声时间选择30 min.
2.1.3 超声功率对茯茶多糖得率的影响
超声功率在180~300 W范围时,茯茶多糖得率整体呈现下降的趋势,240 W时多糖得率最低,如图1(c)所示.超声功率为180 W时,茯茶多糖得率最高为2.93%,比超声功率240 W时茯茶多糖得率高0.13%.综合考虑茯茶多糖得率和成本损耗,选择最佳超声功率为180 W.
2.1.4 料液比对茯茶多糖得率的影响
料液比在1∶10~1∶30范围时,茯茶多糖得率呈上升趋势,如图1(d)所示,料液比1∶30时达到最大值,为2.95%.液料比的增加可以有效促进水溶性多糖物质的溶出,而溶剂用量过大会造成茯茶多糖浓度过低,后续浓缩、沉淀等操作步骤繁多,造成部分多糖损失,导致茯茶多糖得率下降[21,22].由此确定最佳料液比选择1∶30.
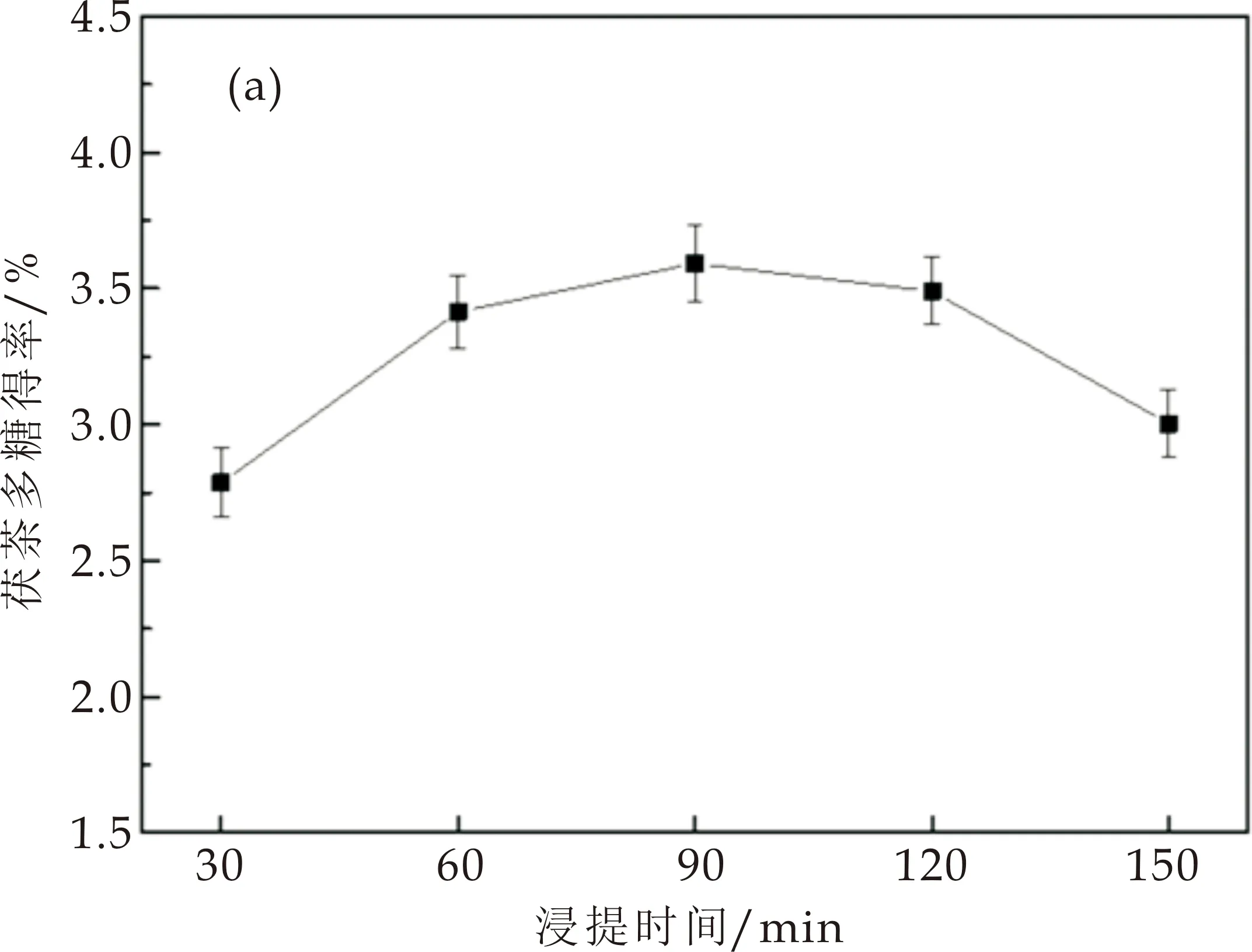
(a)浸提时间对茯茶多糖得率的影响
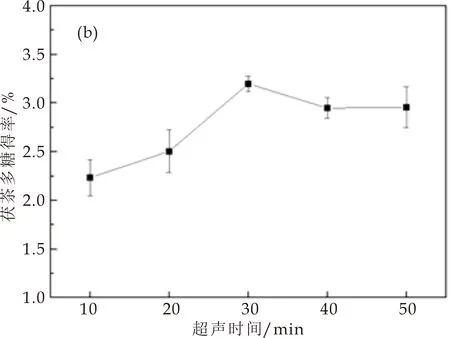
(b)超声时间对茯茶多糖得率的影响
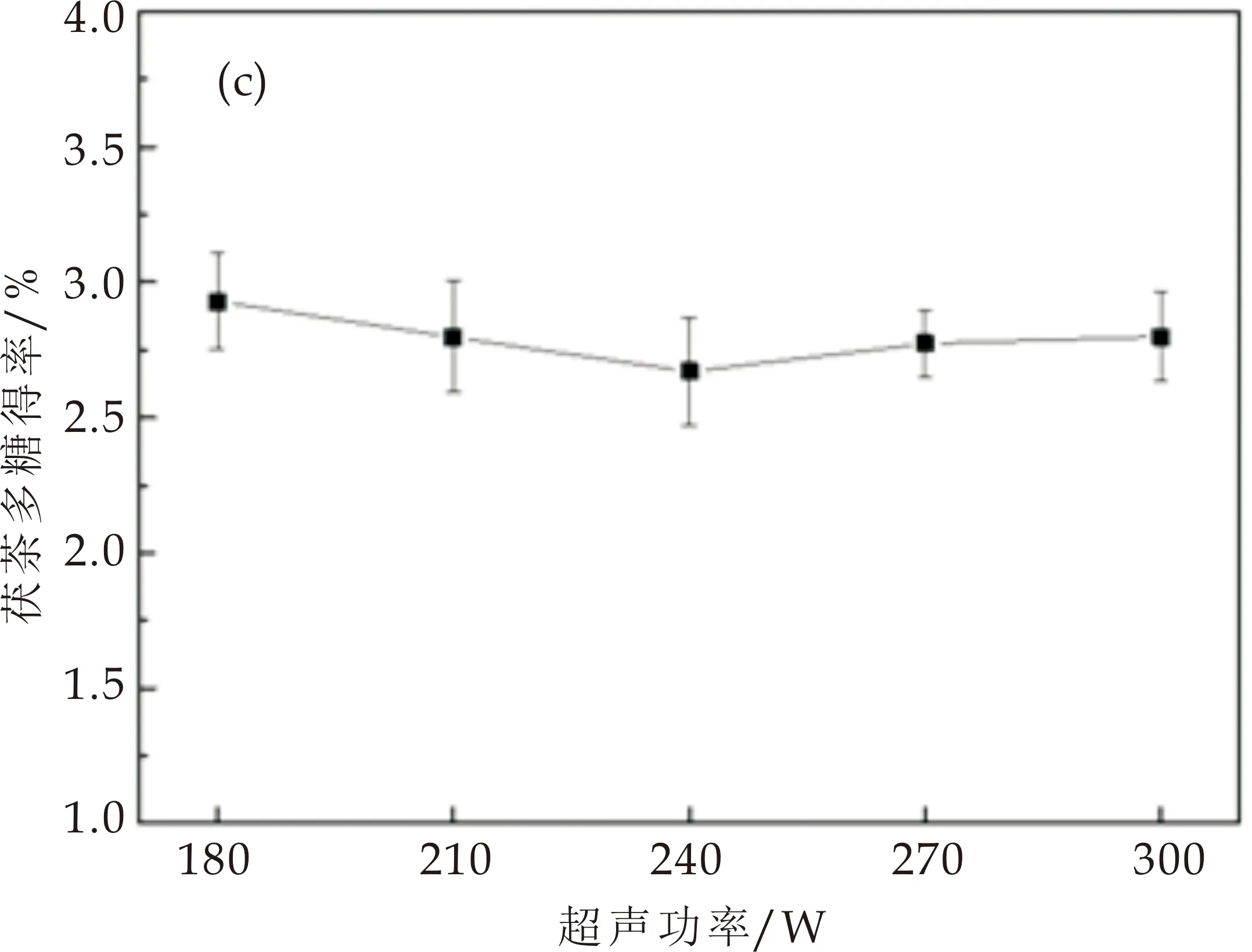
(c)超声功率对茯茶多糖得率的影响
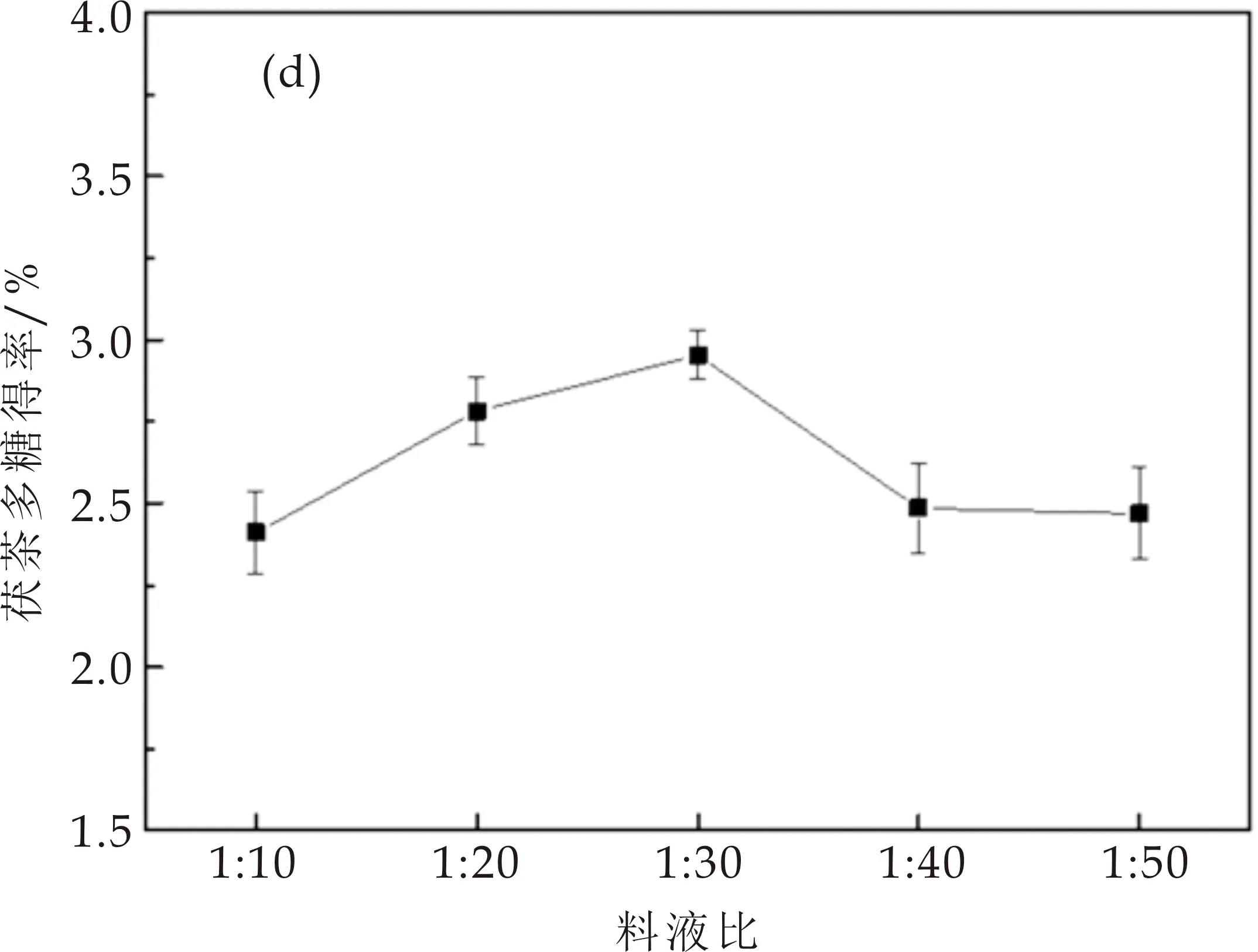
(d)料液比对茯茶多糖得率的影响图1 单因素对茯茶多糖得率的影响
2.2 响应面法优化茯茶多糖的提取工艺
2.2.1 Box-Behnken中心组合实验设计及结果
在单因素实验基础上,根据Box-Behnken中心组合实验设计原理,以浸提时间(A)、超声时间(B)、料液比(C)设计三因素三水平共17组响应面分析实验,实验方案设计如表2所示.从表2可初步看出茯茶多糖得率最高的提取方案:浸提时间为90 min,超声时间为30 min,料液比为1∶30时茯茶多糖得率最高为3.62%.
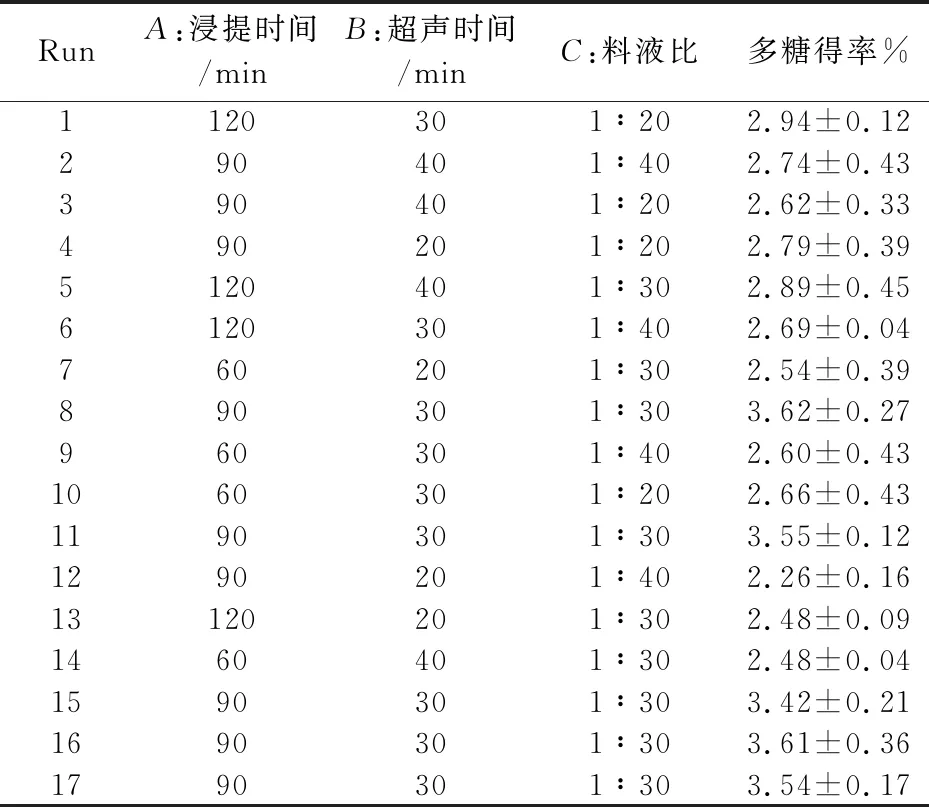
表2 Box-Behnken中心组合实验设计与结果
2.2.2 回归模型的建立及显著性分析
以茯茶多糖得率为响应值,对中心组合的实验结果进行回归分析,获得拟合的二次多项回归方程为:Y=3.57+0.09A+0.081C+0.018A-0.089B+0.12AC-0.048BC-0.43A2-0.54B2-
0.42C2.
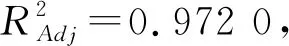
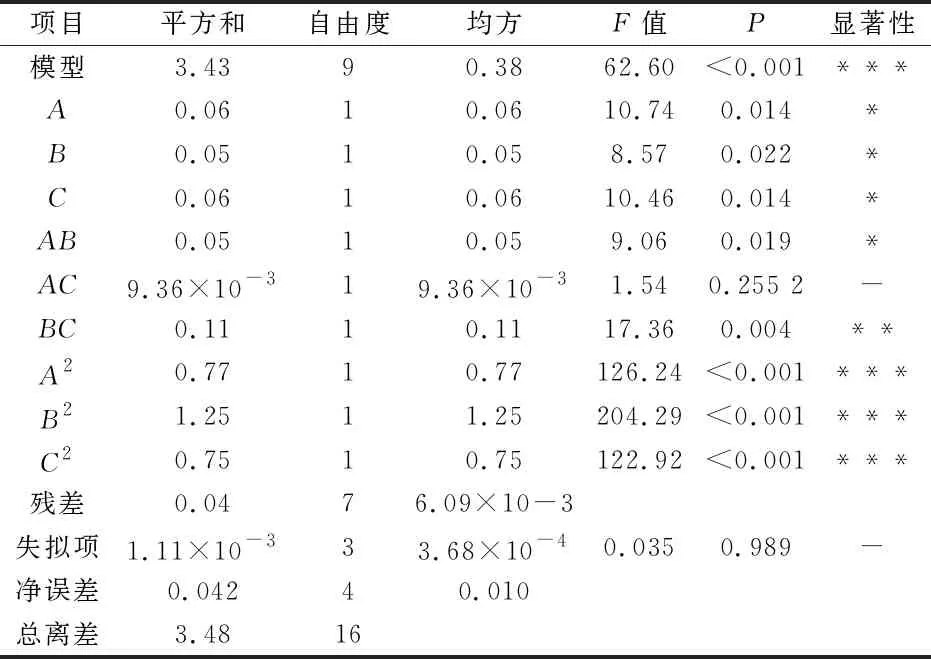
表3 回归方程方差分析
注:“***”表示差异极显著(P<0.001);“**”表示差异非常显著(P<0.01);“*”表示差异显著(P<0.05);“-”表示差异不显著.
2.2.3 响应面优化分析
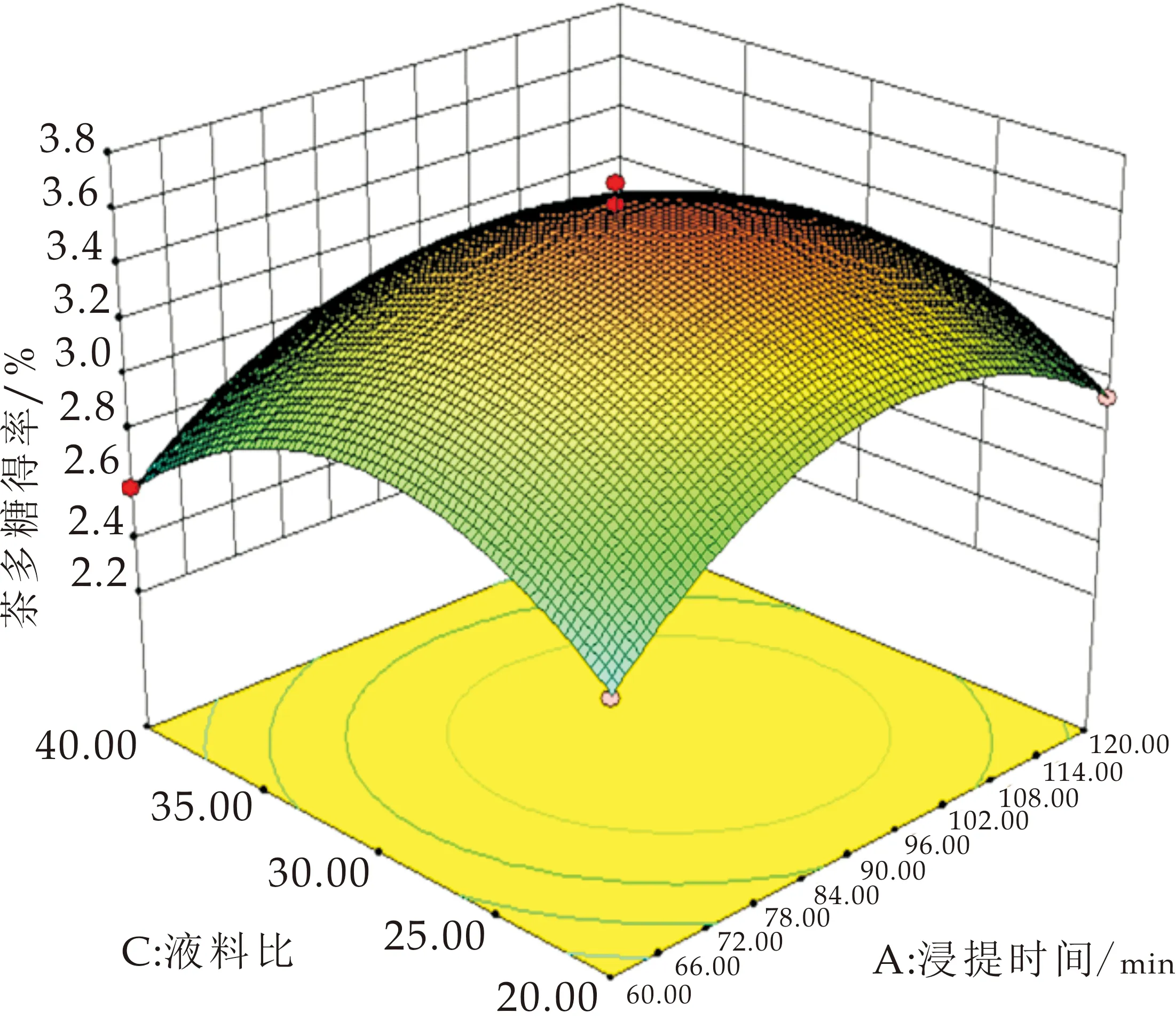
采用Design Expert8.0.6软件绘制得到响应面曲面图和等高线图,如图2所示.通过改变研究试验范围内的两个因子并将另一个因子保持在零水平来形成模型的表面响应图,以确定任何独立变量对茯茶多糖得率的影响[24].等高线图的形状为椭圆时,表示两因素相互作用显著;其形状为圆形时表示两因素相互作用不显著[14,25].浸提时间在76~112 min范围、超声时间在25~36 min范围时,有较高的多糖得率;超声时间对茯茶多糖得率的影响大于浸提时间,如图2(a)所示.响应面曲线(图2(d))坡度较陡,表明浸提时间和超声时间的交互作用对茯茶多糖得率影响显著(P<0.05).
由图2(b)可知,当料液比在1∶22.5~35、浸提时间在73.5~113 min范围内,茯茶多糖有较高的得率;浸提时间对茯茶多糖得率的影响大于液料比,如图2(b)所示.响应面曲线坡度较陡,如图2(e)所示,表明浸提时间和料液比的交互作用对茯茶多糖得率有影响,但通过方差分析浸提时间和料液比的交互作用不显著.
当超声时间在25~36.5 min、料液比在1∶23.5~30之间时,茯茶多糖有最高得率;超声时间对茯茶多糖得率的影响大于液料比(如图2(c)所示).而响应曲面的坡度较陡(如图2(f)所示),表明超声时间和料液比的相互作用对茯茶多糖得率影响较大.
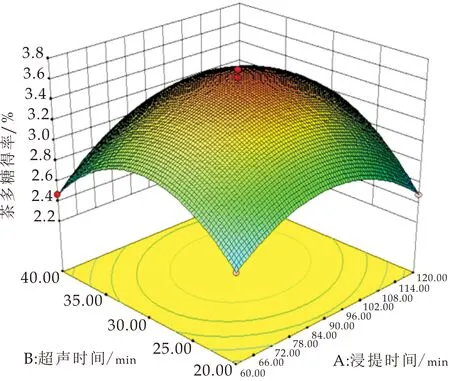
(a)超声时间与浸提时间对茯茶多糖得率影响曲面图
(b)浸提时间和料液比对茯茶多糖得率影响曲面图
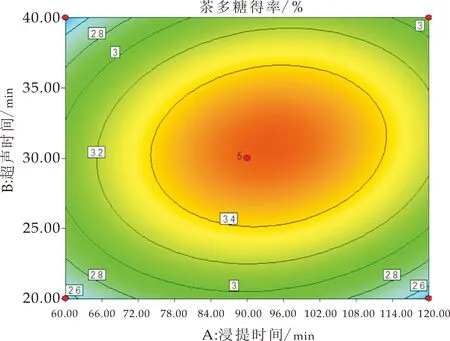
(d)超声时间与浸提时间对茯茶多糖得率影响平面分析

(f)超声时间和料液比对茯茶多糖得率影响平面分析图图2 各交互因素作用的响应面图和等高线图
2.2.4 优化提取参数和验证模型
Design Expert 8.0.6软件分析得到茯茶多糖提取的最佳工艺条件为:浸提时间93.64 min、超声时间30.72 min、料液比1∶29.02,在该条件下预测茯茶多糖提取率为3.58%.根据实际情况调整最佳提取工艺为浸提时间93 min,超声时间30 min,料液比1∶29.为了验证响应面法的可靠性,在此条件下进行两次重复性验证试验,测得茯茶多糖提取率平均值为3.62%,相对误差为1.05%,实测值与理论值之间的拟合度较好,表明利用响应面法对茯茶多糖提取工艺的优化是可行的.
2.3 茯茶多糖的益生作用
2.3.1 茯茶多糖抗氧化活性
茯茶多糖总还原力如图3(a)所示.茯茶多糖浓度与总还原力之间存在一定的量效关系,当茯茶多糖浓度为0.1 mg/mL时,其吸光值为0.17 A,为对照组Vc吸光值的24.37%.与灵芝孢子粉多糖的体外抗氧化活性相比,1.0 mg/mL灵芝孢子粉多糖的总还原力为0.47 A[26],而茯茶多糖浓度为0.6 mg/mL时,其总还原力为0.67 A,较灵芝孢子粉多糖的总还原力强.
随着浓度增加,茯茶多糖对DPPH自由基的清除力整体呈现上升趋势,如图3(b)所示.当浓度为0.3 mg/mL时达到最高值为70.03%,此浓度Vc对DPPH的清除力为92.85%.而3 mg/mL的枸杞多糖对DPPH自由基的清除率为80.41%[27],可以推测,茯茶多糖对DPPH的清除能力极可能强于枸杞多糖.
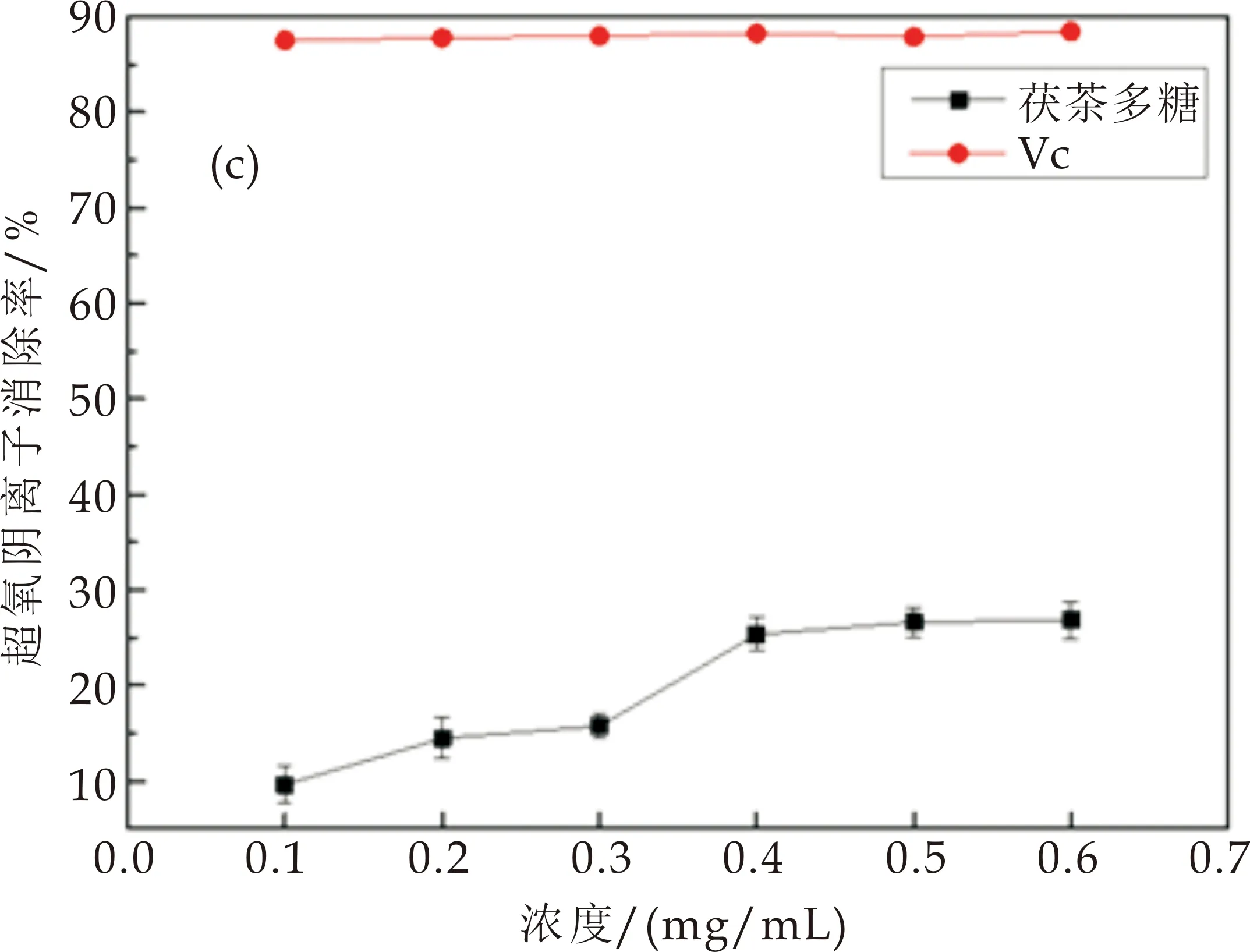
茯茶多糖对超氧阴离子的清除力随浓度增加而增加,如图3(c)所示.茯茶多糖为0.1 mg/mL时,对超氧阴离子的清除率仅为9.64%,当茯茶浓度增加至0.4 mg/mL和0.6 mg/mL时,茯茶多糖对超氧阴离子的清除率显著提高.而阳性对照Vc组对超氧阴离子的清除率在80%以上.
茯茶多糖对羟基自由基也表现出一定的清除力,如图3(d)所示.茯茶多糖浓度为0.1 mg/mL时对羟基自由基的清除率为18.66%,同浓度Vc对羟基自由基对清除率为55.75%.当茯茶多糖浓度为0.6 mg/mL时,其对羟基自由基的清除率增加至23.76%,而0.6 mg/mL灵芝孢子粉多糖对羟基自由基的清除力为56.50%,灵芝子实体多糖对羟基自由基清除力为52.26%[26].因此,浓度为0.6 mg/mL时,对羟基自由基的清除力表现为:灵芝孢子粉多糖>灵芝子实体多糖>茯茶多糖.虽然茯茶多糖对羟基自由基清除率不及灵芝孢子粉及灵芝子实体多糖,然而茯茶多以夏秋茶为原料加工,因此,研究茯茶多糖的抗氧化活性及其高附加值产品的加工,对于剩余茶叶资源的开发利用具有重要的意义.
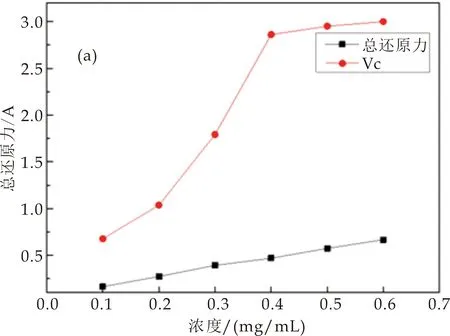
(a)茯茶多糖的总还原力
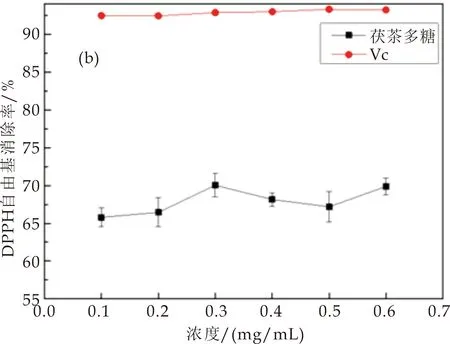
(b)茯茶多糖对DPPH自由基的清除力
(c)茯茶多糖对超氧阴离子的清除力
2.3.2 茯茶多糖对益生菌生长规律的影响
茯茶多糖的添加对凝结芽孢杆菌、戊糖片球菌、屎肠球菌表现出抑制作用.如图4(a)所示,茯茶多糖的添加对凝结芽孢杆菌的菌量生长整体表现出一定的抑制作用,且随着培养基中茯茶多糖浓度增加,对菌量生长的抑制作用有一定的增加趋势.戊糖片球菌也受到抑制作用.
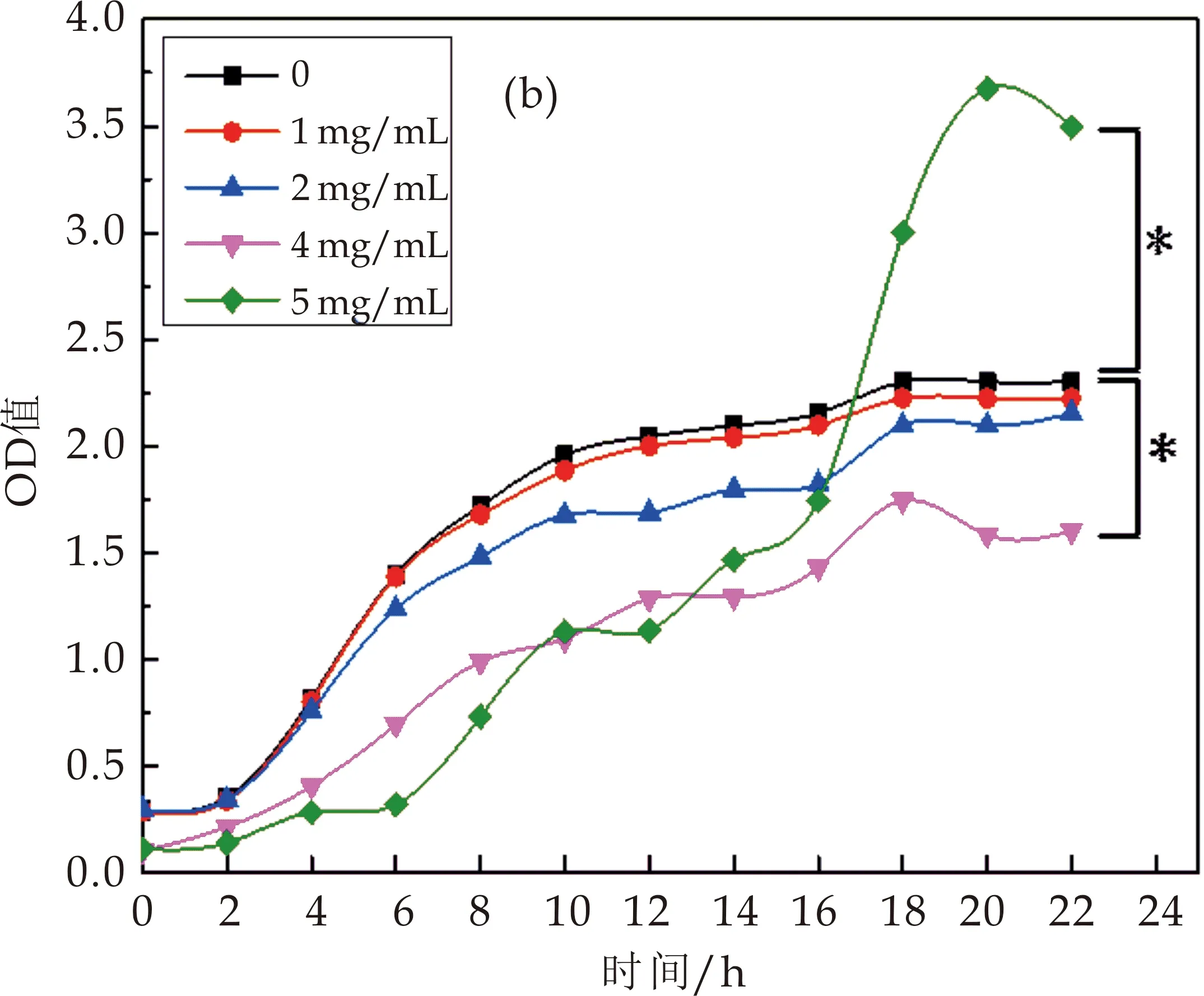
如图4(b)所示,在茯茶多糖浓度分别为1 mg/mL、2 mg/mL和4 mg/mL时,对戊糖片球菌的生长有抑制作用.5 mg/mL的茯茶多糖对戊糖片球菌前期菌量生长有显著抑制作用(P<0.05),而在菌体生长16 h后,显著促进戊糖片球菌菌量的增加(P<0.05).
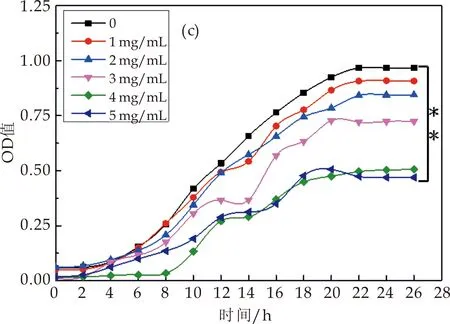
茯茶多糖在对屎肠球菌的生长具有较明显的抑制作用(如图4(c)所示),且5 mg/mL茯茶多糖对屎肠球菌的生长抑制非常显著(P<0.01).茯茶多糖对乳酸乳球菌生长的影响随浓度变化差异较大,如图4(d)所示.茯茶多糖浓度为0.5 mg/mL、1 mg/mL、2 mg/mL时,菌体生长量与对照组基本相似.3 mg/mL茯茶多糖较显著抑制乳酸乳球菌菌量的生长(P<0.05);而随茯茶多糖浓度增加至5 mg/mL时,对菌量生长有显著促进作用(P<0.05).
多糖类物质对益生菌的生长并没有明确的浓度和效应关系.猴头菇多糖对益生菌的生长有显著促进作用,7 mg/mL的猴头菇多糖显著促进保加利亚乳杆菌和青春双歧杆菌的生长[28],而4 mg/mL牛蒡菊糖对双歧杆菌却产生抑制作用[29].本研究中茯茶多糖对益生菌生长的影响作用并不是随着浓度的升高而增加,与白术多糖对双歧杆菌的生长的影响相似:刘丽莎等[30]发现白术多糖对双歧杆菌的生长作用并不是浓度越高对双歧杆菌促进生长越明显.茯茶多糖对戊糖片球菌(P.pentosaceus)、凝结芽孢杆菌(B.coagulans)以及屎肠球菌(E.faecium)的生长整体表现出抑制作用.这与白术多糖对双歧杆菌的生长作用相似,白术多糖浓度超过2 mg/mL时,对B.infanits,B.adolescentis和B.animalis的生长促进作用逐呈现下降趋势[30].此外,白术多糖对B.lottgum和B.bifidum的生长促进作用不显著[30].而0~2 mg/mL的白术多糖较明显促进B.infanits,B.adolescentis和B.animalis三种益生菌的生长.
(b)不同浓度的茯茶多糖对戊糖片球菌生长的影响
(c)不同浓度的茯茶多糖对屎肠球菌生长的影响

(d)不同浓度的茯茶多糖对乳酸乳球菌生长的影响图4 茯茶多糖对益生菌生长规律的影响(**表示P<0.01,*表示P<0.05)
3 结论
本研究获得茯茶多糖最佳提取工艺为:浸提时间90 min、超声时间30 min、料液比1∶30、超声功率180 W,在该条件下,茯茶多糖得率为3.69%.通过测定茯茶多糖的总还原力、DPPH自由基、超氧阴离子和羟基自由基的清除能力,表明茯茶多糖具有较好的抗氧化作用.茯茶多糖在体外对戊糖片球菌(P.pentosaceus)、凝结芽孢杆菌(B.coagulans)以及屎肠球菌(E.faecium)的生长具有一定抑制作用,浓度为3 mg/mL的茯茶多糖对乳酸乳球菌表现出抑制作用,而浓度为5 mg/mL时对菌量体生长具有明显促进作用.
