一例热射病合并多器官功能障碍综合征患者的营养支持方案分析
2020-01-06张云琛陈志民戴成家甘惠贞王佳坤
费 燕,张云琛,陈志民,戴成家,甘惠贞,王佳坤*
(1.联勤保障部队第九○九医院/厦门大学附属东南医院药学科,福建漳州 363000;2.联勤保障部队第九一○医院药学科,福建泉州 362000)
热射病(heat stroke)即重症中暑,是由于人体暴露在高温、高湿环境中导致机体核心温度迅速升高至40 ℃以上,伴有皮肤灼热、意识障碍(如谵妄、惊厥、昏迷)等多器官系统损伤的严重临床综合征[1]。热射病在平时比较罕见,但部队官兵在高温、高湿环境下进行体能训练演习时发病率升高,严重时合并多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS),病死率高达10%~50%[2]。目前热射病有效治疗的关键措施,一是迅速降低患者的核心温度,二是血液净化,三是防止弥散性血管内凝血(disseminated intravascular coagulation,DIC)的发生[1],但有关热射病患者营养支持治疗的报道较少见。本文介绍临床药师参与的1例热射病患者治疗过程中营养支持方案的制定,以期为临床医师及药师治疗类似病例提供参考。
1 病例资料
患者,男,19岁,身高175 cm,体质量65 kg,入院前5 h在部队组织的体能训练过程中出现意识不清,伴有抽搐、高热、呼吸急促、大便失禁,曾于当地卫生院就诊,测量体温高达41 ℃,予以补液、降温等对症治疗。为进一步治疗,转送联勤保障部队第九O九医院。入院查体:体温38.6 ℃,心率106次/min,血压117/61 mm Hg(1 mmHg=0.133 kPa),呼吸50次/min,高流量吸氧状态下的血氧饱和度(SaO2)为98%。双侧瞳孔等大等圆,直径约为3 mm,对光反射迟钝,肠鸣音弱。辅助检查:血常规示白细胞计数14.02×109/L,红细胞计数4.76×1012/L,血红蛋白(HGB) 149 g/L,血小板计数275×109/L。CT示:(1)右侧裂池较左侧变浅,建议进一步检查;(2)CT胸部平扫未见明显异常。临床诊断:(1)热射病;(2)急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS);(3)急性心肌损伤;(4)急性肾功能损伤;(5)急性肝功能损伤;(6)高钾血症;(7)凝血功能障碍。
2 治疗经过
入院后给予降温、呼吸机辅助、连续性肾脏替代治疗(continuous renal replacement therapy,CRRT)、促醒、脱水、抗凝等治疗。入院第2天(d 2),经液体复苏,予丙泊酚1.0 mg·kg-1·h-1镇静,多巴胺3 μg·kg-1·min-1维持下,患者生命体征平稳,开始给予肠外营养支持。d 3患者血流动力学逐步稳定,考虑到肠外营养支持后其肝功能指标、凝血功能指标有所升高,药师建议停用肠外营养,尝试给予肠内营养。d 4,停用血管活性药物,给予肠内营养后患者无明显不适。d 6,停止呼吸机辅助治疗,停止CRRT治疗,尝试给予患者流质饮食。d 9,患者神志清楚,精神稍差,言语清晰,对答切题,尝试改为半流质饮食。d 23,患者病情稳定,脏器功能恢复良好,准予其出院。患者住院期间的重要临床信息及治疗时间轴见图1,肝肾功能和凝血功能变化见表1。
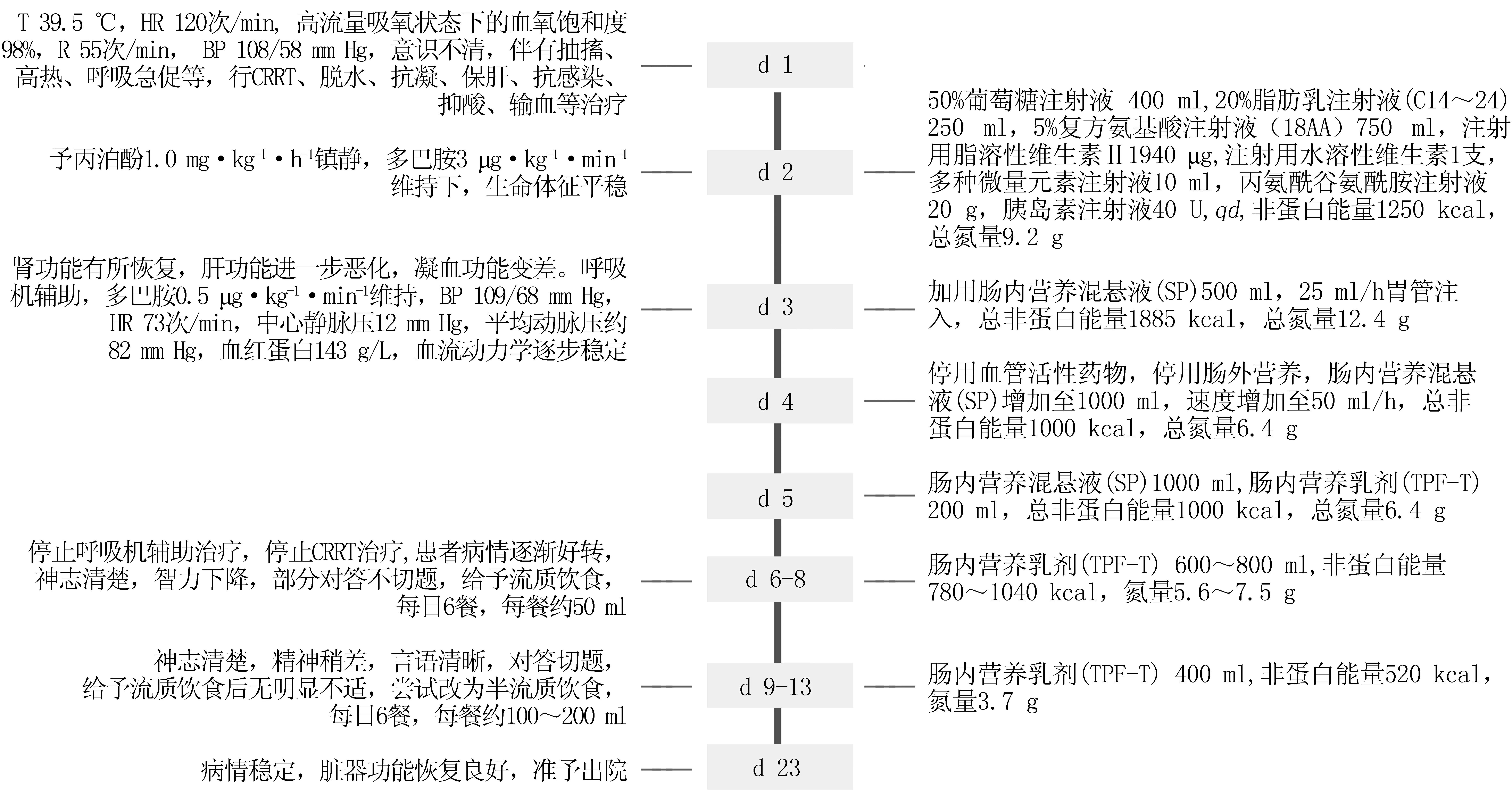
图1 患者住院期间的重要临床信息和治疗时间轴Figure 1 The important clinical information and treatment-time axis of the patient during hospitalizationT:体温;HR:心率;R:呼吸;BP:血压;CRRT:连续性肾脏替代治疗
3 分析和讨论
3.1 营养支持指征及肠外营养时机 采用欧洲肠外肠内营养学会(European Society for Parenteral and Enteral Nutrition,ESPEN)推荐用于临床的营养风险筛查工具(NRS-2002)对该患者进行营养风险筛查,NRS-2002评分为3分,提示存在营养不良的风险,具有营养支持指征。患者经早期液体复苏后,血流动力学不稳定,存在肠内营养(enteral nutrition)禁忌证,营养支持宜采用肠外营养(parenteral nutrition)。关于危重症患者开始肠外营养的时机,指南指出[3],早期营养支持有助于改善危重症患者的临床结局,在生命体征稳定的条件下,危重症患者的营养支持可在入ICU后1~3 d即开始。ESPEN推荐,肠内营养摄入不足的危重症患者,入住ICU后2 d就可以考虑开始联用肠外营养[4]。医师基于上述指南,考虑到患者需要较长时间的住院治疗,早期给予肠外营养可能有助于改善临床结局,因此在入院d 2患者生命体征平稳后,就开始给予肠外营养。药师则密切监测肠外营养对患者的影响。
3.2 MODS对营养支持的影响 患者存在MODS,表现为急性肾损伤(acute kidney injury)、急性呼吸窘迫综合征(ARDS)、急性肝功能损害、凝血功能障碍等。在制定营养支持方案时,需要尽量兼顾各个器官的功能状况,对营养物质的选择不同于单器官功能障碍的患者。
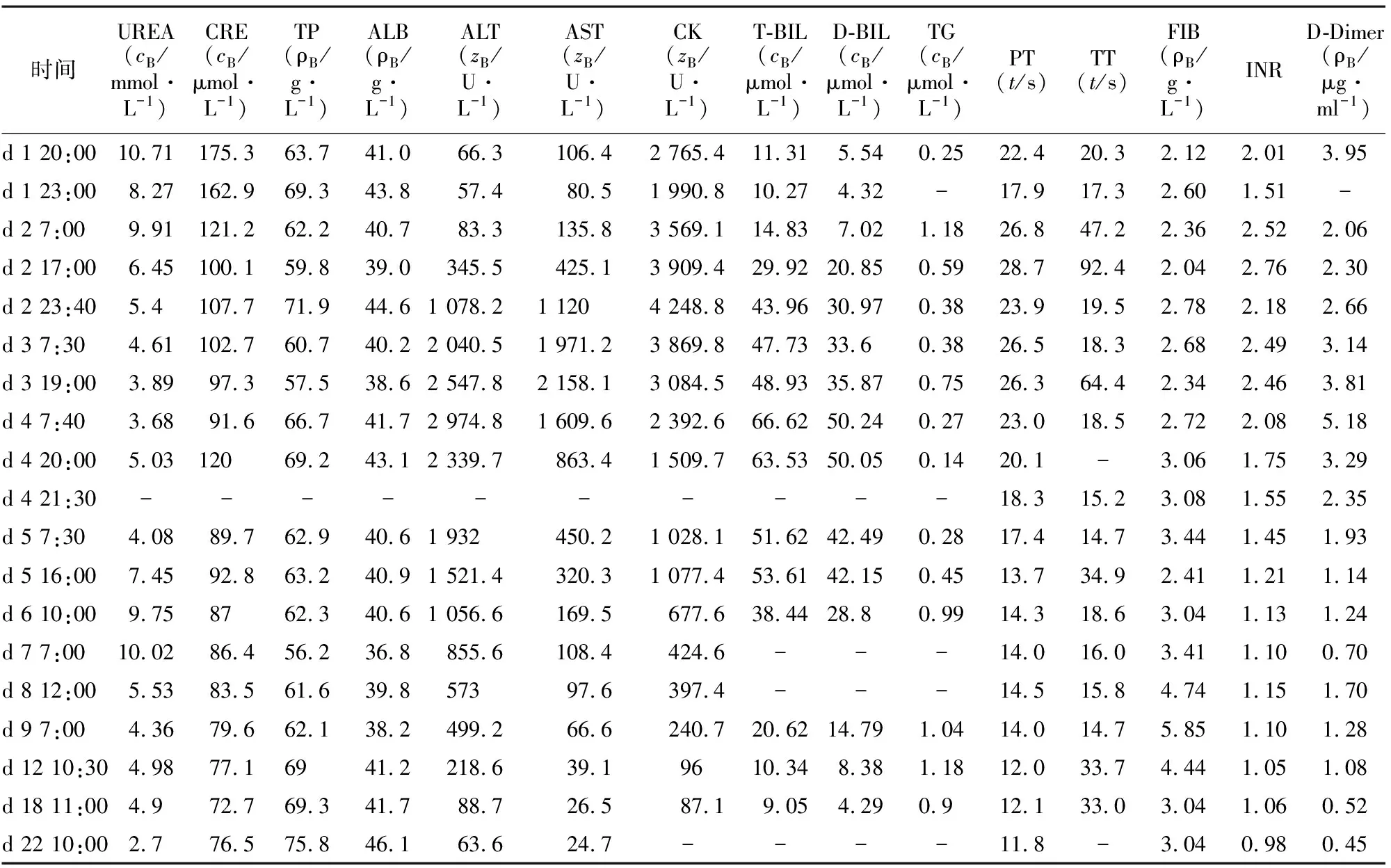
表1 患者住院期间的肝肾功能和凝血功能变化Table 1 Changes in liver and kidney function and blood coagulation of the patient during hospitalization
UREA:尿素;CRE:肌酐;TP:总蛋白;ALB:白蛋白;ALT:丙氨酸氨基转移酶;AST:天冬氨酸氨基转移酶;CK:肌酸激酶;T-BIL:总胆红素;D-BIL:直接胆红素;TG:三酰甘油;PT:凝血酶原时间;TT:凝血酶时间;FIB:纤维蛋白原;INR:国际标准化比值;D-Dimer:D-二聚体
3.2.1 急性肾损伤对营养支持的影响 患者有急性肾损伤症状,入院后即行CRRT治疗。指南指出[3],急性肾损伤并接受CRRT治疗的患者,由于CRRT的持续状态和高过滤速度,可能会对电解质和营养素平衡造成不良影响,如蛋白质的丢失量可达10 g/d,水溶性维生素和微量元素的丢失增加,促使电解质紊乱,导致低磷血症、低镁血症和/或低钠血症的发生。
3.2.2 ARDS对营养支持的影响 患者有ARDS症状,需要接受机械通气治疗。在机械通气时,患者通常无法达到热量需求,需要接受营养支持[5]。肠外营养支持时,应该注意合理安排糖类、脂肪和蛋白质的比例,糖类提供热量占50%~60%为宜,脂肪提供约50%的非蛋白质热量,有助于减少CO2的产生,对每分钟通气量和呼吸熵的影响也较小[6]。
3.2.3 肝功能损害对营养支持的影响 患者伴有急性肝功能损害,原则上应尽可能予以肠内营养,而不是肠外营养[5]。合并肝功能不全的重症患者,营养支持时应增加支链氨基酸(branched-chain amino acid)的供给,降低芳香族氨基酸的比例,非蛋白能量以糖脂双能源供给为主,其中脂肪补充宜选用中长链脂肪乳剂[7]。
3.3 肠外营养支持方案分析
3.3.1 氨基酸制剂的使用 (1)制剂的选择:该患者合并MODS,特别是同时合并急性肝损伤、急性肾损伤,并接受CRRT,选用氨基酸制剂时需综合考虑。该患者早期使用肝病适用型氨基酸,更有利于纠正氨基酸比例的失衡,减少肌肉蛋白质分解,减轻肝脏的负担。因此,综合考虑上述因素后,药师建议使用复方氨基酸注射液(20AA),增加支链氨基酸的用量,并同时兼顾营养补充;后期待患者肝功能恢复后再改为平衡型氨基酸。医师考虑肠外营养为短期过渡使用,故未做更改。(2)谷氨酰胺的补充:谷氨酰胺被称为组织特殊营养素,在创伤、感染等应激状态下,血浆谷氨酰胺水平降至正常的50%~60%,肌肉谷氨酰胺水平降至正常的25%~40%,机体对谷氨酰胺的需求量明显增加。指南指出,添加谷氨酰胺的肠外营养能够明显降低重症患者的病死率,减少住院费用[3]。该患者的胃肠道功能受损,依照国内指南推荐给予丙氨酰谷氨酰胺0.3~0.6 g·kg-1·d-1,结合本院制剂品规,给予丙氨酰谷氨酰胺注射液20 g,它在一定程度上可以作为肠道黏膜保护剂,为早日给予肠内营养创造条件。(3)用法用量:该患者接受CRRT治疗,由于CRRT的持续状态和高过滤速度,蛋白质的丢失量可达10 g/d;给予营养支持时,蛋白质的需要量为1.0~1.5 g·kg-1·d-1,最多可达2.5 g·kg-1·d-1;患者体质量约65 kg,蛋白质摄入量应为65~97.5 g;组方中蛋白质量约为57.5 g,非蛋白质热氮比为155 kcal∶1 g氮。药师建议,若病情需要继续肠外营养支持,建议增加5%复方氨基酸注射液(18AA)250 ml或改用10%复方氨基酸注射液(20AA)500 ml,增加蛋白质补充量,降低热氮比,MODS患者的热氮比可进一步降低至80~130 kcal∶1 g氮。
3.3.2 脂肪乳剂的使用 (1)制剂的选择:针对该患者选用脂肪乳剂时,主要考虑脂肪乳剂对ARDS、急性肝功能损害和凝血功能的影响。美国肠外肠内营养学会(American Society for Parenteral and Enteral Nutrition,ASPEN)推荐[8],在患者入住ICU的第1周,如果无法实施肠内营养而需行静脉营养时,配方中不应含有大豆油(长链脂肪乳)。ASPEN有研究表明[9-10],肠外营养使用鱼油脂肪乳或肠内营养加用鱼油脂肪乳的危重症患者,住院时间缩短,感染率更低,机械通气时间和病死率有降低趋势。结合上述分析,药师建议该患者的脂肪补充初始方案选用中长链脂肪乳剂,同时加用鱼油脂肪乳。(2)脂肪乳剂的用量:该患者接受CRRT治疗,脂肪乳剂不能通过滤膜,没有明显丢失,但患者同时伴有ARDS、肝脏功能不全和凝血功能不全,脂肪的摄入宜控制在0.5~1.0 g·kg-1·d-1。组方中脂肪50 g,加上丙泊酚中脂肪15 g,脂肪用量共约65 g,约1.0 g·kg-1·d-1,提供约42%的非蛋白质热量。脂肪乳剂的使用可以为患者提供足够的能量摄入,然而患者伴有凝血功能异常、休克、肝功能损伤,虽然逐步得到纠正,但从病情变化看,肝功能、凝血功能检验指标有所升高。因此,脂肪乳剂的使用是否对患者产生影响,使用时机是否过早,使用剂量是否过大,仍有待商榷。
3.3.3 葡萄糖的使用 患者伴有ARDS,接受机械通气治疗,肠外营养中为控制每分钟呼气量和呼吸熵,糖类提供热量占50%~60%为宜;同时,患者伴有急性肝损伤,为预防和治疗低血糖,肠外营养保证葡萄糖2 g·kg-1·d-1的供给是必需的[5]。一般情况下,葡萄糖的输入量应当控制在≤200 g/d[7],患者早期肠外营养中给予葡萄糖200 g,符合上述要求。患者接受CRRT治疗,置换液中葡萄糖浓度为10.6 mmol/L,含糖浓度符合生理特点,这种透析液不提供糖能量,可以更好地控制血糖,故在营养支持时给予胰岛素调节血糖,不需要考虑透析液中的含糖量,但需要注意该类透析液可以引起4%的净糖量丢失[6]。
3.3.4 维生素的使用 《维生素制剂临床应用专家共识》指出[11],危重症患者普遍缺乏B族维生素和维生素D;同时,患者接受CRRT治疗,可导致水溶性维生素和微量元素的丢失增加,而对脂溶性维生素影响不大;因此,药师建议肠外营养组方中水溶性维生素可以增加至2倍常用剂量,脂溶性维生素补充正常剂量即可。
3.3.5 多种微量元素的使用 《欧洲临床营养基础》指出[5],高代谢的危重症患者对微量元素的需求量增加,同时,患者接受CRRT治疗也会导致微量元素的丢失增加。因此,肠外营养组方中应补充微量元素,但关于微量元素的补充剂量尚有争议,药师建议给予补充多种微量元素注射液10 ml,以满足日常需要。
3.3.6 水和电解质 肠外营养组方中不含电解质,行CRRT治疗期间,应每日监测电解质含量,根据监测结果和CRRT置换液的性质及容量,及时调整,维持水和电解质平衡。该患者住院治疗期间的水和电解质基本正常。
3.4 肠外营养向肠内营养过渡时机 对于危重症患者,积极尝试肠内营养支持的目的在于维护肠黏膜屏障功能,防止肠道菌群异位,导致感染加重,而非提供充足的热量供应。研究发现[12],如果有20%的营养通过胃肠道获取,就能在一定程度上保护肠黏膜的屏障功能。《维生素制剂临床应用专家共识》指出,如果患者的血流动力学及内环境稳定,且无消化道出血和麻痹性肠梗阻,应尽早给予肠内营养[1]。入院d 3,患者经过CRRT、抗凝、营养支持等治疗后,血流动力学及内环境稳定,查体肠鸣音弱。同时,肠外营养治疗期间,患者的肝功能和凝血功能检验指标有所升高。因此,药师建议对该患者停用肠外营养,在密切监测血流动力学变化和胃肠道功能的情况下,从小剂量肠内营养开始尝试,选择经泵连续性输注的喂养方式,以低速(10~30 ml/h)方式开始肠内营养治疗。医师采纳了临床药师的建议,肠内营养时机把握合理。
3.5 肠内营养支持方案分析
3.5.1 制剂的选择 对于胃肠道功能障碍者,选择肠内营养制剂时需先从短肽制剂逐渐过渡到整蛋白型匀浆膳[1]。因此,药师建议早期尝试肠内营养时给予预消化短肽型制剂肠内营养混悬液(SP),不含膳食纤维,有助于患者胃肠道功能恢复,增强肠内营养耐受性。该患者整蛋白型肠内营养制剂选择肠内营养乳剂(TPF-T),能量密度为1.3 kcal/ml,有助于控制液体量。TPF-T中还含有ω-3鱼油脂肪酸以及维生素A、维生素C、维生素E,能够促进免疫功能,增强机体抵抗力,有助于危重症患者病情改善;另含有膳食纤维,有助于维持胃肠道功能。
3.5.2 肠内营养剂的用法用量 患者入院后d 3,医师采纳药师建议,开始给予肠内营养,肠外营养向肠内营养过渡期间,肠内营养遵循由少到多的原则,逐步增加给药剂量(见图1)。首选尝试给予肠内营养混悬液(SP) 500 ml,25 ml/h胃管注入,患者无明显不适。之后,改为1000 ml肠内营养混悬液,50 ml/h胃管注入,同时停用肠外营养。肠内营养混悬液的能量密度为1 kal/ml,肠内营养摄入量达到1000 kal,能量供给达到维持胃肠道功能并保护肠黏膜屏障的目的,也符合危重症患者适度营养支持的理念。后期,肠内营养逐步过渡为肠内营养乳剂,用量为400~800 ml,能量密度为1.3 kcal/ml,提供能量约为520~1040 kcal,加上流质饮食或半流质饮食摄入量,能量摄入基本满足患者所需。
3.6 药学监护要点
3.6.1 血糖的有效监控 多数危重症患者伴有高血糖,但是许多患者既往并无糖尿病史,多数为创伤应激所致。临床研究发现,危重症患者的应激性高血糖会影响临床预后,增加感染性并发症的发病率和死亡率[6]。目前的主流观点认为,应当控制ICU患者的血糖水平,国内一般采用中华医学会糖尿病学分会推荐的标准,将血糖控制在7.8~10 mmol/L[13]。该患者合并MODS,进行CRRT时需要严格控制血糖。目前CRRT常用的置换液均为含糖配方,该患者使用的置换基础液中葡萄糖浓度为10.6 mmol/L,略高于正常血糖水平,不至于引起患者血糖明显升高[6]。但是当患者血糖浓度高于置换液中葡萄糖浓度时,不仅会增加感染并发症的概率,还会导致葡萄糖和热量的丢失。因此,药师建议对患者加强血糖监控,采用胰岛素泵入控制血糖,在治疗初期,每小时监测血糖1次,待血糖控制较平稳后,每隔4~6 h监测1次,并根据监测值调整胰岛素的用量。该患者住院期间的血糖控制理想。
3.6.2 肠外营养监护要点 该患者合并MODS,给予肠外营养时,需严格控制输注速度,葡萄糖最大输注速率不超过4 mg·kg-1·min-1。该患者体质量65 kg,其输注时间应不<13 h。该患者伴有凝血功能障碍,使用脂肪乳剂时,需每天监测凝血功能变化情况。凝血功能进一步恶化或有出血倾向时,应及时停用脂肪乳剂。同时,患者还伴有肝肾功能损伤,需每天监测肝肾功能及脂肪廓清能力,当三酰甘油>3 mmol/L时,需停止使用脂肪乳剂。患者住院期间的脂肪廓清能力良好,三酰甘油均<1.5 mmol/L。
3.6.3 肠内营养监护要点 该患者早期接受肠内营养时,神志昏迷,药师提醒护士使用肠内营养药物的注意事项,并加强药学监护。(1)该患者神志昏迷,应严格控制肠内营养起始速率,从25~50 ml/h开始,根据耐受情况,以后每12~24 h增加25 ml/h,最大速率为120 ml/h。(2)为减少误吸风险,管饲肠内营养期间,床头需抬高至少30°,取半卧位,防止反流,输注完毕后仍需维持此体位30 min。(3)每4 h要抽吸胃残留液,注意观察其颜色和性状,减少误吸的风险,必要时给予消化道促动力药,如多潘立酮或甲氧氯普胺,促进胃排空。(4)管饲肠内营养期间每4 h及管饲结束后均用>20 ml温水冲管。(5)肠内营养剂给药时应遵循浓度由低到高、容量由少到多,速率由慢到快的原则,并注意保持温度37 ℃左右。
3.7 营养支持疗效评价 ASPEN指南指出[8],传统的通过检测白蛋白、前白蛋白、体质量的营养评估方法不适用于危重症患者。该患者入院前身体条件良好,无基础疾病,营养状况正常,住院期间由于液体复苏、输血治疗、肝肾功能损伤、感染等情况,白蛋白和前白蛋白水平不能真正反映患者的营养状况。住院期间通过给予营养支持12 d,同时采取综合治疗措施,患者的肝肾功能逐步恢复正常,营养支持期间血糖控制平稳,电解质水平基本处于正常范围,无明显相关并发症,胃肠道功能恢复良好,顺利过渡到半流质,出院时白蛋白水平为46.1 g/L,营养支持效果良好。
4 小 结
综上所述,对于热射病患者,营养支持首选肠内营养,但早期血流动力学不稳定,肠道功能未恢复前可考虑给予肠外营养。在营养支持过程中,应根据患者的病理生理状况,调整药物治疗方案,合并MODS时,应综合考虑各脏器功能对营养素的影响。密切监控液体出入量、电解质及血糖等相关指标,及时调整营养素的使用。当患者血流动力学稳定后,可早期尝试给予肠内营养,根据患者的病理生理特点,选择合适的肠内营养剂。该患者的治疗经过提示临床医师和药师,对于热射病患者,在规范治疗方案的基础上,给予合理的营养支持及有效的药学服务,可使患者最终获益。
