印楝幼苗对不同水分和光照条件的生理生态学响应
2020-01-04孙恒张燕平王友琼吴疆翀彭兴民郑益兴
孙恒 张燕平 王友琼 吴疆翀 彭兴民 郑益兴

摘 要:為了揭示印楝幼苗生长及代谢对不同水分和光照条件的响应规律,以0.5年生印楝半同胞家系实生苗为材料,设置4个水分水平(分别占田间持水量的60%~65%、40%~45%、30%~35%和20%~25%)与3个光照水平(分别是自然光照的100%、75%和50%)共12个组合的盆栽试验,分析不同水分及光照条件下生长指标、形态指标、生理指标及印楝素含量的变化情况。结果表明,自然光照、田间持水量为60%~65%的条件更有利于印楝幼苗的生长,干旱胁迫和遮光对印楝苗高、地径、生物量以及叶片发育均会产生抑制作用,且遮光的抑制程度明显大于干旱;在干旱胁迫条件下,印楝可通过大量合成可溶性蛋白质、游离脯氨酸及可溶性糖等初生代谢产物以及增加根茎比来提高植株干旱适应能力;在遮光条件下,印楝主要初生代谢产物可溶性蛋白质、可溶性糖、游离脯氨酸的合成受阻,其次生代谢产物印楝素的积累减少;在重度干旱胁迫条件下,遮光在一定程度上可以缓解干旱对印楝幼苗生长带来的不利影响;干旱和遮光的交互作用遵循“促进理论”,不支持“独立影响理论”。研究表明,印楝幼苗在生长过程中表现出较大的干旱适应范围及较强的光照依赖性。因此,在幼苗培育过程中要尽可能提供最大光照强度。此外,充足光照条件下适当干旱胁迫有利于印楝初生代谢产物与次生代谢产物的积累,这可作为生产上提高印楝素含量的一个潜在措施。
关键词:印楝;遮光;干旱胁迫;生长;印楝素
中图分类号:S792.23 文献标识码:A
Ecophysiological Responses of Azadirachta indica Seedlings to Different Water and Light Conditions
SUN Heng1,2, ZHANG Yanping 1, WANG Youqiong1, WU Jiangchong1, PENG Xingmin1, ZHENG Yixing1*
1. The Research Institute of Resources Insects, Chinese Academy of Forestry, Kunming, Yunnan 650224, China; 2. Nanjing Forestry University, Nanjing, Jiangsu 210037, China
Abstract: In order to reveal the response of Azadirachta indica seedling growth and metabolism to dif-ferent water and light conditions, a greenhouse pot experiment covering twelve combinations with four water levels (60%–65%,40%–45%,30%–35% and 20%–25% of field capacity, respectively) and three light levels (100%, 75% and 50% of full sunlight, respectively) was set up to analyze the indicators of growth, pattern, physiological and the content of azadirachtin. The results showed that natural light and field capacity of 60%–65% were more favorable for the growth of A. indica seedlings while the height, diameter, biomass and the growth of leaves of A. indica seedlings were inhibited by drought stress and shading, and the inhibition degree of shading was significantly higher than that of drought. Under drought stress conditions. A. indica could improve drought adaptability by increasing the root--stem ratio and synthesizing a large number of primary metabolites, such as soluble proteins, free proline and soluble sugars and so on. Under shading conditions, the synthesis of soluble protein, free proline and soluble sugar were blocked; meanwhile, the content of azadirachtin was reduced. Under severe drought stress, shading could alleviate the negative effects of drought on the growth of A. indica, which followed the above-ground facilitation hypothesis and didnt support the independent influence theory. It was concluded that A. indica had a wide range of drought adaptation and strong dependence of light in the growth stage of seeding; therefore, the maximum intensity of the light should be provided during seeding breeding. In addition, proper drought stress under sufficient light conditions was beneficial to the accumulation of primary and secondary metabolites in A. indica, which could be a potential measure to increase the content of azadirachtin in production.
Keywords: Azadirachta indica; shading; drought stress; growth; azadirachtin
DOI: 10.3969/j.issn.1000-2561.2020.11.014
水分与光照是生态系统中最基本的元素,是影响植物生长代谢的重要环境因子[1]。近年来,已有研究报道水分和光照对植物的影响[2],但有关二者交互作用及对植物的影响方面的文章却罕见报道,且结果也未曾统一[3]。目前最为典型的假说主要有“促进理论”假说[4],其认为遮阴会减轻干旱给植物带来的不利影响;与之相反的则是“平衡理论”假说[5];“相互作用理论”假说则认为[6]适度遮阴可缓解干旱给植物带来的负面影响,而强光和重度遮阴则会加重负面影响;而“独立影响理论”[7]则认为水分和光照是两个独立的因子,对植物不会产生交互作用。
印楝(Azadirachta indica A. Juss)广泛分布于印度、缅甸及南亚、东南亚等地区,是一种喜温耐旱、适生于干热河谷地区的生态和经济树种。印楝种子、枝叶和树皮一直被广泛用于医药、农药及日化产品等领域,被人们认为是可解决全球问题的一个树种[8]。20世纪中期,印楝作为农药植物受到世界各国青睐,已被引种栽培到70多个国家和地区[9]。我国于20世纪80年代初开始陆续引种到广东、四川、云南等地,并体现出一定的应用价值,尤其在我国干热河谷生态治理中发挥着关键作用。印楝在我国虽说已有20多年的栽培应用历史,但在基础研究方面仍然较为薄弱,国内对印楝的研究主要集中在引种栽培、良种选育、产品开发和应用等方面[10-12],关于环境与生长及代谢方面的基础性研究仍然较少[13-15],而水分和光照交互作用对印楝生长和代谢影响方面的研究还未见报道。为了揭示印楝生长及代谢对不同水分和光照条件的响应情况,本研究以盆栽0.5年生印楝半同胞家系实生苗为试验材料,分析不同水分和光照条件下幼苗生长指标及生理指标的变化情况,为印楝生长及物质代谢等生理生态学方面的研究充实理论基础,同时为印楝的幼苗管护和人工林的经营提供参考。
1 材料與方法
1.1 材料
试验材料为0.5年生印楝半同胞家系实生苗。试验前选择生长健壮的幼苗进行盆栽,盆栽容器为塑料盆,规格为上口径30 cm,下口径20 cm,高30 cm。盆栽基质为红心土与泥炭土的混合土壤,二者体积比为2∶1,每盆装育苗基质9 kg,移栽幼苗2株。幼苗移栽后进行正常水肥管理,35 d后选取生长均匀一致(苗高22~27 cm、地径3.0~3.3 mm、叶片数7~9个、无病虫害、无分枝)的盆栽幼苗进行试验。
1.2 方法
1.2.1 试验设计 试验于2018年6月17日至10月12日在中国林业科学研究院资源昆虫研究所进行,位于云南省红河州元阳县蔓延坡的人工大棚,地理位置为东经102°67′、北纬23°26′,海拔300 m,昼夜平均气温31 ℃/24 ℃,处理期间大棚通风良好。盆栽幼苗移至大棚后首先进行缓苗25 d,缓苗期间进行正常的水肥管理。干旱胁迫参照柴胜丰等[16]的方法按照土壤水分含量占田间持水量(field capacity, FC)的比例设置4个水分梯度:适宜水分、轻度干旱、中度干旱和重度干旱,分别对应的田间持水量为60%~65%(W0)、40%~45%(W1)、30%~35%(W2)和20%~25%(W3)。在每个水分条件下采用增加遮阳网(两针)层数的办法设置3个光照强度:自然光照、轻度遮光和深度遮光,分别对应的光照强度为自然光照的100%(L0)、75%(L1)、50%(L2)。试验采用完全随机区组设计,共计产生(W0L0、W0L1、W0L2、W1L0、W1L1、W1L2、W2L0、W2L1、W2L2、W3L0、W3L1、W3L2)12个处理,每个处理15盆幼苗,共180盆。试验过程中采用称重法维持每个处理的土壤含水量,即每隔2 d,每个处理选取3盆为代表称重后分别补浇各处理亏缺的水分,同时用WET Sensor土壤水分测定仪进行监测。为排除边缘效应,每隔1周调换1次盆栽位置。
1.2.2 项目测定 (1)生长指标。完成缓苗后,利用游标卡尺测量每个植株地径,用卷尺测定苗高,试验结束后再测定一次。随后将全部苗木从盆内取出,洗净泥土,晾干,用枝剪分离根茎。用精度1/10000的电子天平分别称量地上、地下部分鲜重,再分别将根、茎装入信封,置于烘箱内105 ℃杀青0.5 h,然后在80 ℃下烘至恒重后称量干重。
(2)形态指标。各处理选取5株平均苗木,每个植株选取中部3个羽状复叶,再摘取每个复叶中部3对小叶,用天平称量鲜重(LFM),用LI-3000C(LI-COR,美国)叶片扫描仪测量各小叶的叶长、叶宽及叶面积。然后将叶片置于烘箱内105 ℃杀青0.5 h,在80 ℃下烘干至恒重,称取干重(LDM),计算比叶面积(LSA)和叶片含水量(LWC)。LSA=A/LDM;LWC= (LFM-LDM)/LFM。
(3)生理指标。选取植株中部枝条的功能叶3~5个,先用酒精擦拭消毒后再用蒸馏水冲洗多余酒精,最后用吸水纸吸干叶面水分。每个处理单独取样,所取样品充分混合后装入密封袋,置于–20 ℃车载冰箱内带回实验室进行各指标的测定。可溶性糖(sugar)采用蒽酮比色法测定[17];蛋白质(prot)采用考马斯亮蓝G-250染色法测定[18];游离氨基酸(prol)采用茚三酮显色法测定[18]。
(4)叶绿素含量。选取植株中部3~5个功能叶进行叶绿素含量的测定。按照王学奎[17]的方法采用酒精提取,利用酶标仪分别测定665、649和470 nm波长下的吸光度,并利用公式计算叶绿素a、叶绿素b及总叶绿素的含量。
(5)印楝素含量。选取植株中部3~5个功能叶进行印楝素含量的测定,测定方法参照王友琼等[19]的方法适当改进,其主要步骤是:准确称取1 g样品置于研钵内,加入5 mL甲醇进行匀浆,匀浆液转移到10 mL离心管内超声提取10 min后进行减压过滤(滤液过滤到15 mL试管),滤渣加入3 mL甲醇重复超声提取2次,合并滤液并用旋转蒸发仪减压浓缩至3 mL,加2 mL去离子水,摇匀,再加入等体积二氯甲烷萃取2次,二氯甲烷相萃取液减压浓缩后得到印楝素浸膏,用甲醇将其溶解并定容到10 mL,最后用Agilent 1200高效液相色谱仪对其进行定量检测。
1.3 数据处理
试验数据统计采用Microsoft Excel 2003软件;方差分析和差异显著性检验(Duncan新复极差法)采用SPSS 17.0软件;作图采用Sigma Plot 12.5软件;图片编辑采用Adobe Illustrator CS5软件。
2 结果与分析
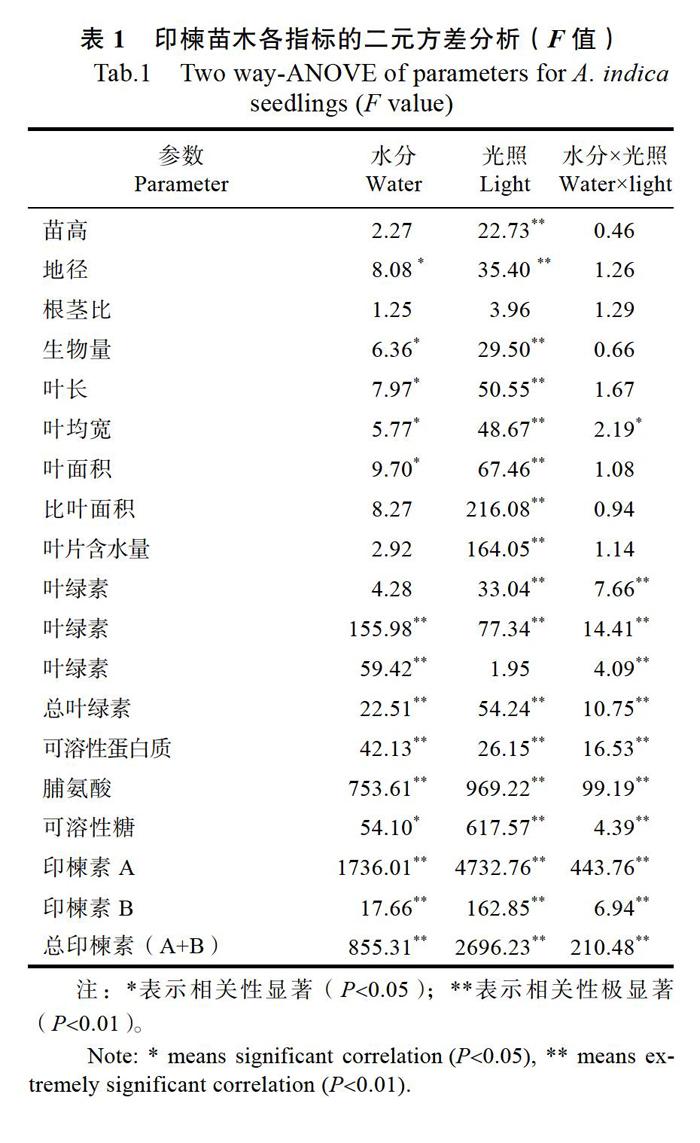
2.1 幼苗生长指标对不同水分和光照条件的响应
由表1可以看出,不同水分条件对印楝地径和生物量均产生显著影响,对苗高和根茎比影响不显著;光照条件除了对印楝根茎比影响不显著以外,对其他各生长指标均产生显著影响;而二者的交互作用对各生长指标影响均不显著。由图1可知,在光照条件相同时,印楝苗高增幅整体上呈现出随着干旱胁迫程度的增加而减少的趋势,但在L1(轻度遮光)和L2(深度遮光)条件下,印
楝苗高增幅在W3(重度干旱)条件下有增大趋势。在水分条件相同时,印楝苗高增幅随光照强度(L0到L2)的减弱而不断减少。印楝生物量对不同水分和光照的响应规律与苗高基本相同。印楝地径增幅在同一光照条件下的变化趋势与苗高也基本一致,但在各水分条件下的变化规律与苗高存在较大差异,即在W2(中度干旱)和W3条件下,印楝地径增幅在L2条件下较大,而在L1条件下较小。印楝根茎比在同一光照条件下随着干旱胁迫程度的增加不断增大,但在W0(自然光照)条件下仍然具有较大的根茎比;在水分条件相同时,印楝根茎比在L2光照条件下最大,而在L1光照条件下最小。
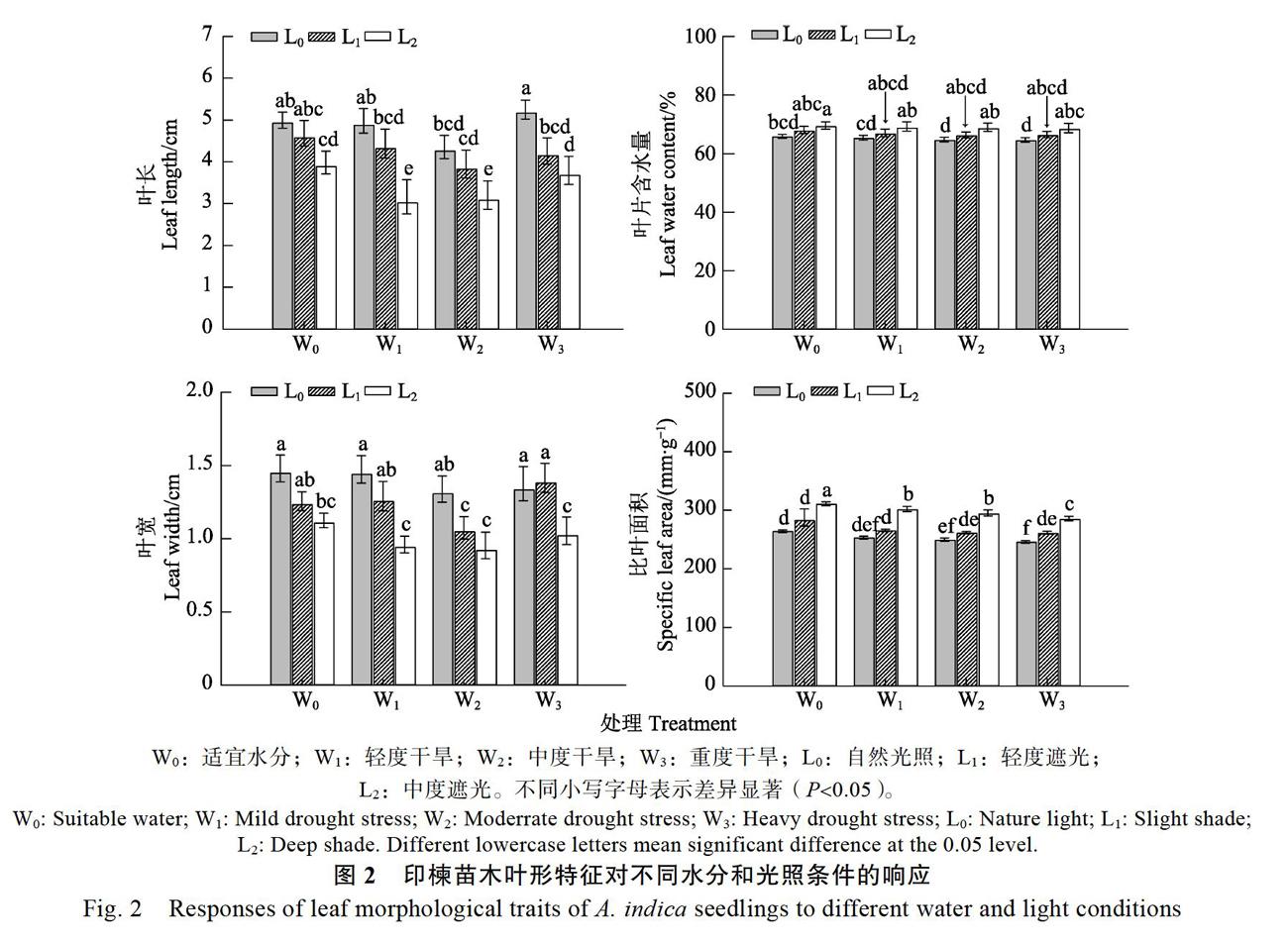
2.2 叶形指标对不同光照和水分的响应
不同水分条件均对印楝叶长、叶宽及叶面积产生显著影响,不同光照条件对三者产生极显著影响,二者的交互作用仅对叶宽产生显著影响,对叶长及叶面积的影响不显著(表1)。由图2可以看出,在光照条件相同时,印楝叶长、叶宽均随着干旱胁迫程度的增加呈先减小后增大的趋势,其中最大值出现在W3条件下,最小值出现在W2条件下;在水分条件相同时,印楝叶长、叶宽均随着光照强度的减弱而减小。
不同光照条件对印楝叶片含水量和比叶面积的影响较大,而不同水分条件对二者的影响较小,光照和水分的交互作用对二者的影响也不显著(表2)。在水分条件相同时,叶片含水量和比叶面积随着光照条件的减弱而不断增加;在光照条件相同时,二者则随着干旱胁迫程度的增加而呈减小趋势。
2.3 叶片色素对不同光照和水分的响应
除水分对叶绿素a影响不显著、光照对叶绿素a/b影响不显著以外,不同水分和光照条件对叶绿素a、叶绿素b、总叶绿素含量及叶绿素a/b均产生显著影响,且水分和光照的交互作用对四者的影响极为显著(表1)。图3显示,在光照条件相同时,印楝叶绿素b及总叶绿素含量均随着干旱胁迫程度的增加呈先增加后减少的趋势,在W2水分条件下达到最大值,叶绿素a/b在W0条件下最大,随着干旱胁迫程度的增加,叶绿素a/b逐渐增加;在同一水分条件下,叶绿素a、叶绿素b和总叶绿素含量均随着光照强度的减弱呈增加趋势。
2.4 代谢产物对不同光照和水分的响应
不同水分及光照条件对印楝叶片初生代谢产物(可溶性蛋白质、脯氨酸和可溶性糖)含量及次生代谢产物(印楝素A、印楝素B和印楝A+B)含量均产生显著影响,二者交互作用对各代谢产物含量影响同样显著;从F值来看,除可溶性蛋白质以外,光照对印楝各代谢产物含量产生的影响均大于水分产生的影响。由表2可知,在水分条件相同时,除W0条件下印楝可溶性蛋白质含量随光照强度的减弱而少量增加以外,可溶性蛋白质、游离脯氨酸及可溶性糖含量均随光照强度的减弱呈减少趋势;在光照条件相同时,除可溶性蛋白质含量随干旱胁迫程度的增加呈先增加后减少的趋势外,游离脯氨酸和可溶性糖含量均随着干旱胁迫程度的增加而不断增加。印楝素A、印楝素B及总印楝素A+B含量对不同水分和光照条件表現出相同的响应规律。在水分条件相同时,印楝叶片印楝素含量均随着光照强度的减弱而不断减少;在光照条件相同时,印楝素含量在W1条件下最高,随后随着干旱胁迫程度的增加而不断减少。不同水分和光照条件下,印楝素A、印楝素B及总印楝素A+B含量最高为W1L0处理,分别为0.0144%、0.0026%和0.0170%,比W0L0处理分别高41.2%、8.3%和34.9%。
3 讨论
干旱和遮光均会抑制植物的冠幅、苗高等指标的生长,同时会影响到植物的叶形指标[3,20]。本研究结果表明,在自然光照条件下,随着干旱程度的增加,印楝苗高、地径和生物量增幅都有所下降,但下降的幅度相对较小。由此表明,印楝幼苗对干旱条件具有较强的适应能力;在遮光条件下,印楝苗高、地径及生物量增幅在重度干旱胁迫条件下呈增加的趋势,由此看来,遮光在一定程度上可以缓解干旱对印楝幼苗生长带来的负面影响,这说明干旱和遮光对印楝苗木的生长
遵循“促进理论”学说[4],不支持“平衡理论”学说[5]。水分条件相同时,印楝苗高和生物量增幅均随光照强度的减弱而急剧减小,这表明幼苗生长对光照具有较强的依赖性。植物根茎比可以反映植物的水分利用率,通常情况下,抗旱性强的植物在干旱胁迫条件下往往具有较大的根茎比[21]。本研究结果表明,光照条件相同时,印楝根茎比均随着干旱胁迫程度的增加而不断增大,说明在干旱环境下,印楝可通过增加根部的生长来提高水分利用率,这一结果很好地诠释了“为什么印楝在造林前通常需要炼苗”这一科学问题。印楝在干旱胁迫、重度遮光条件下具有较大根茎比,这可以用“生活史进化对策权衡理论”的观点[22]来解释,当光合产物向根部分配增加时,必然导致茎部分配量的减少。
叶片是植物进行能量转化和物质代谢的主要场所,也是植物与外界环境接触面积较大的器官,对环境的变化最为敏感[23]。当外部环境变化时,植物叶片可能会发生形态变异,这种变异对植物适应新的环境具有重要意义[24]。本研究结果表明,水分条件相同时,随着光照强度的减弱,印楝叶长和叶宽不断减小,其叶片含水量、比叶面积、叶绿素含量及叶绿素a/b值则随着光照强度的减弱大幅增加,这与Guo等[25]的研究结果一致。遮光阻碍了印楝叶片的正常生长,其原因不仅仅是遮光影响了光合作用,还有可能是遮光抑制了与蒸腾相关的系列反应。叶绿素a/b值是反映植物耐阴性的重要指标,有研究表明,叶绿素a/b值小的植物具有较强的耐阴性[26]。但印楝叶绿素a/b值随着光照强度的减弱而大幅增加,这从印楝代谢的层面再次揭示了印楝不耐阴的特性。光照条件相同时,随着干旱胁迫强度的增加,印楝叶长、叶宽小幅度减少,而叶片含水量和比叶面积则相对比较稳定。研究表明,抗旱性越强的植物在水分胁迫条件下,叶片含水量、比叶面积等叶片指标变幅较小[27]。因此,从印楝叶片形态指标来看,同样可以反映印楝较强的干旱适应能力。
通常情况下,阴生植物可溶性蛋白质等初生代谢物含量往往低于阳生植物[28],逆境下适应性强的植物游离脯氨酸、可溶性糖含量会高于抗逆性差的植物[24]。本研究结果表明,光照条件相同时,可溶性蛋白质、游离脯氨酸和可溶性糖含量均随着干旱胁迫程度的增加而增加,随着光照强度的减弱而减少,这表明在水分不足的情况下,印楝可通过增加可溶性蛋白质、游离脯氨酸及可溶性糖的合成增大细胞渗透势,从而提高水分的吸收和利用,与此同时,游离脯氨酸和可溶性糖的大量合成可减少其他有害物质的形成,保护植物免受伤害。在光照不足的情况下,印楝叶片可溶性蛋白质等初生代谢物的合成较少,表明遮光对印楝的初生代谢不利。汪丽娜等[24]在研究厚朴遮光后可溶性糖含量明显高于对照,出现不同结果的原因可能与植物的属性有关,即厚朴为喜阴植物,而印楝喜光。
印楝素属于四环三萜类化合物,是印楝的次生代谢产物。有研究表明,植物在逆境下往往会积累更多的次生代谢产物[8],此外,在紫外辐射增强的条件下,同样可以诱导植物产生较多吸收紫外光的次级代谢物质[29]。本研究结果显示,在同一水分条件下,印楝素含量随着光照强度的减弱不断减少,这与程金焕等[30]的研究结果相吻合。而在轻度干旱的自然光照条件下,印楝素含量最高。这与Sidhu等[31]的结果也一致,这表明遮光不利于印楝素的合成,而适度干旱则有利于印楝素的合成。印楝素含量在中度和重度水分胁迫条件下有所下降,这可能是由于干旱程度过高而导致细胞活力降低,从而使物质转换过程受阻。
4 结论
印楝幼苗代谢及生长对光照具有较强的依赖性,轻度遮光(75%)就会影响印楝可溶性蛋白质、可溶性糖等初生代谢产物的合成,从而使叶面积、苗高及地径等生长指标受到抑制,影响植株的生物量;与此同时,在初生代谢产物不足的情况下,印楝次级代谢产物印楝素的积累也受到影响。与之相反,印楝幼苗对干旱环境具有较强的适应能力,在干旱胁迫条件下,印楝可通过大量合成可溶性蛋白质和可溶性糖等渗透调节物质来提高植株干旱适应能力,尽可能降低干旱对植株生长带来的负面影响,同时,适度干旱对幼苗叶片中印楝素的合成是有利的;此外,印楝幼苗大部分形態指标和生理指标均对不同水分和光照表现出不同程度的交互作用,因此不支持“独立影响理论”学说;在2种环境胁迫同时存在的条件下,遮光在一定程度上可以缓解干旱对印楝生长和代谢带来的不利影响,支持“促进理论”学说。因此,对于主要引种栽培区是在我国干热河谷的印楝,在幼苗培育过程中要尽可能提供充足的水分和光照条件,当水分缺乏时要对幼苗进行遮光,而造林前适当干旱胁迫可以增大幼苗根茎比,提高造林成活率。此外,在生产上主要以获取种子内印楝素为目标的印楝,适当干旱可以提高幼苗叶片中印楝素的含量,而种子内印楝素含量是否也会一同增加,这还需要开展印楝大树对水分胁迫生理学响应方面的研究才能得出定论。
参考文献
[1] Guerfel M , Beis A , Zotos T , et al. Differences in ab-scisic acid concentration in roots and leaves of two young Olive (Olea europaea L.) cultivars in response to water deficit[J]. Acta Physiologiae Plantarum, 2009, 31(4): 825-831.
[2] 胡举伟, 代 欣, 宋 涛, 等. 红蓝光配比对桑树幼苗碳、氮代谢和内源激素的影响[J]. 草业科学, 2018, 35(10): 2489-2499.
[3] 刘翠菊, 郭 霄, 王奎玲, 等. 耐冬山茶对不同光照和水分的生理生态学响应[J]. 应用生态学报, 2018, 29(4): 1125-1132.
[4] Quero J L, Villar R, Maranon T, et al. Interactions of drought and shade effects on seedlings of four Quercus species: Physiological and structural leaf responses[J]. New Phytologist, 2006, 170(4): 819-834.
[5] Smith T, Huston M. A theory of the spatial and temporal dynamics of plant communities[J]. Plant Ecology, 1989, 83(11): 49-69.
[6] Holmgren M, Scheffer M, Huston M A. The interplay of facilitation and competition in plant communities[J]. Ecology, 1997, 78(7): 1966-1975.
[7] Holmgren M. Combined effects of shade and drought on tulip poplar seedlings: Trade-off in tolerance or facilitation?[J]. Oikos, 2010, 90(1): 67-78.
[8] Krishnan N M,Pattnaik1 S, Jain P, et al. A draft of the genome and four transcriptomes of a medicinal and pesticidal angiosperm Azadirachta indica[J]. BMC Genomics, 2012, 13(1): 464.
[9] 起国海, 许 冰, 朱利利, 等. 印楝嫁接技术研究[J]. 热带农业科学, 2014, 34(12): 39-41, 48.
[10] 刘 芸. 印楝树栽培技术[J]. 园艺与种苗, 2018, 38(7): 10-12.
[11] 李一鸣, 陈孝甜, 王勇庆, 等. 印楝素干粉的制备及生物活性测定[J]. 华南农业大学学报, 2017, 38(4): 48-51.
[12] 徐汉虹, 赖 多, 张志祥, 等. 植物源农药印楝素的研究与应用[J]. 华南农业大学学报, 2017, 38(4): 1-11, 133.
[13] 王瑞波, 刘新龙, 张燕平. 影响印楝素稳定性及其含量的主要因素[J]. 西部林业科学, 2004, 33(1): 59-61, 93.
[14] Zheng Y X, Wu J C, Cao F L, et al. Effects of water stress on photosynthetic activity, dry mass partitioning and some associated metabolic changes in four provenances of neem (Azadirachta indica A. Juss)[J]. Photosynthetica, 2010, 48(3): 361-369.
[15] 彭兴民, 吴疆翀, 郑益兴, 等. 印楝无性系当代种子农药品质性状的遗传变异及农药型印楝优株评价[J]. 林业科学研究, 2017, 30(6): 921-928.
[16] 柴胜丰, 唐健民, 王满莲, 等. 干旱胁迫对金花茶幼苗光合生理特性的影响[J]. 西北植物学报, 2015, 35(2): 322-328.
[17] 王学奎. 植物生理生化试验原理与技术[M]. 北京: 高等教育出版社, 2008.
[18] 高俊凤. 植物生理学试验指导[M]. 北京: 高等教育出版社, 2006.
[19] 王有琼, 李晓升, 孙 龙, 等. 印楝素的快速提取法研究[J]. 林产化工通讯, 2005, 39(5): 13-15.
[20] Guo X, Guo W, Luo Y, et al. Morphological and biomass characteristic acclimation of trident maple (Acer buergerianum Miq.) in response to light and water stress[J]. Acta Physiologiae Plantarum, 2013, 35(4): 1149-1159.
[21] 朱维琴, 吴良欢, 陶勤南. 作物根系对干旱胁迫逆境的适应性研究进展[J]. 土壤与环境, 2002, 11(4): 430-433.
[22] 张大勇. 理论生态学研究[M]. 北京: 中国高等教育出版社, 2000.
[23] Zhang X R, Xiang F, Wang R Q, et al. Effects of soil moisture and light intensity on ecophysiological characteristics of Amorpha fruticosa seedlings[J]. Journal of Forestry Research, 2013, 24(2): 293-300.
[24] 汪麗娜, 杨志玲, 杨 旭, 等. 不同遮光处理对平茬后厚朴萌蘖株部分形态及生理指标的影响[J]. 植物资源与环境学报, 2017, 26(2): 55-60.
[25] Guo X, Guo W, Luo Y, et al. Morphological and biomass characteristic acclimation of trident maple (Acer buergerianum Miq.) in response to light and water stress[J]. Acta Physiologiae Plantarum, 2013, 35(4): 1149-1159.
[26] Fu X Y, Zhou L Y, Huang J B, et al. Relating photo-synthetic performance to leaf greenness in litchi: A comparison amonggenotypes[J]. Scientia Horticulturae, 2013, 152(2): 16-25.
[27] Xiao Y A. The physiology responses and adjective adaptability of water stress on Cleme spinosa L. seedlings[J]. Journal of Wuhan Botanical Research, 2001, 19(6): 524-528.
[28] 曹 珂, 朱更瑞, 王永熙, 等. 遮光对桃幼树形态及一些生理指标的影响[J]. 植物资源与环境学报, 2006, 15(4): 52-56.
[29] 鲁守平, 隋新霞, 孙 群, 等. 药用植物次生代谢的生物学作用及生态环境因子的影响[J]. 天然产物研究与开发, 2006, 18(6): 1027-1032.
[30] 程金焕, 徐永强, 彭兴民, 等. 印楝种仁中印楝素含量的变异[J]. 江西农业学报, 2009, 21(5): 30-33.
[31] Sidhu O P, Behl H M. Seasonal variation in azadirachtins in seeds of Azadirachta indica[J]. Current Science (Bangalore), 1996, 70(12): 1084-1086.
收稿日期 2020-01-15;修回日期 2020-02-18
基金项目 国家自然科学基金项目(No. 31770669)。
作者简介 孙 恒(1988—),男,博士研究生,研究方向:经济林栽培。*通信作者(Corresponding author):郑益兴(ZHENG Yixing),E-mail:yixingzheng@126.com。
