柚芽变株系类胡萝卜素代谢差异基因的转录组学分析
2020-01-04潘鹤立潘腾飞佘文琴徐世荣李小婷黄汉唐陈源吴少华潘东明
潘鹤立 潘腾飞 佘文琴 徐世荣 李小婷 黄汉唐 陈源 吴少华 潘东明
摘 要:為了研究‘琯溪蜜柚果实红肉突变株系类胡萝卜素代谢和芽变的分子机制,本研究以‘琯溪蜜柚及其芽变一代品种‘红肉蜜柚和芽变二代品种‘三红蜜柚果实为材料,使用RNA-seq技术研究3个品种3个发育时期果肉类胡萝卜素的代谢。经生物信息学分析,共筛选出参与类胡萝卜素生物合成显著差异表达的10个基因,分别为八氢番茄红素合成酶基因(PSY)、六氢番茄红素脱氢酶基因(ZDS)、类胡萝卜素异构酶基因(CRTISO1、CRTISO2)、紫黄质脱环氧酶基因(NPQ1)、9-顺式-环氧类胡萝卜素双加氧酶基因(NCED3、NCED5)、脱落醛氧化酶基因(AAO3)、ABA 8-羟化酶基因(CYP707A1)、类胡萝卜素裂解双加氧酶基因(CCD4)。共表达分析揭示了7个家族转录因子的表达模式与类胡萝卜素合成基因高度相关,分别为MADS、bZIP、bHLH、MYB、AP2/ERF、NAC和WRKY。通过实时荧光定量PCR(qRT-PCR)验证了部分基因的表达模式,结果与RNA-seq结果高度一致。此外,经对‘红肉蜜柚果肉转色期的初生和次生代谢通路DEGs富集分析,发现类胡萝卜素的积累过程中,细胞壁、脂质、类黄酮代谢差异基因大量富集。研究结果揭示,‘琯溪蜜柚果实红肉突变品种‘红肉蜜柚和‘三红蜜柚果实类胡萝卜素的形成和积累,是由类胡萝卜素的代谢相关酶基因差异表达和转录因子调控引起的;在果肉红色芽变的同时,伴随着与汁胞粒化相关的基因突变。这对进一步开展柚子果实类胡萝卜素的形成与积累、汁胞粒化研究,为解析柚果实不同颜色突变、汁胞粒化的机制有重要参考价值。
关键词:琯溪蜜柚;芽变;类胡萝卜素;转录组;基因;转录因子
中图分类号:S666.3 文献标识码:A
Transcriptome Analysis of Carotenoid Metabolism Differential Genes in Pomelo Bud Strain
PAN Heli1, PAN Tengfei1, SHE Wenqin1, XU Shirong1, LI Xiaoting1, HUANG Hantang1, CHEN Yuan2,
WU Shaohua1*, PAN Dongming1*
1. College of Horticulture, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China; 2. Institute of Agricultural Engineering and Technology, Fujian Academy of Agricultural Sciences, Fuzhou, Fujian 350003, China
Abstract: In order to study the molecular mechanism of carotenoid metabolism of ‘Guanximiyou pomelo red mutant line, ‘Guanximiyou pomelo (GX), its budding first generation ‘Hongroumiyou (HR) and budding second generation ‘Sanhongmiyou (SH) were used to study the carotenoid metabolism in the pulp of the three varieties at three development stages by the RNA SEQ technology. By bioinformatics analysis, 10 differentially expressed genes were isolated to participate in the biosynthesis of carotenoids, namely, PSY, ZDS, CRTISO1/2, NPQ1, and 9-cis-epoxy carotenoids, the genes of oxygenase (NCED3/5), abscisic aldehyde oxidase (AAO3), ABA 8-hydroxylase (CYP707A1), carotenoid cleavage dioxygenases gene (CCD4). Co expression analysis revealed that the expression patterns of seven family transcription factors were highly correlated with carotenoid synthesis genes, which were MADS, bZIP, bHLH, MYB, AP2/ERF, NAC and WRKY. The expression patterns of some genes were verified by real-time quantitative PCR (qRT-PCR), and the results were highly consistent with those of RNA-seq. In addition, DEGs enrichment analysis of primary and secondary metabolic pathways in ‘red flesh honey pomelo showed that during the accumulation of carotenoids, genes of cell wall, lipid and flavonoid metabolism were abundant. The results showed that the red flesh mutation of GX was caused by the differential expression of carotenoid metabolism related enzyme genes and the regulation of transcription factors; at the same time, the red bud mutation in flesh was accompanied by the mutation related to juice granulation. This may provide a valuable reference for further study on the formation and accumulation of carotenoids and juice granulation, and also provide a way to analyze the mechanism of different color mutation and juice granulation in pomelo fruit.
2.2 差异基因分析
采用P<0.01且| log 2 (FC)|≥2的标准,在3个蜜柚品种的果实发育过程中进行了unigenes的差异表达分析。由3个品种的不同发育时期的维恩图(图2)可知,3个时期两两比对同时差异表达的DEGs,GX、HR和SH分别有619、651和632个,其中最多的是HR,有651个。“80 d vs. 120 d”与“120 d vs. 180 d”同时差异表达的基因中,HR和SH均远多于GX,差距300多个,说明这些基因可能与类胡萝卜素代谢相关。通过比较发现了许多差异表达的基因(表2)。
2.3 差异表达基因的功能注释和分析
为了确定和注释3个蜜柚品种的转录组数据,对差异表达基因与NR,Swiss-Prot,GO,COG,KOG,Pfam和KEGG这7个数据库进行功能注释,发现HR果肉在80 d和180 d之间注释富集到了最多的KEGG,共1317条。3个蜜柚品种芽变的性状是由次级代谢中的类胡萝卜素决定的,进一步对次级代谢中的主要KEGG进行差异基因数目的统计(图3),发现在苯丙烷生物合成途径差异基因最多,在GX、HR和SH 3个品种果实中分别有63、66和68个,其次是黄酮类合成途径,在类胡萝卜素代谢途径中分别有8、9、10个。苯丙烷、黄酮类代谢均与木质素合成关系密切,与汁胞粒化密切相关;且黄酮类代谢还与类胡萝卜素代谢相关。说明‘琯溪蜜柚果肉红色芽变还伴随着与汁胞粒化相关的突变,这与‘红肉蜜柚‘三红蜜柚2个芽变品种较‘琯溪蜜柚容易发生汁胞粒化症相符合。
2.4 类胡萝卜素代谢分析
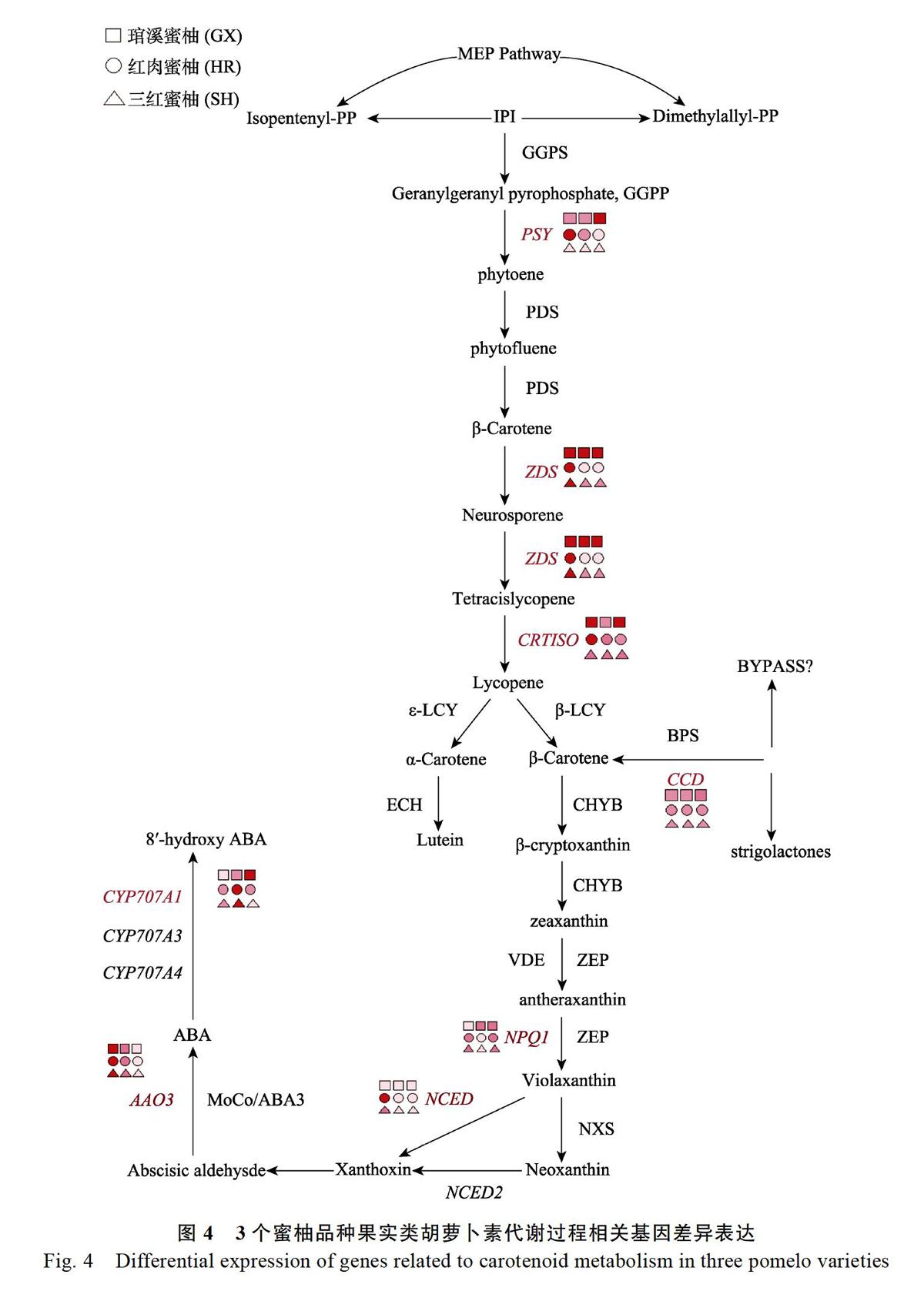
为了进一步探究参与类胡萝卜素生物合成的基因,分析了不同发育阶段3个蜜柚品种的转录组学数据,分离了编码与类胡萝卜素生物合成途径相关酶的基因(表3),并根据差异基因的表达量,在类胡萝卜素代谢途径中进行标注(图4),可见3个蜜柚品种类胡萝卜素的代谢有明显的差异。
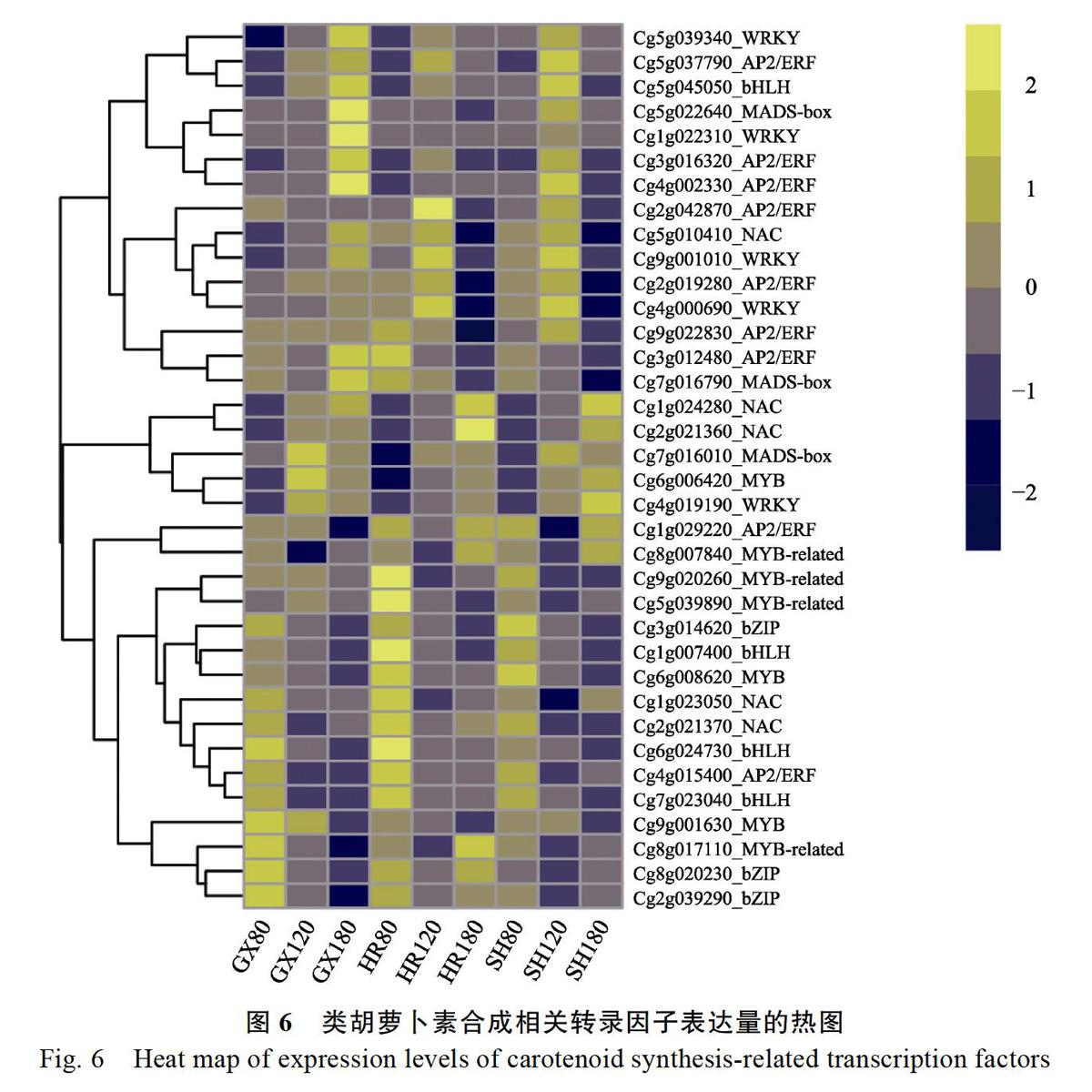
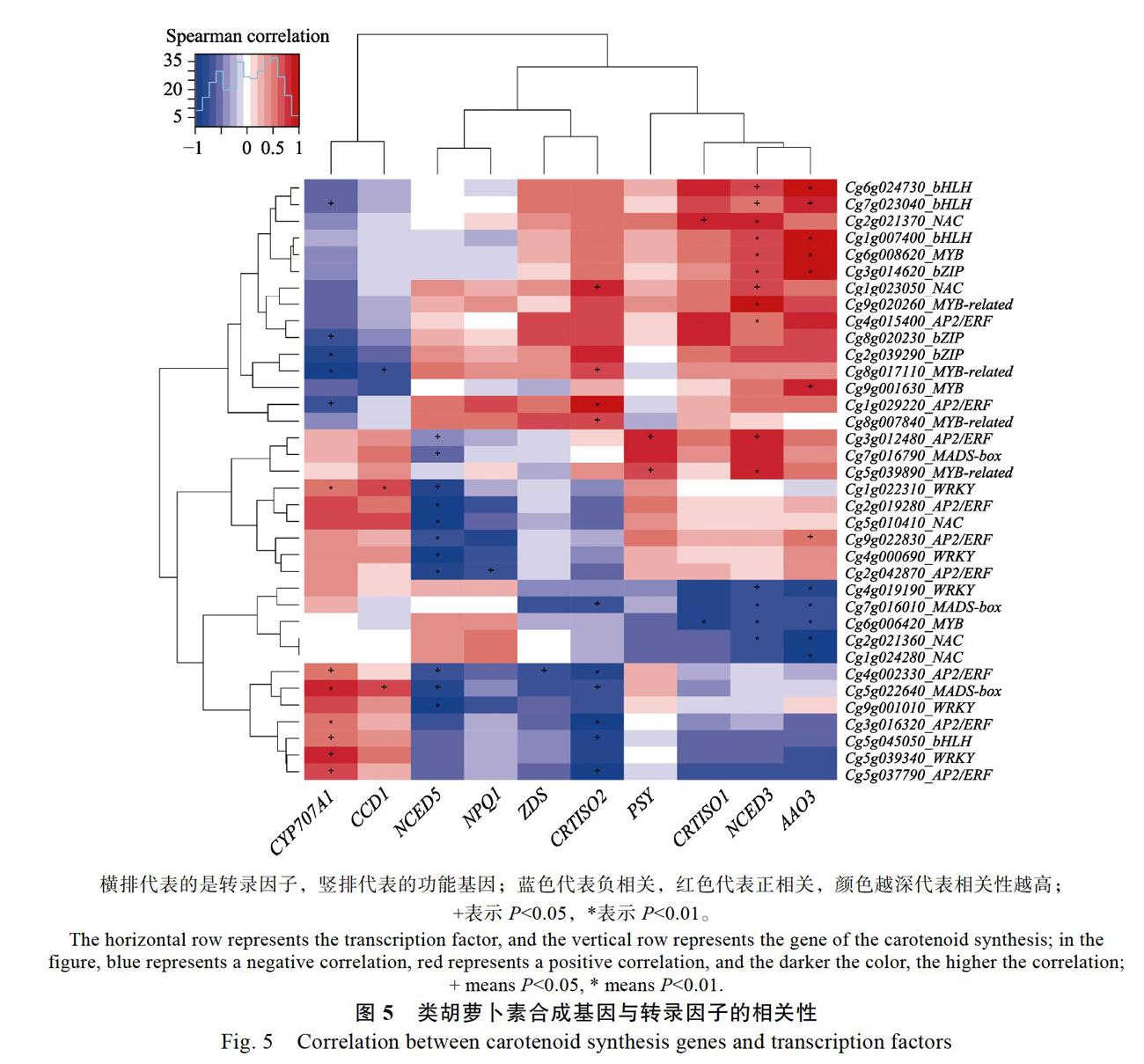
为了鉴定3个蜜柚品种差异表达的转录因子,利用百迈客云平台(www.biocloud.net)预测柚子中的所有转录因子,与所有差异基因取交集发现其中具有差异表达的转录因子共有570个,来自51个不同家族。用spearman方法计算类胡萝卜素生物合成途径的功能基因与转录因子的相关性,设置相关性系数阈值为大于0.73或者小于?0.73,且至少有一个FKPM大于等于10(排除假阳性),得到的转录因子共有205个。又分别筛选每个功能基因正负相关性最大的5个基因进行分析,最终得到与类胡萝卜素代谢高度相关的候选转录因子71个,分布在27个不同家族。其中,包括7个与类胡萝卜素代谢相关的转录因子家族,为MADS、bZIP、bHLH、MYB、AP2/ERF、NAC和WRKY(图5)。在图5中,有大片區域展
示蓝色,说明该区域转录因子对类胡萝卜素合成基因为负调控作用;红色区域说明处于这一块区域转录因子对类胡萝卜素合成基因为正调控作用。如Cg4g002330对CYP707A1显著正相关,与NCED5、ZDS显著负相关,与CRTISO2极显著负相关。
此外,由图6可知,类胡萝卜素代谢相关的转录因子,在3个蜜柚品种和3个时期的表达趋势各异。
2.5 ‘红肉蜜柚果实转色期的初生和次级代谢分析
果实发育是一个代谢物积累、转运和降解的过程。类胡萝卜素代谢只是次级代谢中的一种,离不开其它代谢过程的相互作用。‘红肉蜜柚是‘琯溪蜜柚的芽变品种,在果实成熟过程,果肉从白色突变为红色,是研究类胡萝卜素与其他代谢途径协同关系的重要材料。经‘红肉蜜柚果实转色期的初生和次生代谢通路DEGs富集分析,发现在类胡萝卜素积累的过程中,差异基因富集最多的是细胞壁代谢、脂质代谢、次生代谢途径,其次是糖代谢、抗坏血酸和谷胱甘肽等一些代谢途径。其中,细胞壁代谢途径差异表达最多的是纤维素合成、果胶甲脂酶、果胶酸裂解酶和多聚半乳糖醛酸酶基因;在糖代谢途径中,淀粉降解加快,蔗糖合成加快,蔗糖降解减慢,符合果实成熟发育的特征;抗坏血酸和谷胱甘肽代谢的基因多数上调表达;次级代谢途径中,类胡萝卜素代谢的上游代谢途径类黄酮代谢中差异表达基因数最多,与类胡萝卜素代谢关系较为密切。
这一结果再次表明,在果肉红色芽变果肉中类胡萝卜素代谢相关基因差异表达的同时,伴随着与汁胞粒化相关基因的差异表达。
2.6 qRT-PCR验证
为了进一步证实转录组学分析的结果,选择了10个类胡萝卜素合成的差异表达基因,以及18个与类胡萝卜素代谢极显著(P<0.01)相关的转录因子,通过qRT-PCR在3个蜜柚品种中分析了10个与类胡萝卜素生物合成相关的基因。如图7所示,所有选择的基因在3个阶段中以不同水平表达,并且与RNA-seq数据具有紧密相关性。
根据qRT-PCR结果(图7),HR和SH 3个时期果实的ZDS和CRTISO2基因的表达均高于GX,可能是HR和SH积累番茄红素的关键因素。CCD4对应拟南芥中的AtCCD4(AT4G19170.1),GX果肉中的表达量从80 d到180 d下降了约2倍,而HR上升了约1.5倍,说明CCD4可能在蜜柚果肉中调控番茄红素的降解。AAO3在不同蜜柚品种中随着果实的成熟而下降,说明到成熟后期内源ABA合成迅速减慢。CYP707A1在HR和SH中呈先升高后降低的趋势,而GX则随着成熟不断升高。这可能涉及在果实成熟后期降低ABA含量防止其过度积累,从而使果实生命活动趋于稳定。因此,推测ABA的合成受类胡萝卜素的含量和组分的调控,同时,ABA也参与调控果实成熟及类胡萝卜素的反馈调节。MYB5、WRKY1、MADS1、MADS2和WRKY2在GX的3个发育时期的差异表达是3个品种中最显著的。MYB3在80 d时在SH中的表达量最高,随着果实发育迅速下降。转录因子NAC3在GX 3个发育时期的果实中的表达量逐渐上升,在HR和SH的80 d与120 d时期保持一定的表达量,在180 d时表达量增大1倍,而NAC4则呈现逐渐下降后期回升的趋势。转录因子ZIP1、ZIP2、BHLH1和BHLH2在3个品种中则都随着果实发育而下降。
3 讨论
类胡萝卜素是柚类水果中最主要的红色色素。类胡萝卜素的组成组分与代谢积累是影响果实颜色呈色的主要原因,不同的类胡萝卜素组分使得果实颜色表现出黄色到紫红色的变化。前期研究已经证明,‘琯溪蜜柚的红色突变品种‘红肉蜜柚和‘三红蜜柚,果肉中主要积累番茄红素和β-胡萝卜素[1-4, 6-9]。
在本研究中发现,‘红肉蜜柚和‘三红蜜柚3个不同时期果实的ZDS和CRTISO2基因的表达均高于‘琯溪蜜柚。前人研究表明,八氢番茄红素合酶基因(PSY)、六氢番茄红素脱氢酶基因(ZDS)、类胡萝卜素异构酶基因(CRTISO)、紫黄质脱环氧酶(NPQ)、9-顺式-环氧类胡萝卜素双加氧酶(NCED)在类胡萝卜素生物合成中,可能是控制类胡萝卜素代谢的关键因素[2,3,8,10]。另有研究报道,分别从番茄和拟南芥中分离和鉴定得到了类胡萝卜素异构酶(CRTISO)基因,并确认了在植物体内由八氢番茄红素转化番茄红素是PDS、ZDS和CRTISO三个酶基因共同作用的结果[11-12]。由此可见,ZDS和CRTISO2基因的上调表达是‘琯溪蜜柚红肉突变体‘红肉蜜柚和‘三红蜜柚积累番茄红素的关键因素。
‘琯溪蜜柚果肉中的CCD4表达量从花后80 d到180 d下调了约2倍,而‘红肉蜜柚上调了约1.5倍。有研究证实,CCD4酶是编码具有9-顺式-环氧类胡萝卜素双加氧酶活性的蛋白质,作用于多种类胡萝卜素,包括β-胡萝卜素、叶黄素、玉米黄质和全反式-紫黄质。在不同植物不同组织中对类胡萝卜素具有调控作用,如拟南芥种子[13]、菊花瓣[14]和桃果肉[15-16]。柑橘中的CCD4酶通过切割β-胡萝卜素、β-隐黄质和玉米黄质中的C7-C8双键,从而调控果皮色素、β-柑橘苷、β-柠檬醛以及挥发物等[17-19]。已经证实9-顺式- 环氧类胡萝卜素双加氧酶NECD对顺式-环氧类胡萝卜素的氧化裂解是高等植物中ABA合成调节的关键步骤[20]。说明CCD4可能在蜜柚果肉中调控着番茄红素的积累。
本研究结果表明,在不同蜜柚品种中AAO3随着果实的成熟而下降,说明到果实成熟后期内源ABA合成减慢。已有研究表明,水果中ABA含量的调节是由两种主要的代谢酶基因AAO3和CYP707A1调控的[21]。外源ABA处理,可以显著影响杧果[22]、葡萄[23-24]、西瓜[25]等水果类胡萝卜素含量的积累。同样,参与类胡萝卜素代谢的几个重要基因,如来自玉米的PSY3和来自水稻的β-胡萝卜素羟化酶基因DSM2,都被ABA处理显著诱导[12, 26]。这些结果表明,ABA既是类胡萝卜素途径的下游产物,同时也是类胡萝卜素代谢的反馈调节剂。在本研究中观测到,CYP707A1在‘红肉蜜柚和‘三红蜜柚果实中,呈先上调而后下调的趋势,而‘琯溪蜜柚則随着成熟不断升高。因此,推测ABA的合成受类胡萝卜素的含量和组分的调控,同时,ABA也参与调控果实成熟及类胡萝卜素的反馈调节。
本研究筛选到18个与类胡萝卜素合成基因显著相关的转录因子,其家族分别为9个AP2/ERF、4个bHLH、3个bZIP、3个MADS-box、7个MYB、5个NAC和5个WRKY。已有研究报道了一些转录因子可能调控类胡萝卜素代谢,如拟南芥中的PIF1和RAP2.2(AP2/ERF家族)[27-28];西瓜中的ERF6等[29];红薯中的NAC、MYB、AP2/ERF、WRKY、bZIP和ARF等[30]。在番茄中,沉默SlNAC4不仅延迟果实成熟同时导致类胡萝卜素含量减少,说明SlNAC4是类胡萝卜素和成熟的正调控因子[30]。将葡萄中的R2R3-MYB转录因子(VvMYB5b)转入番茄中,发现苯丙烷代谢下调,而β-胡萝卜素的量上调,证明了这2条途径都受到调控并可以独自代谢[31]。而在柑橘突变体(Citrus reticulata cv Suavissima)中,也发现R2R3-MYB转录因子(CrMYB68)通过负调控CrBCH2和CrNCED5的表达,从而调控α-和β-分支类胡萝卜素的转化[32]。共表达分析表明,本研究筛选到的转录因子与类胡萝卜素合成基因具有显著相关,有些同时与多个类胡萝卜素合成基因具有显著相关性。
综上所述,本研究初步鉴定了一批与蜜柚类胡萝卜素代谢相关的功能基因和转录因子。研究结果揭示,‘琯溪蜜柚果实红肉突变品种‘红肉蜜柚和‘三红蜜柚果实类胡萝卜素的形成和积累,是由类胡萝卜素的代谢相关酶基因差异表达和转录因子调控引起的;在果肉红色芽变的同时,伴随着与汁胞粒化相关的基因突变。诚然,这些功能基因的功能已有较多的研究,作用已经逐渐清晰,但是调控它们的转录因子目前研究的还很少,特别是多年生果树柑橘,由于童期太长,研究进展相对缓慢。因此,这些被鉴定的转录因子,是如何与靶基因相互作用而实现转录调控的;是如何影响蛋白修饰如组蛋白磷酸化、甲基化和乙酰化,从而导致不同的调控途径发挥不同作用的,都尚不清楚。这些调控机理尚待进一步研究,为揭示柚类等柑橘的类胡萝卜素调控和果实颜色芽变机理提供理论支持。
参考文献
[1] 李伟明. 柚果实生长发育过程中类胡萝卜素的分离及其积累研究[D]. 福州: 福建农林大学, 2013.
[2] 余 磊. 柚果实类胡萝卜素合成途径的研究[D]. 福州: 福建农林大学, 2018.
[3] 陈德欣. 红肉蜜柚β-胡萝卜素合成途径相关酶基因的克隆[D]. 福州: 福建农林大学, 2007.
[4] 扶丽红. 柚COMT基因的克隆与表达研究[D]. 福州: 福建农林大学, 2015.
[5] 王 霞. 柑橘精细定位平台构建及其在多胚和色泽芽变研究中的应用[D]. 武汉: 华中农业大学, 2018.
[6] Bartley G E, Scolnik P A. Plant carotenoids: pigments for photoprotection, visual attraction, and human health[J]. The Plant Cell, 1995, 7(7): 1027-1038.
[7] Sieber P, Petrascheck M, Barberis A, et al. Organ polarity in Arabidopsis NOZZLE physically interacts with members of the YABBY family[J]. Plant Physiolgy, 2004, 135(4): 2172-2185.
[8] 余 磊, 潘騰飞, 张 蒙,等.‘三红蜜柚果实类胡萝卜素合成途径部分酶基因的克隆及表达分析[J]. 热带作物学报, 2018, 39(10): 1990-1998.
[9] 赵晓玲, 佘文琴, 林慧颖. 不同套袋处理对琯溪蜜柚果实品质的影响[J]. 中国南方果树, 2012, 41(4): 62-64.
[10] Rodrigo M, Marcos J F, Zacarías L. Biochemical and molecular analysis of carotenoid biosynthesis in flavedo of orange (Citrus sinensis L.) during fruit development and maturation[J]. Journal of Agricultural & Food Chemistry, 2004, 52(22): 6724-6731.
[11] Chen C X, Costa M G C, Yu Q B, et al. Identification of novel members in sweet orange carotenoid biosynthesis gene families[J]. Tree Genetics & Genomes, 2010, 6(6): 905-914.
[12] Isaacson T, Ronen G, Zamir D, et al. Cloning of tangerine from tomato reveals a carotenoid isomerase essential for the production of beta-carotene and xanthophylls in plants[J]. The Plant Cell, 2002, 14(2): 333-342.
[13] Gonzalez-Jorge S, Ha S-H, Magallanes-Lundback M, et al. Carotenoid cleavage dioxygenase4 is a negative regulator of β-carotene content in Arabidopsis seeds[J]. The Plant Cell, 2013, 25(12): 4812-4826.
[14] Ohmiya A, Kishimoto S, Aida R, et al. Carotenoid cleavage dioxygenase (CmCCD4a) contributes to white color formation in chrysanthemum petals[J]. Plant Physiology, 2006, 142(3): 1193-1201.
[15] Brandi F, Bar E, Mourgues F, et al. Study of ‘Redhaven peach and its white-fleshed mutant suggests a key role of CCD4 carotenoid dioxygenase in carotenoid and norisoprenoid volatile metabolism[J]. BMC Plant Biology, 2011, 11(1): 24.
[16] Falchi R, Vendramin E, Zanon L, et al. Three distinct mutational mechanisms acting on a single gene underpin the origin of yellow flesh in peach[J]. The Plant Journal: For Cell and Molecular Biology, 2013, 76(2): 175-187.
[17] Ma G, Zhang L C, Matsuta A, et al. Enzymatic formation of β-citraurin from β-cryptoxanthin and zeaxanthin by carotenoid cleavage dioxygenase4 in the flavedo of citrus fruit[J]. Plant Physiology, 2013, 163(2): 682-695.
[18] Rodrigo M J, Alquézar B, Alós E, et al. A novel carotenoid cleavage activity involved in the biosynthesis of citrus fruit-specific apocarotenoid pigments[J]. Journal of Experimental Botany, 2013, 64(14): 4461-4478.
[19] Zheng X J, Zhu K J, Sun Q, et al. Natural variation in CCD4 promoter underpins species-specific evolution of red coloration in citrus peel[J]. Molecular Plant, 2019, 12(9): 1294-1307.
[20] Xia H, Wu S, Ma F W. Cloning and expression of two 9-cis-epoxycarotenoid dioxygenase genes during fruit development and under stress conditions from Malus[J]. Molecular Biology Reports, 2014, 41(10): 6795-6802.
[21] Li R, Zhai H, Kang C, et al. De novo transcriptome sequencing of the orange-fleshed sweet potato and analysis of differentially expressed genes related to carotenoid biosynthesis[J]. International Journal of Genomics, 2015: 843802.
[22] Zhou Y, Tang Y, Tan X, et al. Effects of exogenous ABA, GA3 and cell-wall-degrading enzyme activity, carotenoid content in ripening mango fruit[J]. Acta Phytophysiologica Sinica, 1996, 22(4): 421-426.
[23] Cantín C M, Fidelibus M W, Crisosto C H. Application of abscisic acid (ABA) at veraison advanced red color deve?lopment and maintained postharvest quality of ‘crimson seedless grapes[J]. Postharvest Biology and Technology, 2007, 46(3): 237-241.
[24] Wheeler S, Loveys B, Ford C, et al. The relationship between the expression of abscisic acid biosynthesis genes, accumulation of abscisic acid and the promotion of Vitisvinifera L. berry ripening by abscisic acid[J]. Australian Journal of Grape and Wine Research, 2009, 15(3): 195-204.
[25] Zhang J, Guo S G, Ren Y, et al. High-level expression of a novel chromoplast phosphate transporter ClPHT4; 2 is required for flesh color development in watermelon[J]. New Phytologist, 2017, 213(3): 1208-1221.
[26] Du H, Wang N L, Cui F, et al. Characterization of the beta-carotene hydroxylase gene DSM2 conferring drought and oxidative stress resistance by increasing xanthophylls and abscisic acid synthesis in rice[J]. Plant Physiology, 2010, 154(3): 1304-1318.
[27] Toledo-Ortiz G, Huq E, Rodríguez-Concepción M. Direct regulation of phytoene synthase gene expression and carotenoid biosynthesis by phytochrome-interacting factors[J]. Proc Natl Acad Sci USA, 2010, 107(25): 11 626-11 631.
[28] Welsch R, Maass D, Voegel T, et al. Transcription factor RAP2.2 and its interacting partner SINAT2: Stable elements in the carotenogenesis of Arabidopsis leaves[J]. Plant Physiol, 2007, 145(3): 1073-1085.
[29] Grassi S, Piro G, Lee J M, et al. Comparative genomics reveals candidate carotenoid pathway regulators of ripening watermelon fruit[J]. BMC Genomics, 2013, 14(1): 781.
[30] Zhu M K, Chen G P, Zhou S, et al. A new tomato NAC(NAM/ATAF1/2/CUC2) transcription factor, SlNAC4, functions as a positive regulator of fruit ripening and carotenoid accumulation[J]. Plant and Cell Physiology, 2014, 55(1): 119-135.
[31] Mahjoub A, Hernould M, Joubès J, et al. Overexpression of a grapevine R2R3-MYB factor in tomato affects vegetative development, flower morphology and flavonoid and terpenoid metabolism[J]. Plant Physiology and Biochemistry, 2009, 47(7): 551-561.
[32] Zhu F, Luo T, Liu C Y, et al. An R2R3-MYB transcription factor represses the transformation of alpha- and beta-branch carotenoids by negatively regulating expression of CrBCH2 and CrNCED5 inflavedo of citrus reticulate[J]. New Phytologist, 2017, 216: 178-192.
收稿日期 2020-04-24;修回日期 2020-07-16
基金項目 2017年福建省科技厅区域发展项目(No. 2017N3005);2018年福建省发改委农业“五新”工程项目(闽发改农业[2018]114号);福建省农业科学院“青年科技英才百人计划”项目(No. YC2015-10)。
作者简介 潘鹤立(1983—),男,博士,讲师,研究方向:园艺学。*通信作者(Corresponding author):吴少华(WU Shaohua),E-mail:348279953@qq.com;潘东明(PAN Dongming),E-mail:pdm666@126.com。
