1株抗烟草青枯病菌拮抗菌的筛选及鉴定
2020-01-03王磊王兴兰郭瑞
王磊 王兴兰 郭瑞
摘 要:在黔南烟区烟草青枯病严重发病的田块采集健康烟草根际土壤进行分离、纯化和培养后共获得35株细菌,通过抑菌圈法筛选出2株对烟草青枯病菌具有良好拮抗效果的菌株S3-1和S3-2,抑菌圈直径分别为1.3cm和1.4cm,抗青枯病的模式菌FZB抑菌圈为1.3cm;通过对目标菌株S3-2开展16S rDNA序列测定,并对测序结果开展BLAST比对,初步鉴定出S3-2菌株属于芽孢杆菌属。
关键词:烟草青枯病菌;根际细菌;拮抗菌;分子生物学鉴定
Abstract:Collecting healthy tobacco rhizosphere soil from fields with severe incidence of tobacco bacterial wilt in Qiannan tobacco area,35 strains of bacteria were obtained after isolation,purification,and cultivation. Two strains were screened out with good antagonistic effects against tobacco bacterial wilt by the inhibition zone method. The diameters of the inhibition zone of the strains S3-1 and S3-2 are 1.3cm and 1.4cm,respectively. The inhibition zone of bacterial wilt resistance model FZB is 1.3cm. By sequencing the 16S rDNA of the target strain S3-2 and comparing the sequencing results with BLAST,the strain S3-2 was preliminarily identified as bacillus.
Key words:Tobacco bacterial wilt;Rhizosphere bacteria;Antagonistic bacteria;Molecular biological identification
由青枯雷爾氏菌引起的细菌性土传性病害烟草青枯病危害范围广泛,对我国烟草种植业造成了巨大的经济损失[1]。通过筛选有效的生物防治细菌进行生物防治是一种安全无害且长效的方法[2]。微生物有机肥不仅可以降低青枯病的发病率,而且还能为烟株提供营养,改善土壤环境[3]。与常用的化学防治方法相比,生物防治具有成本低、效果持久以及无二次污染等优点[4]。毕涛[5]在山东烟区根际土壤中分离出3株具有最佳抑菌效果的菌株Cla、Tsb、C2c,经鉴定均为多粘类芽孢杆菌;董昆明等[6]从黔江烟区根际土壤中分离得到的5B18菌株经鉴定是解淀粉芽孢杆菌。由此可见,筛选抗性菌株对青枯病等病害进行生物防治是当前热门的研究课题之一。本研究从发病田块的健康烟草植株根际土壤样品中筛选出2株对青枯病菌具有良好抗性的菌株,并进行分子生物学鉴定,以期为开发绿色生物肥料、防治病害、改良土壤环境提供物质支持。
1 材料与方法
1.1 材料
1.1.1 供试菌种 试验所用的烟草青枯病病原菌来源于安徽农业大学植物病理实验室,从黔南烟区的健康植株根际土壤中分离得到所需的烟草根际细菌。
1.1.2 培养基 烟草根际细菌分离、培养、筛选均使用牛肉膏蛋白胨培养基(NA):蛋白胨10g,氯化钠5g,牛肉膏3g,琼脂15g,水1000mL,pH 7.0~7.2[7];青枯病病原菌培养使用TCC培养基:蛋白胨10g,氯化钠5g,牛肉膏3g,加入1%TTC,琼脂15g,水1000mL,pH 7.0~7.2。
1.2 试验方法
1.2.1 菌种初筛 按梯度稀释土壤样品。取1g土壤样品置于装有9mL无菌水的灭菌试管内,并将其混合均匀得到10-1土壤稀释溶液;取1mL该土壤稀释液,转移至装有9mL无菌水的新试管内,充分混合得到10-2土壤稀释溶液[8];以此类推,同样操作得到10-5、10-6、10-7土壤稀释溶液。分别吸取100μL 10-5、10-6、10-7土壤稀释液涂布到NA固体培养基内,将平板置于28℃恒温培养箱中,培养24h后挑取形态不同的单菌落进行纯化培养。
1.2.2 高效生防菌的筛选 取1mL浓度为1×[106]CFU/mL的烟草青枯病菌悬浮液,在TTC培养基灭菌后且温度冷凝到一定程度后混合均匀倒平板,制成含烟草青枯病菌的培养基。在培养基平板背面距离中心2.5cm处做上标记,每个平板4个角落各做1个标记,然后将灭好菌的牛津杯(孔直径为6mm)置于背面做好位置标记的培养基上,分别取150μL提前制备好的烟草根际细菌菌悬液置于牛津杯孔内并做好标记,将FZB生防菌菌悬液放入第4个牛津杯中作为对照。置于30℃恒温培养箱中培养48h后测定抑菌圈大小。每个处理重复3次。通过测量抑菌圈直径,筛选出对烟草青枯病菌拮抗效果较好的细菌。
1.3 菌种分子鉴定 16S rDNA PCR扩增[9]:PCR扩增引物用27F和1492R,PCR扩增体系:灭菌去离子2l?L,GoTaq?Green Master Mix 25?L,DNA模板2?L,2个引物各1?L,体系共计50?L;PCR扩增条件:95℃预变3min,94℃变性30s,55℃退火1min,72℃延伸100s,35个循环,72℃延伸7min;PCR产物的电泳检测:取5?L的PCR扩增产物,用移液枪在提前配制好的已经凝固的1%琼脂糖凝胶上点样,之后进行电泳,25min左右在紫外灯下对扩增的结果进行检测,记录目的片段扩增情况;将扩增的样品送测序公司测序,结合测序结果在NCBI官网开展BLAST比对,进而对筛选出来的菌株进行初步鉴定。
2 结果与分析
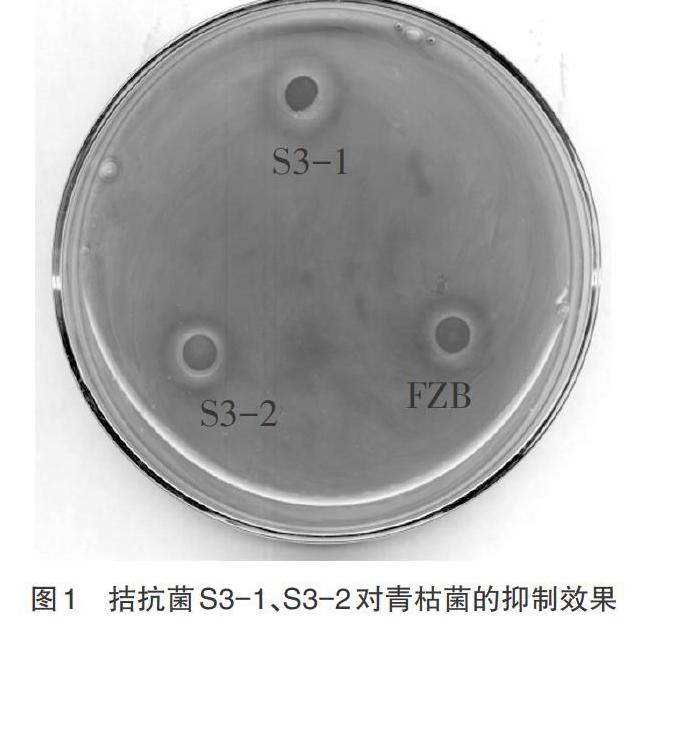
2.1 细菌菌株的分离筛选 经过稀释涂布法筛选共获得35株细菌,通过抑菌圈法筛选出2株细菌S3-1、S3-2,对烟草青枯病病原菌均具有拮抗作用,其中S3-1抑菌圈为1.3cm,S3-2抑菌圈为1.4cm,抗青枯病模式菌FZB抑菌圈为1.3cm(图1)。因此选择S3-2进行分子生物学鉴定。
2.2 16S rDNA基因序列测定以及分子学鉴定 通过对菌株S3-2进行16S rDNA基因序列测定,对测序结果开展BLAST比对,初步鉴定菌株为芽孢杆菌属。
3 结论与讨论
本次研究采取梯度稀释分离法和平板涂布纯化法对烟草根际土壤进行分离和纯化培养,共得到35株疑似生防菌,通过抑菌圈法发现其中2株具有抑菌效果,分别是S3-1菌株和S3-2菌株,S3-2抑菌能力优于抗青枯病模式菌FZB,因此使用S3-2作为后续试验鉴定的主要菌株。通过对目标菌株开展16S rDNA序列测定,并对测序结果开展BLAST比对,初步鉴定出S3-2菌株属于芽孢杆菌属。在后续试验中,S3-2的发酵液经初步纯化后应用于青枯病菌的防控中,表现出较强的抑制效果,因此可作为生物防治手段防治青枯病,同时也有助于改良土壤环境[10]。
參考文献
[1]易龙,肖崇刚.烟草赤星病防治研究进展[J].植物保护,2003(5):10-14.
[2]冯吉,黎妍妍,程玲,等.烟草青枯病的生物防治研究进展[J].安徽农业科学,2016,44(1):203-205,215.
[3]吴晓宗,曾强,李红丽,等.拮抗菌生物有机肥对植烟土壤和烟草青枯病的影响[J].江苏农业科学,2017,45(15):88-91.
[4]吴翔,甘炳成,谢丽源,等.一株烟草青枯拮抗细菌的筛选、鉴定和培养特性研究[J].中国土壤与肥料,2019(2):208-215.
[5]毕涛.山东省烟草青枯病病原鉴定及化学药剂和生防菌株的筛选[D].泰安:山东农业大学,2014.
[6]董昆明,陈亮,周晓见,等.1株抑烟草青枯病生防菌的筛选·鉴定及其活性物质研究[J].安徽农业科学,2011,39(31):19172-19175.
[7]陈欣怡.苹果轮纹病生防解淀粉芽胞杆菌(Bacillus amyloliquefaciens)PG12主要生防机制研究[D].北京:中国农业大学,2016.
[8]陈丽,疏秀林,安德荣,等.土壤拮抗放线菌S-5210-6活性产物抑菌谱及其作用机制[J].植物保护学报,2007(3):277-282.
[9]Svetoslav Dimitrov Todorov,Martina Meincken,Leon Milner Theodore Dicks.Factors affecting the adsorption of bacteriocins ST194BZ and ST23LD to Lactobacillus sakei and Enterococcus sp.[J].The Journal of general and applied microbiology,2006,52(3):159-167.
[10]何明兴,沈亮,邱恒良,等.烟草青枯病的发生及防治[J].现代农业科技,2019(1):111-112,115.
(责编:徐世红)
