促黄体素对绵羊卵母细胞体外成熟及卵裂的影响
2020-01-03赵建清高庆华
李 娜 赵建清 黄 飞 袁 水 方 翟 高庆华,3*
(1塔里木大学生命科学学院,新疆阿拉尔843300)
(2塔里木大学动物科学学院,新疆阿拉尔843300)
(3 新疆生产建设兵团塔里木畜牧科技重点实验室,新疆阿拉尔843300)
在动物体内优势卵泡成熟前LH 峰(LH surge)激增促使卵泡成熟并排卵,Dieleman 等[1]利用活体采卵技术(OPU,ovum pick-up)采集出现LH 峰后优势卵泡中的卵母细胞,其囊胚率和活胚率均高于未出现LH 峰卵泡中的卵母细胞。张美佳等[2]研究发现维持减数分裂阻滞关键化合物为环腺苷酸(cAMP,cyclic adenosine monophosphate)和环鸟苷酸(cGMP,cyclic guanosinc monophosphate),cAMP 水平降低会引起卵母细胞过早成熟导致其成熟和排卵不同步,影响卵母细胞受精能力。PDE3A 是卵母细胞特异表达的磷酸二酯酶(phosphodiesterases),能被LH 激活,从而下调卵母细胞中的cAMP 水平,启动卵母细胞的成熟。LH 峰到来之前,来源于颗粒细胞的cGMP,通过缝隙连接到达卵母细胞内,抑制了卵母细胞内PDE3A 的活性,将卵母细胞成熟和排卵调至同步状态。Younis等[3]提出LH 能促进卵母细胞的成熟,孔祥敏等[4]认为在促排卵周期中,LH水平较高时,能够获得较高的卵子数,提高获卵率,对临床妊娠率也是一种帮助。Okazaki等[5]研究了含有FSH 的成熟培养基中添加LH能够上调颗粒细胞cAMP 水平刺激孕酮的分泌,分泌的孕酮能够减少颗粒细胞增殖活性,加速减数分裂恢复。李凯等[6]认为LH 延迟生发泡破裂(GVBD,germinal vesicle breakdown)的同时,促进卵母细胞胞质成熟,使绵羊卵母细胞的核质成熟趋于同步,有助于绵羊卵母细胞的体外成熟以及受精后进一步的发育。Blondin 等[7]在奶牛超数排卵方案中于取卵前6 h对一半的母牛注射LH,OPU后发现注射LH虽未改变卵泡的大小但显著提高了体外胚胎培养的胚胎发育率及囊胚率。目前LH 对绵羊卵裂后胚胎发育作用的研究较少,且大多数研究者认为LH 的添加浓度在5~20 µg/mL 时,能获得较高的卵母细胞成熟率,但LH的最适添加浓度并没有得到统一[8-10,15]。本试验在TCM199成熟基础培养液中分别添加5个浓度梯度的LH,比较不同浓度的LH 对绵羊卵母细胞的成熟率、受精率以及卵裂率的影响,以确定LH 的最适添加浓度。
1 材料与方法
1.1 材料
1.1.1 主要试剂
促卵泡素(FSH)购自Reprobiol 公司,肝素钠、促黄体素(LH)购自索莱宝,SOF液购自Caisson公司,胎牛血清(FBS)、双抗(PS)、TCM199 培养基购自Giboc公司,昆仑一号精液稀释液购自塔克蓝公司,其余药品均购自Sigma公司。
1.1.2 试剂配制
卵巢运输液1 L:9 g NaCl+0.1 g(100 mg/L)青霉素+0.1 g(100 mg/L)链霉素。
采卵液1 L:9. 5 g TCM199 粉(9. 5 g/L)+0. 42 g NaHCO3(5 mM)+2. 383 g HEPES(10 mM)+2. 603 g HEPES-Na(10 mM)+0. 01 g 肝素钠(10 mg/mL)+10 ml FBS(1%)+10 ml PS(1%)
卵母细胞基础成熟培养液100 ml:TCM199 培养基90 ml+200 µL 5 mg/L FSH 浓储液终浓度(10 µg/mL)+10 ml FBS(10%)+ 20 µL 10 mg/L E2浓储液终浓度(2 µg/mL)+1 ml PS(1%)+0. 022 g 丙酮酸钠(2 mM)+0.5 ml 200 mM L-谷氨酰胺(1 mM)+0.0024 g L-胱氨酸(100µM)
配制不同浓度LH 的卵母细胞成熟液:卵母细胞基础成熟培养液(0µg/mL)中LH的添加浓度分别为:5、10、15、20µg/mL
0. 1% 透明质酸酶:0. 1 g 透明质酸酶+100 mL PBS
精 子 获 能 液10 ml:8 ml SOF 液+ 2 ml FBS(20%)+0. 01 g 肝素钠(10 mg/mL)+0. 0044 g 乳酸钙(2 mM)
受精液10 ml:8 ml SOF 液+ 2 ml FBS(20%)+0.005 g肝素钠(5 mg/mL)+0.0011 g乳酸钙(0.5 mM)
胚胎培养液10 ml:10 ml SOF 液+0. 1 ml NEAA(1%)+0. 2 ml EAA(2%)+0. 005 g 肌醇(2. 77 mM)+0. 05 ml 200 mM L-谷氨酰胺(1 mM)+0. 06 g BSA(6 mg/mL)+0. 0004 g 葡萄糖(0. 25 mM)+0. 1 ml PS(1%)
1.1.3 主要仪器
二氧化碳培养箱(型号:MC0-15A),日本三洋公司制造;高压灭菌锅(型号:SX-500),日本TOMY 公司制造;倒置荧光显微镜(型号:TS100-FNikon),尼康公司制造;超净工作台(SWCJ-2FD),博讯公司制造;台式高速冷冻离心机(型号:Sigma 3K30),Sigma公司制造。
1.2 方法
1.2.1 离体卵巢采集
绵羊卵巢采自阿克苏市屠宰场。阿克苏地区成年母羊屠宰后立即取下双侧卵巢,用75%乙醇喷洗,放入37 ℃灭菌(加双抗)生理盐水中2~3 h 内运回实验室。
1.2.2 卵丘-卵母细胞复合体(COCs)采集
采用切割法收集卵母细胞。采集发情季节绵羊卵巢,用75%乙醇快速清洗3 遍,37 ℃无菌生理盐水中清洗3遍。在无菌培养皿中,用手术刀片划破卵泡后用装有采卵液的注射器冲洗卵泡腔,使卵母细胞流入采卵液中。沉淀数分钟,在体式显微镜下捡卵[11]。
1.2.3 COCs选择
在体视显微镜下选择A、B 级COCs 进行成熟培养。A级卵母细胞要求有颗粒细胞3层以上,且紧密包围卵母细胞颗粒细胞扩张充分;B 级要求卵母细胞胞质均匀,颗粒细胞少于等于3层大于2层。
1.2.4 COCs成熟培养
采用微滴培养法。在无菌环境下制作成熟培养微滴,将挑选A、B 级COCs 用IVM 液清洗3 遍转入预先平衡好的微滴中,每个微滴放入30 枚COCs。在二氧化碳恒温培养箱中以5%CO2、38.5 ℃、饱和湿度培养24 h,观察卵丘的扩散,并做好记录。
1.2.5 观察第一极体排出情况
成熟培养24 h 用自制口吸管将COCs 转移至含0.1%透明质酸酶的PBS 中,200µL 移液枪反复吹打至COCs 周围颗粒细胞脱落露出透明带,在IVF 液中洗三遍,放置体视镜下用细玻璃管拨动卵母细胞观察第一极体排出情况,记录排出第一极体的卵母细胞数。
1.2.6 颗粒细胞培养
用胚胎发育液在35 mm 培养皿中制作70 µL的微滴(石蜡油覆盖,CO2培养箱中平衡2 h 以上)。将透明质酸酶脱离的颗粒细胞接种至微滴中,在38.5 ℃、5% CO2、100%湿度的二氧化碳恒温培养箱中培养。
1.2.7 精子上游
电刺激采集绵羊精液,1:4的比例添加稀释液,按照昆仑一号说明书操作步骤进行稀释。取0.5 mL稀释精液缓慢注入含1 mL 精子获能液的离心管底部,倾斜45°,置于38.5 ℃、5%CO2、100%湿度的恒温培养箱内孵育30 min,取上清液1 mL,800 ×g 离心5 min,弃上清液,重复一次。
1.2.8 体外受精
脱去颗粒细胞的成熟卵母细胞,用受精液清洗3次后放入50µL 覆盖有石蜡油的受精液微滴中,单个微滴最多15 枚COCs。取上游精液加入受精微滴中(精子密度大约为1×106个/mL),在38.5 ℃、5%CO2、100%湿度的二氧化碳恒温培养箱中精卵共孵18 h。
1.2.9 胚胎体外培养
预先平衡70µL 胚胎发育液,将受精后的受精卵放入胚胎发育液中洗掉周围精子后放入发育液中,颗粒细胞与受精卵于CO2恒温培养38.5 ℃、5%CO2、100%湿度共孵,24 h记录卵母细胞卵裂数。每隔2 d进行一次半量换液,胚胎发育第4 d 解除颗粒细胞与胚胎共孵培养,144 h统计桑椹胚的数量。
1.2.10 统计分析
每个试验组都重复3次,所有数据采用SPSS17.0统计软件的单因素方差分析进行显著性检验,LSD多重比较差异,以P<0.05为差异显著性判断标准,结果用平均值±标准差表示。
成熟率=成熟COCs总数/COCs总数×100%
卵裂率=卵裂卵母细胞总数/成熟COCs总数×100%
桑椹胚率=桑椹胚总数/成熟COCs×100%
2 结果与分析
2.1 不同浓度LH对COCs成熟率的影响
本试验将卵丘扩散疏松(如图1-A 所示),第一极体排出胞质均匀的COCs(如图1-B 所示),记为成熟COCs。不同浓度LH 成熟培养液中成熟情况见表1。由表1 可见,C 组COCs 的成熟率显著高于其它组(P<0.05),B、D、E 组COCs 的成熟率差异不显著(P>0.05)。

表1 不同浓度的LH 对COCs成熟率的影响
2.2 不同浓度LH对卵裂率的影响
成熟卵母细胞卵裂率见表2。由表2 可见,C 组培养成熟的COCs 其卵裂率显著高于其它各组(P<0.05),B、D、E各组间差异不显著(P>0.05)。
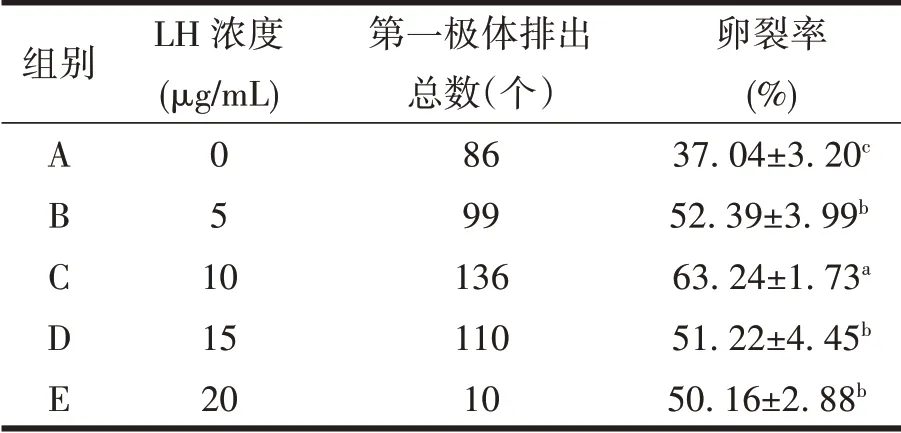
表2 不同浓度的LH对卵裂率的影响
2.3 不同浓度的LH对桑葚胚率的影响
桑椹胚见图2-C,卵裂后桑椹胚发育情况见表3。由表3 可见,C 组培养成熟的COCs 显著高于其它各组(P<0.05),D、E组间无显著差异(P>0.05)。
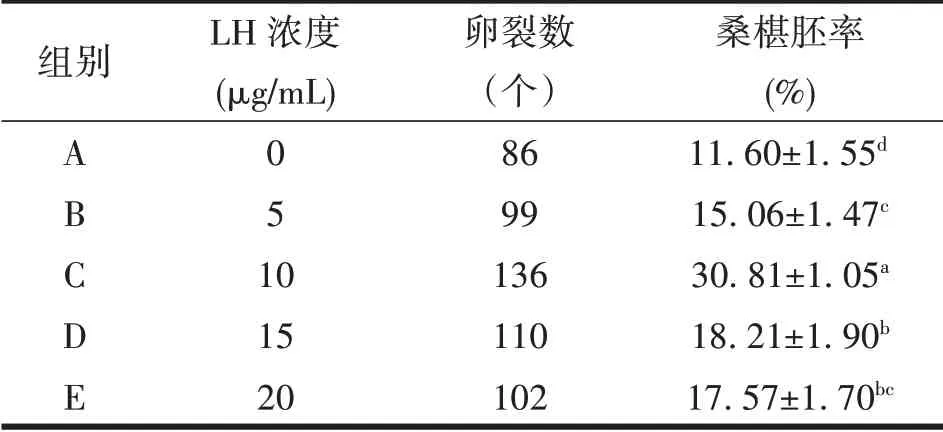
表3 不同浓度的LH对桑葚胚率的影响

图1 卵母细胞成熟

图2 桑椹期胚胎
3 讨论
Figueiredo 等[12]认为小于8 mm 的牛卵泡中,颗粒细胞只表达FSHR mRNA ,而没有LHR mRNA 表达,故单独添加不同浓度的LH 不能提高卵母细胞的成熟。但Fu 等[13]利用RT-PCR 及原位杂交技术发现FSH 刺激的卵母细胞减数恢复与颗粒细胞上的LHR mRNA 表达密切相关,单独添加LH 对小鼠卵母细胞减数分裂起始无影响。胡艳明等[14]在成熟培养液中单独添加10µg/mL 的LH 时,延边黄牛卵母细胞体外成熟率和卵裂率分别为80. 6%和79. 8%,其成熟率显著高于添加0 µg/mL、5 µg/mL、15 µg/mL、20 µg/mL,与本试验含10 µg/mL FSH 添加10 µg/mL LH 所得成熟率76. 60%基本相近。本试验基础成熟液中含10 µg/mL 的FSH,结果表明添加10 µg/mL 的LH,卵母细胞的成熟率最高且显著高于其他添加浓度,而成熟率的提高是否与LHR mRNA 的表达相关需要进行分子试验验证。FSH和LH在卵母细胞成熟过程中具有协同作用,本试验未探究FSH 和LH 添加比例对卵母细胞成熟的影响,仅在添加10 µg/mL FSH 的基础上添加不同浓度的LH,王娟等[15]在滩羊卵母细胞成熟培养时同时添加40 µg/mL LH 和200 µg/mL FSH 成熟率达到68.8%,FSH 和LH 的添加浓度均高于本试验10µg/mL LH 和10µg/mL FSH,原因可能是激素的生产厂家不同其纯度会有所差异,使得激素的添加浓度差异较大。杨恕玲等[16]认为20µg/mL LH是滩羊卵母细胞体外成熟的最佳添加剂量,较本试验得出10 µg/mL 最佳添加剂量较高,原因可能是阿克苏地区绵羊与滩羊品种不同。潘文平等[17]在山羊卵母细胞体外成熟培养试验中用LH 处理后卵母细胞成熟率显著高于未添加组。因此,添加LH 能提高COCs 的成熟、卵裂率及桑椹胚率。且本试验结果表明添加10µg/mL LH 能显著提高卵母细胞成熟率、卵裂率及桑椹胚率。
Chebrout 等[18]认为颗粒细胞的扩散程度能够反映出卵母细胞的成熟情况。孙桂金[19]和周佰成[20]认为10 µg/mL FSH/LH 为绵羊卵母细胞体外成熟的最适添加浓度,与本试验最适添加浓度一致,但在孙桂金[19]的试验中绵羊卵母细胞的成熟率为68.60%,与本试验成熟率(77.71%)相比较低,其原因可能是采集的卵母细胞质量不同而造成的差异。李凯等[6]添加10µg/mL 的LH 时绵羊的卵裂率显著高于对照组,与本试验结果一致。卫恒习[8]认为添加LH 对绵羊的卵裂率无明显作用,造成差异的原因可能是:一是成熟培养液中其他添加物质不相同,二是成熟卵母细胞的质量和精子活力造成差异。LH能够提高卵母细胞的受精率和卵裂率,原因是LH 具有暂时性抑制生发泡的破裂,延迟卵母细胞核成熟的作用,使卵母细胞有更长的时间来完成胞质成熟[21],LH 同时关闭卵母细胞和颗粒细胞之间的缝隙连接,使卵母细胞从减数分裂抑制的状态中解除出来[22]。卵母细胞的成熟质量决定着后期受精和胚胎发育情况。
4 结论
在含有10 µg/mL FSH 的TCM199 成熟培养液中添加10µg/mL LH 的绵羊卵母细胞的成熟率、受精率和卵裂率均显著高于其他添加组(P<0. 05)。LH 浓度为10µg/mL 时对绵羊卵母细胞体外成熟及受精发育效果最好。
