miR-78抑制心肌部分梗死模型大鼠心肌纤维化机制探讨*
2019-12-27赖增华颜春菊吴淑静窦学凯范长青魏梅娟
赖增华,颜春菊,吴淑静,窦学凯,范长青,魏梅娟
(1.中国人民解放军第一七四医院·厦门大学附属成功医院心内科,福建 厦门 360001; 2.中国人民解放军第一八〇医院心内科,福建 泉州 362000)
心肌梗死从发病机制来看最明显的特征是胶原积累,胶原主要由心肌成纤维细胞合成,可导致心肌梗死后纤维化。胶原蛋白在健康心脏中表达水平较低,但在梗死部位和外周带心肌梗死部位表达增加[1]。陈璐等[2]的研究中,在大鼠心肌梗死后第7天,可清楚地观察到梗死部位心肌纤维化,导致心脏功能障碍。潜在的心肌纤维化检测和评估技术已有报道,如超声背散射[3]。心肌纤维化的新治疗方法,尤其是干细胞移植策略[4]已引起关注,且相关的分子机制如C3G蛋白作用机制也已被揭示[3],但仍需更多关于心肌梗死和纤维化的详细信息。GATA-4是心脏发育的重要调控因子[5],可通过激活不同基因介导心脏肥大[6]。各种肥厚性刺激,可激活GATA-4在心肌细胞的表达[7]。GATA-4在低氧损伤和心肌缺血或再灌注损伤时调节心肌细胞的抗凋亡信号通路中也有重要作用[8],已被认为是治疗缺血性心脏病的一个潜在治疗靶点[9]。microRNA是由基因组编码的短 RNA,通过与mRNA的3′非翻译区(UTR)的结合抑制翻译或促进mRNA的降解[10]。单个微小RNA可识别各种靶mRNA,单个mRNA可同时与多个微小RNA结合,构成精细调节系统。microRNAs对GATA-4的调控作用在心肌梗死和纤维化中的作用如下miR-200c的下调通过靶向GATA-4保护心肌细胞免受缺氧诱导的凋亡[11];miR-122的下调导致GATA-4表达增强,从而抑制缺氧/复氧诱导的心肌细胞凋亡[12]。进一步研究对GATA-4具有调控作用的miRNA,对于治疗心肌梗死和心肌纤维化具有重要意义。目前关于microRNA-78(miR-78)的研究较少,经预测分析发现,其可能作用于GATA-4。本研究中探讨了miR-78对GATA-4的可能作用机制,以及该作用对心肌部分梗死模型大鼠心肌纤维化的影响。现报道如下。
1 材料与方法
1.1 动物、仪器与试药
动物:SD大鼠60只,28~32周龄,体质量(250±20)g;新生大鼠10只,雌雄各半。在24℃、50%相对湿度条件下饲养7 d。自由饮食饮水。本实验经本地动物实验伦理委员会批准,且根据条例规定进行。
仪器:超声心动仪(10S探头,图像深度2~4 cm,频率11.4 MHz);FACSCanto流式细胞仪(美国BD公司)。
试药:硫酸阿托品注射液(上海禾丰制药有限公司,国药准字 H31021057,规格为每支2 mL∶10 mg);胰蛋白酶(货号25300054)、DMEM/F12培养基(货号11330057,含胎牛血清)均购自美国Gibco公司;磷酸二酸乙酯缓冲液;苯胺蓝;慢病毒悬浮液;Lipofectamine 2000 转染液(货号 11668019)、TRIzol裂解液(货号1559602),均购自美国Invitrogen公司;BCA蛋白检测试剂盒(上海碧云天生物技术有限公司,货号P0012S);一抗(抗 COL1、抗 ACTA2和抗 GATA4),均购自美国Abcam 公司(批号分别为 ab96723,ab5694,ab84593)。
1.2 方法
分组与建模:将60只SD大鼠随机分为手术组(45只)和假手术组(15只)。手术组大鼠用乙醚麻醉,腹腔注射氯胺酮注射液(75 mg/kg);注射硫酸阿托品注射液(上海禾丰制药有限公司,国药准字H31021057,规格为每支 2 mL ∶10 mg)20 μg/kg,以减少呼吸道分泌物。大鼠连置术台后,连接心电图和呼吸机(呼吸速率为80 次 /分,吸气呼气比为 1 ∶2,潮气量为 18 mL/kg)。打开胸膜,暴露心脏,左前降支(LAD)与普洛林和针头(直径0.5 mm)结扎,然后用碘伏封闭和消毒胸部和皮肤,大鼠心脏复苏后取出呼吸机,术后10 min心电图J点升高表明心肌梗死模型建立。假手术组大鼠进行上述除结扎步骤外的所有手术。为了预防感染,所有大鼠均在手术后3 d内注射青霉素。
心肌纤维细胞培养:新生大鼠麻醉,心脏采血。将心脏标本切成约每片1 mm3,在37℃下用胰蛋白酶消化15 min,然后收集细胞,置含有胎牛血清的DMEM/F12培养基中,在37℃、5%CO2条件下培养。90 min后取出细胞悬液,收集贴壁细胞进行培养。当纯度达95%时,用抗波形蛋白、抗血管性血友病因子、抗结蛋白检测心肌成纤维细胞的纯度。
慢病毒转染:由GenePharma公司设计和构建慢病毒过表达miR-78前体和空白慢病毒。慢病毒注入模型大鼠的冠状动脉。大鼠饲养4周后取样和检测。在细胞转染中,将细胞在24孔板(密度1×105/孔)中预培养24 h,用6 μg/mL聚溴胺和慢病毒悬浮液处理,培养24 h,后更换新鲜培养基,培养48 h后用流式细胞仪检测转染效率。
心肌功能评价:术后14 d,麻醉大鼠,超声心动图检测左室缩短率(LVFS)和左室射血分数(LVEF)。每组3只大鼠,采样;其余心脏标本切片,置4%多聚甲醛中固定8 h,石蜡包埋,切成6 μm切片,用Masson染色法进行染色;然后将玻片染色,苏木精染色7 min,浸入1%盐酸30 s,用胭脂红染色5 min,浸入磷酸二酸乙酯缓冲液和苯胺蓝中各5 min,再浸入磷酸二酸乙酯缓冲液中1 min;乙酸脱1 min,将玻片与中性香脂结合,用光学显微镜观察。随机选取3个视觉点,用QWIN软件计算梗死面积。
荧光素酶试验:使用Multi Site-Directed试剂盒对GATA4 3′非翻译区(UTR)的结合位点进行突变。然后将突变型或野生型GATA4 3′UTR连接到pGL3-basic载体,在12孔板转染心肌纤维细胞(密度3×104个/孔)。载体phRL-TK作为内参被共同转染。以聚合酶测定荧光素酶活性。
siRNA转染:通过转染siRNA或siRNA对照来进行GATA4的特异性敲低,使用转染剂Lipofectamine 2000培养心肌纤维细胞,转染前将细胞预培养于24孔板中(密度1×105/孔)24 h,转染后于无血清培养基中培养,转染后36 h收集转染细胞进一步分析。
实时定量聚合酶链反应(RT-PCR):分别于建模后1,2,4 周采集大鼠心肌梗死区(I)和梗死边缘区(B)。收集siRNA转染的细胞。总RNA提取用TRIzol裂解液,miRNA提取用小核糖核酸的RNAiso。采用PrimeScript First链cDNA合成技术进行反转录,扩增条件见表1,引物设计见表2,反应体系见表3。以U6和GAPDH为内参。数据采用2-△△Ct方法进行分析。

表1 RT-PCR反应条件

表2 RT-PCR引物序列设计
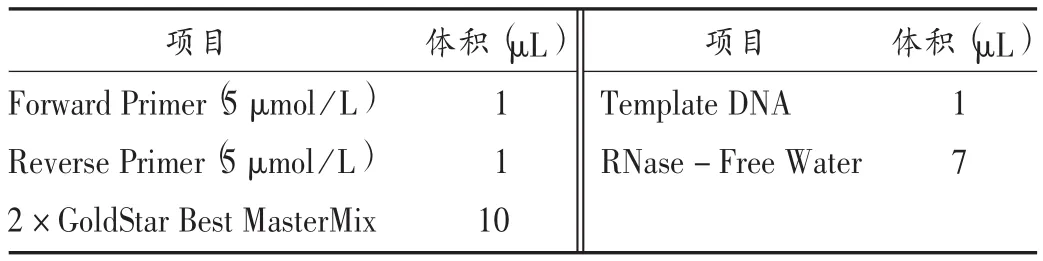
表3 RT-PCR反应体系
蛋白质印迹试验:在模型诱导和转染细胞2周后收集I区的组织样品进行蛋白质提取。用RIPA裂解液对蛋白样品进行裂解,并用BCA蛋白检测试剂盒定量。用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,加样量为每孔20 μg。凝胶上的蛋白条带被转移到二氟乙烯薄膜上,然后在室温下以5%的脱脂牛奶封闭2 h。一抗中孵育4℃过夜,然后在辣根过氧化物酶结合的二级抗体中室温下持续孵育1 h。以ECL显影液进行显影,并用Image J软件进行分析,以GAPDH作为内参。
1.3 统计学处理
采用SPSS 20.0统计学软件分析。计量资料以表示。组间比较行单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 miR-78表达水平在心肌梗死的心脏中降低
术后1,2,4周检测miR-78的变化,结果见表4。与假手术组相比,手术组I区和B区的miR-78表达水平均显著降低(P<0.05)。术后2周表达水平降低最明显,术后4周表达水平略有升高(I区比B区降低得更严重,这表明心肌梗死组织中miR-78减少)。
表4 术后心肌梗死组织中miR-78的表达水平(±s)

表4 术后心肌梗死组织中miR-78的表达水平(±s)
组别 第1周 第2周 第4周假手术组手术组I区手术组B区F值P 0.99±0.03 0.58±0.01 0.62±0.02 54.22<0.05 1.01±0.04 0.46±0.03 0.60±0.01 49.02<0.05 1.00±0.05 0.85±0.06 0.91±0.07 54.02<0.05
2.2 miR-78过表达缓解心肌梗死损伤
转染miR-78前体,premiR-78过表达。并在手术和转染后 2周进行验证(见表5)。RT-PCR结果显示,premiR-78组miR-78表达水平显著高于转染对照组(P<0.05),表明miR-78成功过表达,转染样品适合进一步检测。
转染对照组梗死面积约为50%,在miR-78过表达后,梗死面积明显减少至30%(P<0.05,见表5)。假手术组LVEF约为60%,术后降至20%(P<0.05),详见表 6;随着 miR-78的高表达,LVEF增至 30%(P<0.05)。同样,假手术组LVFS由手术前的30%左右减少到手术后的15%左右(P<0.05),详见表6。miR-78明显恢复(P<0.05),表明miR-78过表达可减轻心肌梗死程度。
表5 miR-78表达及梗死面积(±s)
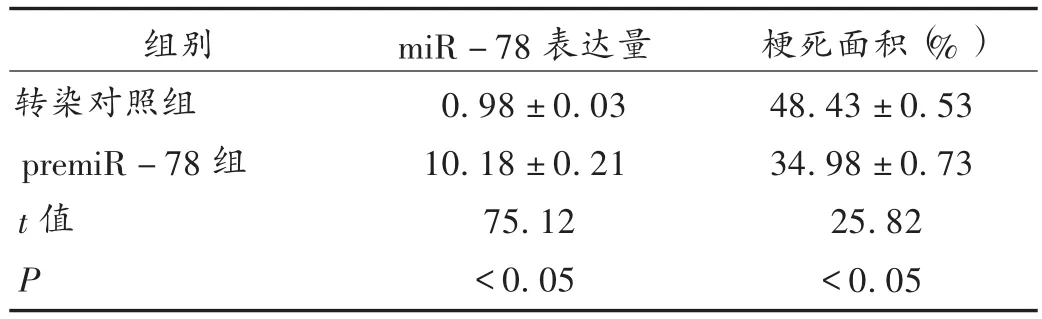
表5 miR-78表达及梗死面积(±s)
组别转染对照组premiR-78组t值P miR-78表达量0.98±0.03 10.18±0.21 75.12<0.05梗死面积(%)48.43±0.53 34.98±0.73 25.82<0.05
2.3 miR-78对COL1A1和ACTA2的抑制作用
由于在诱导心肌梗死的模型中,miR-78能改善心功能,减少梗死面积,因此本研究中进一步探索miR-78是否影响COL1和ACTA2等纤维化相关因子的表达。经Western印迹法检测,心肌梗死诱导后COL1和ACTA2 mRNA水平显著升高(P<0.05),而miR-78过表达时两者均受到抑制(P<0.05),详见图1和表7。上述2个因子的蛋白表达水平显示一致的变化模式,表明miR-78可能抑制COL1A1和ACTA2的表达,进一步抑制COL1和ACTA2蛋白的合成,从而减轻梗死后的心肌纤维化程度。
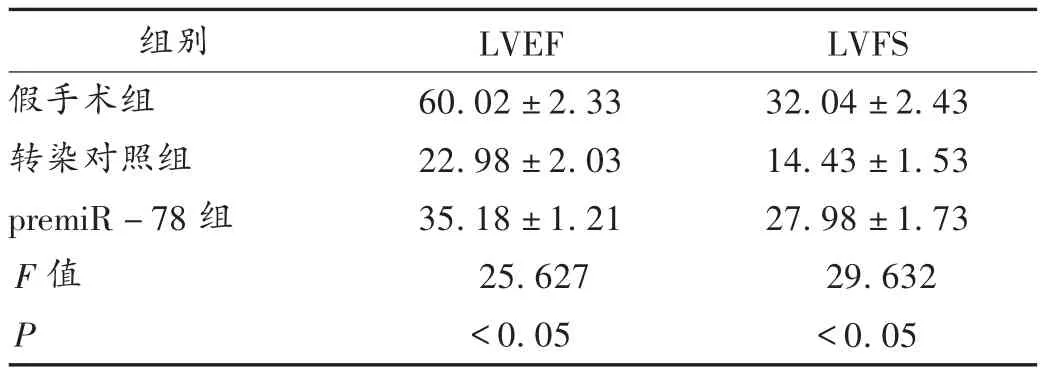
表6 心肌梗死手术后LVEF和LVFS的水平(X ± s,% )

图1 COL1A1和ACTA2蛋白表达水平
表7 COL1A1和ACTA2蛋白表达水平(±s)
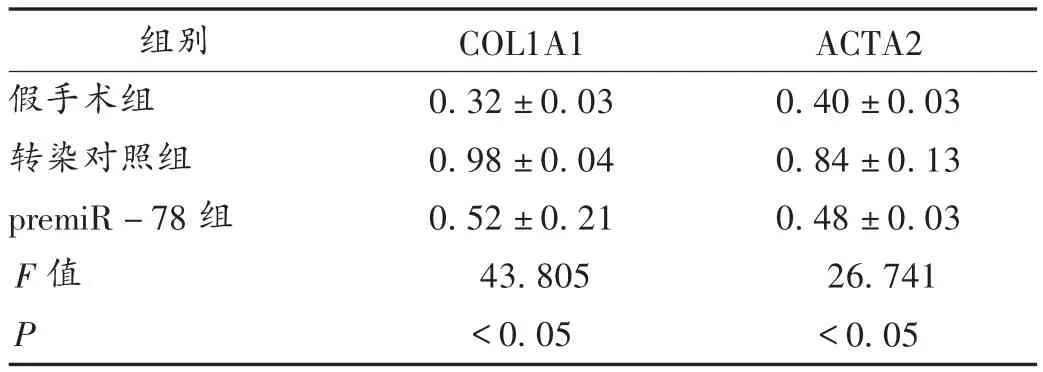
表7 COL1A1和ACTA2蛋白表达水平(±s)
组别假手术组转染对照组premiR-78组F值P COL1A1 0.32±0.03 0.98±0.04 0.52±0.21 43.805<0.05 ACTA2 0.40±0.03 0.84±0.13 0.48±0.03 26.741<0.05
2.4 miR-78对GATA4的抑制作用
利用在线数据库TargetScan,GATA4被作为miR-78的靶基因,用野生型和突变型GATA43′UTR(图2和表8)的双荧光素酶试验在培养的心肌成纤维细胞中证实了这一点。miR-78与 WT-GATA4 3′UTR的位置 1363至1369结合,但不与MUT-GATA4 3′UTR结合。据预测,miR-78过表达可抑制WT-GATA4 3′UTR载体的荧光素酶活性。然而,当靶序列发生突变(mut-GATA4 3′UTR)时,miR-78的过表达对荧光素酶活性影响不显著(P>0.05),详见表 8。这些结果表明,GATA4 是 miR-78的直接靶标,其3′UTR序列GUCUUA为相互作用位点。miR-78的高表达导致GATA4蛋白表达下调(P<0.05),表明miR-78能直接与GATA4结合抑制其表达。
基于miR-78在抑制中的作用分析心肌纤维化的相关因素、GATA4与上述因素的关系,以验证miR-78是否通过GATA4起作用,在此之前,GATA4被小干扰RNA(si-GATA4)抑制,并检测其情况,详见表 9。结果显示,si-GATA4组与对照组相比,能显著降低GATA4 mRNA表达水平(P<0.05)。然后在这些细胞样本中检测发现,当GATA4被抑制时,COL1和ACTA2的蛋白水平均被抑制(图3)。上述结果提示,miR-78可直接抑制GATA4,并能抑制纤溶相关因子COL1和ACTA2的表达,这可能是miR-78在心肌梗死后纤维化中的调节机制。
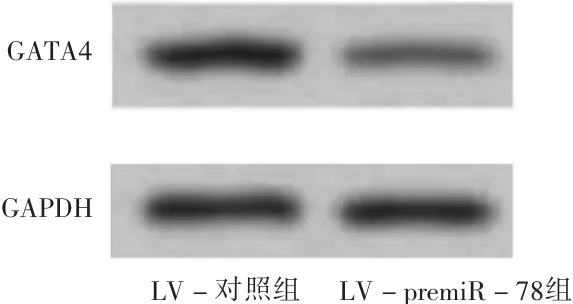
图2 GATA4蛋白表达水平
表8 GATA4蛋白表达水平(±s)

表8 GATA4蛋白表达水平(±s)
组别转染对照组premiR-78组t值P GATA4 0.76±0.21 0.34±0.15 2.819<0.05

图3 COL1和ACTA2蛋白表达量
表9 COL1和ACTA2蛋白表达水平(±s)
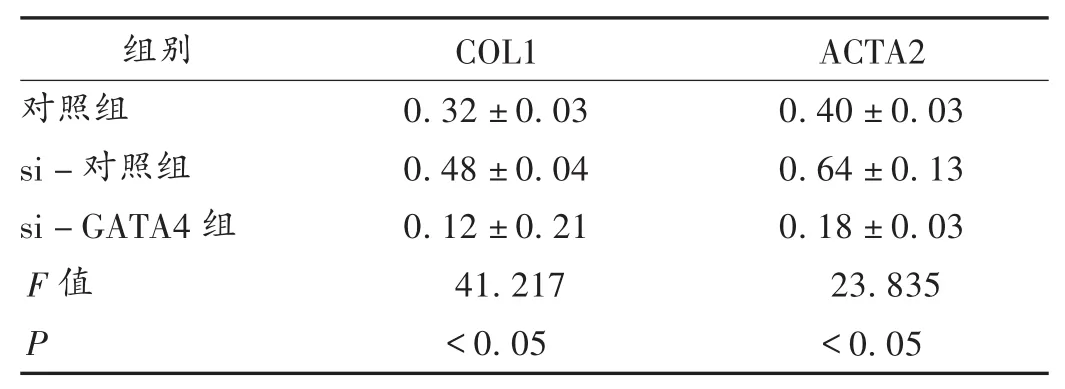
表9 COL1和ACTA2蛋白表达水平(±s)
组别COL1ACTA2对照组si-对照组si-GATA4组F值P 0.32±0.03 0.48±0.04 0.12±0.21 41.217<0.05 0.40±0.03 0.64±0.13 0.18±0.03 23.835<0.05
3 讨论
本研究发现,miR-78在心肌梗死大鼠模型心脏中表达下调,并揭示其在心肌梗死后心肌纤维化的调节作用。进一步的分析显示,miR-78可能的靶向区域为GATA4 3′UTR,从而降低GATA表达水平,进而可能抑制梗死后心肌纤维化的进展。
本研究中采用2种纤维化相关因子COL1和ACTA2作为心肌纤维化指标。COL1由α1链(由COL1A1编码)和α2链(由COL1A2编码)组成的三螺旋组成。它通常被用作各种疾病中纤维化的标志,包括心肌纤维化。正常大鼠心脏COL1水平较低,但诱导心肌梗死后COL1水平升高[13]。本研究结果表明,心肌梗死诱导后I区COLLA1和蛋白COL1表达水平均升高,表明心肌纤维化加重。miR-78的过表达抑制COL1A1转录和COL1合成。ACTA2在二联症中也被证明与纤维化高度相关[14-15],在心肌梗死后可促进其mRNA和蛋白质水平的升高,该状况可被miR-78过表达所抑制。可见,由于miR-78的过度表达可降低与纤维相关的因素COL1和ACTA2的高表达水平从而抑制了心肌纤维化。
GATA4是重要的转录调控因子,可调节心脏发育过程和疾病相关基因[16],是心肌细胞肥大和纤维化的重要指标。人 GATA4与 DNASiⅠ超敏位点结合COL1A2基因可下调COL1A2的表达[17]。本研究结果表明,miR-78过表达抑制了GATA4,这也与下调的si-GATA4心肌成纤维细胞中的COL1和ACTA2有关。与miR-78过表达对心肌纤维化的保护作用一致,表明GATA4在梗死后心肌纤维化中具有促进作用。然而,GATA4在其他细胞类型或组织,如胎鼠肝间充质细胞中可能起着不同的作用,其中GATA4敲除导致了晚期肝纤维化[18]。本研究中,GATA4对心肌纤维化的作用是通过COL1和ACTA2实现的,但在其他细胞中可能通过其他因素发挥作用。本研究中发现,miR-78在心肌梗死后心脏的I区和B区表达下调,而在心肌梗死后血浆中表达上调。miR-78表达水平的升高可作为急性心肌梗死后心肌损伤和左心室重构的生物标志物。心肌成纤维细胞水平的降低和血浆水平的升高可能是由细胞释放miR-78所致。血浆中microRNA的存在除了在人类之外,还存在于各种动物物种中,且来源于循环血细胞和其他受疾病影响的细胞[19]。细胞通过外来体、微泡或蛋白复合体选择性地将一些早熟和成熟的microRNAs释放到血液[20]。从这个角度来看,本研究中的下调miR-78表达与其在血浆中的上调表达并不矛盾。故可推测,在心肌梗死期间,miR-78向血浆的释放可能会增加。
心肌梗死时细胞内miR-78表达水平的变化是否与其转录活性或细胞释放活性有关尚不清楚,有待进一步研究。但miR-78的保护作用不可否认。除了在心血管疾病中的作用外,本研究中还进一步证实其在心肌梗死期间具有抗纤维化功能,从而减少对心脏的损害。目前已有大量报道指出microRNA是疾病可能的治疗靶点[19-21],miR-78的潜在应用可能是减轻梗死后心肌纤维化的一种替代方法。
综上所述,miR-78可抑制心肌梗死大鼠心肌纤维化,作用机制可能为下调GATA4表达,从而下调COL1和ACTA2的表达。
