冠心病患者氯吡格雷低反应性与CYP2C19基因多态性的相关性研究
2019-12-27胡程艳李静刘志
胡程艳,李静,刘志
冠状动脉粥样硬化性心脏病(冠心病)是动脉粥样硬化导致器官病变最常见的类型,抗血小板是其治疗不可或缺的手段,目前氯吡格雷联合阿司匹林双联抗血小板是治疗、预防冠心病缺血事件发生,改善急性冠脉综合征(ACS)和经皮冠状动脉介入治疗(PCI)临床预后的标准方案,但仍有4%~30%的患者在标准剂量治疗中,无法达到预期的抗血小板疗效[1],同时还可能出现支架内血栓形成、支架内再狭窄,甚至临床死亡等心血管不良事件。血小板对氯吡格雷缺乏反应或反应降低称为氯吡格雷抵抗(CPGR)[2,3]。目前国际上对于CPGR尚缺乏统一标准,Muller等[4]定义CPGR指给予600 mg氯吡格雷负荷剂量4 h后,对于ADP诱导的血小板聚集率较基线相比降低小于10%,降低10%~29%为半抵抗,抑制>30%为正常反应。氯吡格雷是一种前体药物,本身无活性,约15%的药物在肠道内被吸收后经肝脏内P450系列酶代谢后,转化为具有抗血小板活性的代谢产物发挥作用。其中CYP2C19基因编码的蛋白酶是影响氯吡格雷代谢的关键酶[5],大部分科研人员认为CYP2C19基因在氯吡格雷激活中起到关键作用[6,7],但也有研究表明[8,9],CYP2C19基因多态性与氯吡格雷抵抗无明显关联性。血栓弹力图(TEG)是凝血功能检测方法之一,可通过对血液中的凝血、血小板聚集、纤溶等变化进行全过程动态监测,并且以具体的血小板抑制率来全面、准确反映患者对氯吡格雷药物的反应性,从而指导临床用药降低心血管事件的发病率及死亡率[10]。本研究通过对氯吡格雷患者的血栓弹力图检测的血小板抑制率结果及CYP2C19基因多态性进行分析,探讨二者的相关性,以便指导临床用药。
1 资料与方法
1.1 研究对象入选2015年3月至2018年9月于首都医科大学宣武医院心脏科确诊为冠心病并服用氯吡格雷的患者680例,其中男性489例,平均年龄(60.97±11.06)岁,女性191例,平均年龄(68.40±11.55)岁。纳入标准:①入院明确诊断冠心病;②治疗方案为口服300 mg或600 mg氯吡格雷>1 d或规律氯吡格雷75 mg/d>4 d[11];③规范氯吡格雷或氯吡格雷联合阿司匹林治疗后,所有患者均同期接受CYP2C19基因和TEG检测。排除标准:①血小板计数>450×109/L或<100×109/L;②术前两周使用其他口服抗血小板药物;③阿司匹林或氯吡格雷使用禁忌证;④严重肝脏疾病或凝血功能异常者;⑤合并肿瘤、免疫系统疾病、严重贫血、感染性疾病等;⑥血栓弹力图检测前正在应用替罗非班或停用时间<10 h。收集患者基线资料及各项检测指标。
1.2 给药方法根据患者病情,如急诊PCI患者术前给予负荷剂量氯吡格雷300 mg+阿司匹林300 mg,次日起服用维持剂量氯吡格雷75 mg/d+阿司匹林100 mg/d;择期PCI患者给予氯吡格雷75 mg/d+阿司匹林100 mg/d,服用时间至少4 d以上。或术后规律服用氯吡格雷75 mg/d+阿司匹林100 mg/d双联抗血小板治疗至少1年以上。
1.3 血栓弹力图检测血小板抑制率方法明确患者服用300 mg或600 mg氯吡格雷>1 d或规律氯吡格雷75 mg/d治疗>4 d,采集清晨空腹静脉血2~3 ml,利用血栓弹力图凝血分析仪及配套试剂,包括高岭土、激活剂F(由蝮蛇血凝酶和血小板Ⅺ-Ⅱa因子混合而成)及ADP(2 μmol/L),通过 TEG软件以ADP为激活物测定氯吡格雷的抗血小板抑制率。根据相关研究[12,13]和产品说明,将血小板ADP受体抑制率<30%定义为氯吡格雷低反应性(CLR),血小板抑制率≥30%为正常反应性。
1.4 CYP2C19基因型检测方法采集患者清晨空腹静脉血2 ml(EDTA Na2抗凝),提取基因组DNA。用CYP2C19基因检测试剂盒(DNA微阵列芯片法),通过聚合酶链式反应(PCR)扩增,杂交显色,反应结束后,读取生物芯片,用BaiO基因芯片图像分析软件进行图像扫描和数据分析,得出检测结果。根据基因检测结果分三组:快代谢(野生型纯合子型CYP2C19 *1*1);中等代谢(野生型与突变基因杂合子型CYP2C19*1*2、CYP2C19 *1*3);慢代谢(突变基因纯合子与杂合子型CYP2C19 *2*2、CYP2C19 *2*3 、CYP2C19 *3*3)三组。
1.5 统计学处理采用SPSS 22.0软件进行统计分析,正态分布的计量资料以(±s)表示,组间比较采用t检验;计数资料用百分比率表示,定性资料组间比较采用卡方检验。非正态分布的计量资料用中位数(P25,P75)表示,采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 患者一般资料比较氯吡格雷正常反应组与氯吡格雷低反应组间患者年龄、体质指数(BMI)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、高血压、糖尿病、肌酐、糖化血红蛋白等之间均无统计学差异(P>0.05),而性别、吸烟史、饮酒史、血小板计数、高脂血症、谷草转氨酶、谷丙转氨酶、三酰甘油及CYP2C19基因型等指标间有统计学差异(P<0.05)(表1)。
2.2 不同CYP2C19基因型患者的血小板抑制情况不同CYP2C19基因型患者的血小板抑制情况对不同CYP2C19基因型间的血小板抑制率采用单因素方差比较,差异有统计学意义(P<0.05);680例患者中快代谢型(CYP2C19*1*1)有297例(43.7%);其中CLR者111例(37.4%)。中等代谢型中CYP2C19*1*2者265例(38.9%),CYP2C19*1*3者43例(6.3%);其中CLR者148例(48.1%)。慢代谢型中CYP2C19*2*2者57例(8.4%),CYP2C19*2*3者16例(2.3%),CYP2C19*3*3者2例(0.3%);其中CLR为47例(62.7%)(表2)。
表1 两组患者一般资料比较(±s)
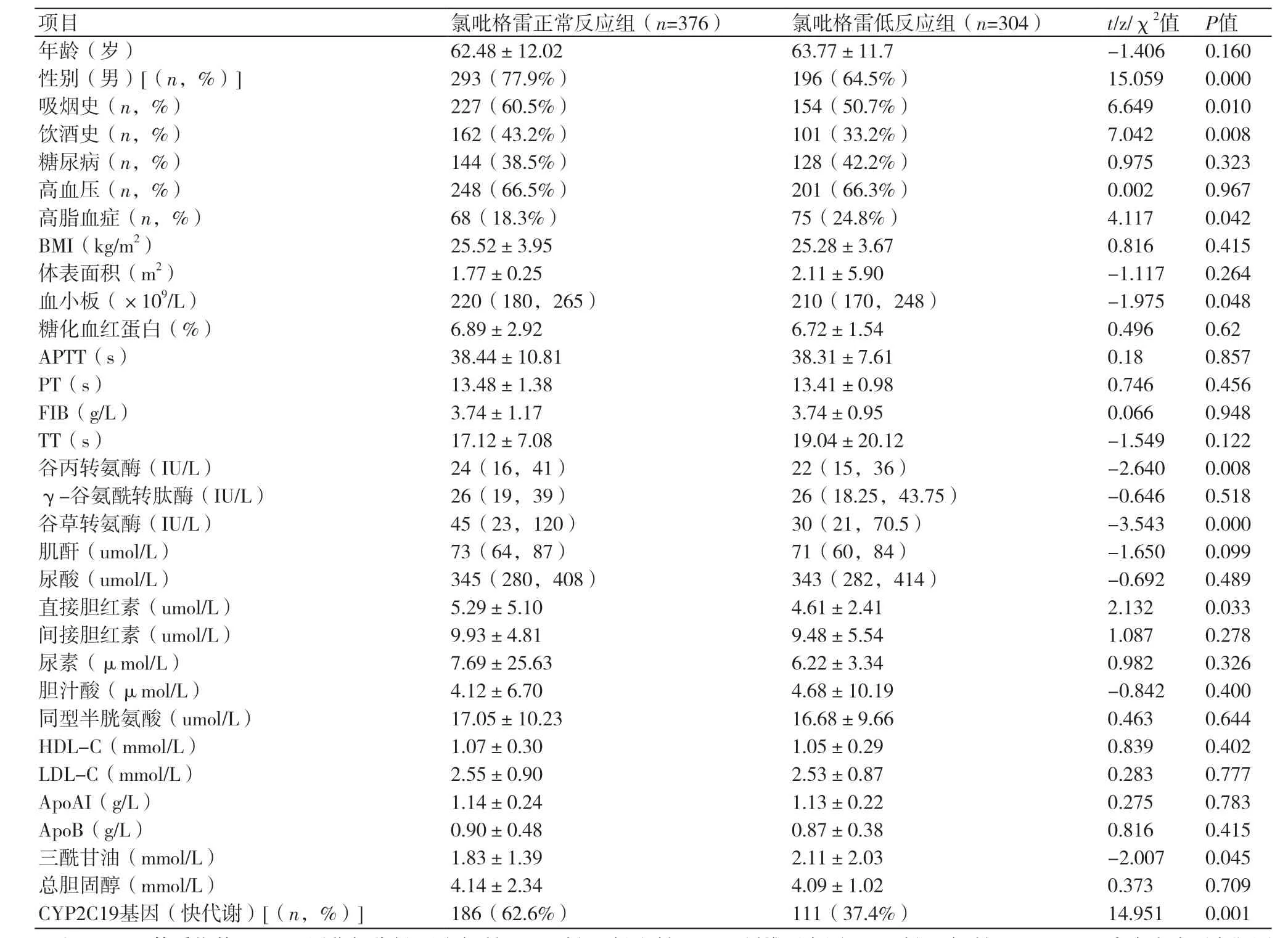
表1 两组患者一般资料比较(±s)
注:BMI:体质指数;APTT:活化部分凝血活酶时间;PT:凝血酶原时间;FIB:纤维蛋白原;TT: 凝血酶时间;HDL-C:高密度脂蛋白胆固醇;LDL-C:高密度脂蛋白胆固醇;ApoAI:载脂蛋白-AI;ApoB:载脂蛋白-B
项目 氯吡格雷正常反应组(n=376) 氯吡格雷低反应组(n=304) t/z/χ2值 P值年龄(岁) 62.48±12.02 63.77±11.7 -1.406 0.160性别(男)[(n,%)] 293(77.9%) 196(64.5%) 15.059 0.000吸烟史(n,%) 227(60.5%) 154(50.7%) 6.649 0.010饮酒史(n,%) 162(43.2%) 101(33.2%) 7.042 0.008糖尿病(n,%) 144(38.5%) 128(42.2%) 0.975 0.323高血压(n,%) 248(66.5%) 201(66.3%) 0.002 0.967高脂血症(n,%) 68(18.3%) 75(24.8%) 4.117 0.042 BMI(kg/m2) 25.52±3.95 25.28±3.67 0.816 0.415体表面积(m2) 1.77±0.25 2.11±5.90 -1.117 0.264血小板(×109/L) 220(180,265) 210(170,248) -1.975 0.048糖化血红蛋白(%) 6.89±2.92 6.72±1.54 0.496 0.62 APTT(s) 38.44±10.81 38.31±7.61 0.18 0.857 PT(s) 13.48±1.38 13.41±0.98 0.746 0.456 FIB(g/L) 3.74±1.17 3.74±0.95 0.066 0.948 TT(s) 17.12±7.08 19.04±20.12 -1.549 0.122谷丙转氨酶(IU/L) 24(16,41) 22(15,36) -2.640 0.008 γ-谷氨酰转肽酶(IU/L) 26(19,39) 26(18.25,43.75) -0.646 0.518谷草转氨酶(IU/L) 45(23,120) 30(21,70.5) -3.543 0.000肌酐(umol/L) 73(64,87) 71(60,84) -1.650 0.099尿酸(umol/L) 345(280,408) 343(282,414) -0.692 0.489直接胆红素(umol/L) 5.29±5.10 4.61±2.41 2.132 0.033间接胆红素(umol/L) 9.93±4.81 9.48±5.54 1.087 0.278尿素(μmol/L) 7.69±25.63 6.22±3.34 0.982 0.326胆汁酸(μmol/L) 4.12±6.70 4.68±10.19 -0.842 0.400同型半胱氨酸(umol/L) 17.05±10.23 16.68±9.66 0.463 0.644 HDL-C(mmol/L) 1.07±0.30 1.05±0.29 0.839 0.402 LDL-C(mmol/L) 2.55±0.90 2.53±0.87 0.283 0.777 ApoAI(g/L) 1.14±0.24 1.13±0.22 0.275 0.783 ApoB(g/L) 0.90±0.48 0.87±0.38 0.816 0.415三酰甘油(mmol/L) 1.83±1.39 2.11±2.03 -2.007 0.045总胆固醇(mmol/L) 4.14±2.34 4.09±1.02 0.373 0.709 CYP2C19基因(快代谢)[(n,%)] 186(62.6%) 111(37.4%) 14.951 0.001
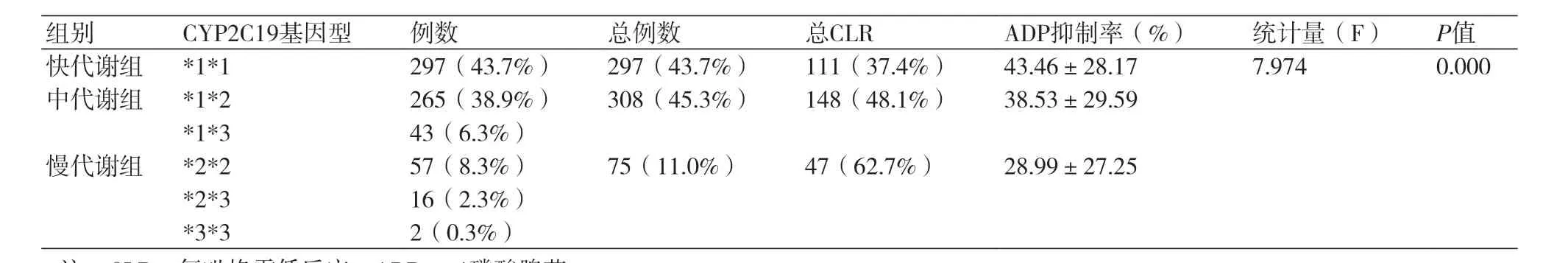
表2 不同CYP2C19基因型与血小板抑制率分布情况(n,%)
三类基因型患者间的氯吡格雷反应性采用卡方检验比较,差异有统计学意义(χ2=14.951,P=0.001),其中快代谢与中代谢(χ2=7.042,P=0.008),快代谢和慢代谢比较(χ2=12.589,P=0.000)均有统计学差异;中代谢和慢代谢比较差异无统计学意义(χ2=3.444,P=0.063)(图1)。
氯吡格雷的药物低反应性与不同CYP2C19基因型比较6种不同CYP2C19基因型间的氯吡格雷低反应性采用卡方检验比较,差异有统计学意义(χ2=16.926,P=0.002),其中CYP2C19*1*1型明显优于其他各型,比较差异有统计学意义(P<0.05);CYP2C19*1*2型和CYP2C19*2*2型比较差异有统计学意义(P<0.05),而CYP2C19*1*2与CYP2C19*1*3、CYP2C19*1*3与CYP2C19*2*3间比较无统计学差异(P>0.05)(表3)。
CYP2C19基因型与氯吡格雷的药物低反应性的ROC曲线,以灵敏度为纵轴、1-特异度为横轴,绘制出ROC曲线。氯吡格雷的药物低反应性与不同CYP2C19基因型比较差异有统计学意义(P<0.05),ROC曲线下面积(AUC)>0.5,说明通过检测CYP2C19基因型对氯吡格雷的药物反应性有较强的预测作用。
2.3 多因素Logistic回归分析以患者是否对氯吡格雷低反应为因变量,对患者年龄、性别、吸烟史、饮酒史、高血压、糖尿病、血小板计数、三酰甘油及CYP2C19基因型等因素为自变量进行Logistic回归分析,发现性别、血小板计数、谷草转氨酶及CYP2C19基因型与氯吡格雷低反应有相关性(P<0.05),男性、血小板计数、谷草转氨酶值与氯吡格雷抑制率负相关(表4)。
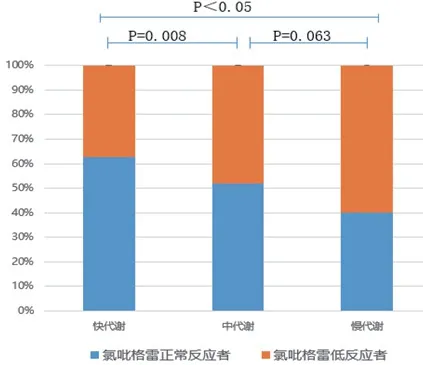
图1 三组患者间氯吡格雷低反应性关系
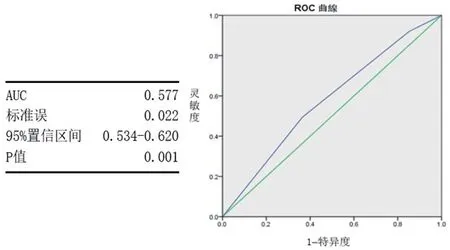
图2 CYP2C19基因型与氯吡格雷的药物低反应性的ROC曲线
3 讨论
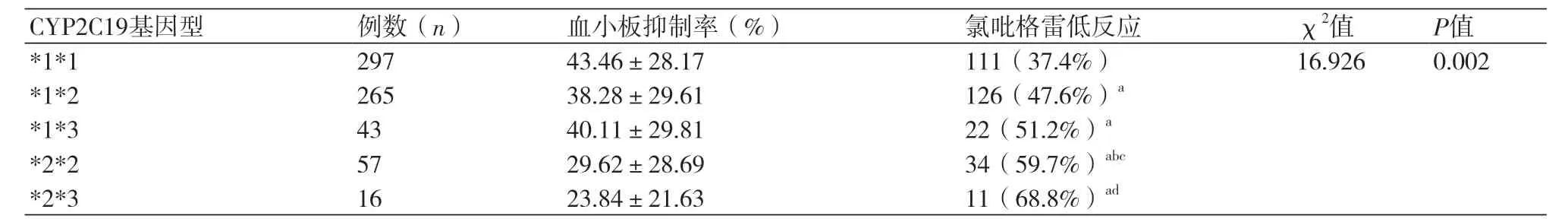
表3 氯吡格雷的药物低反应性与不同CYP2C19基因型比较
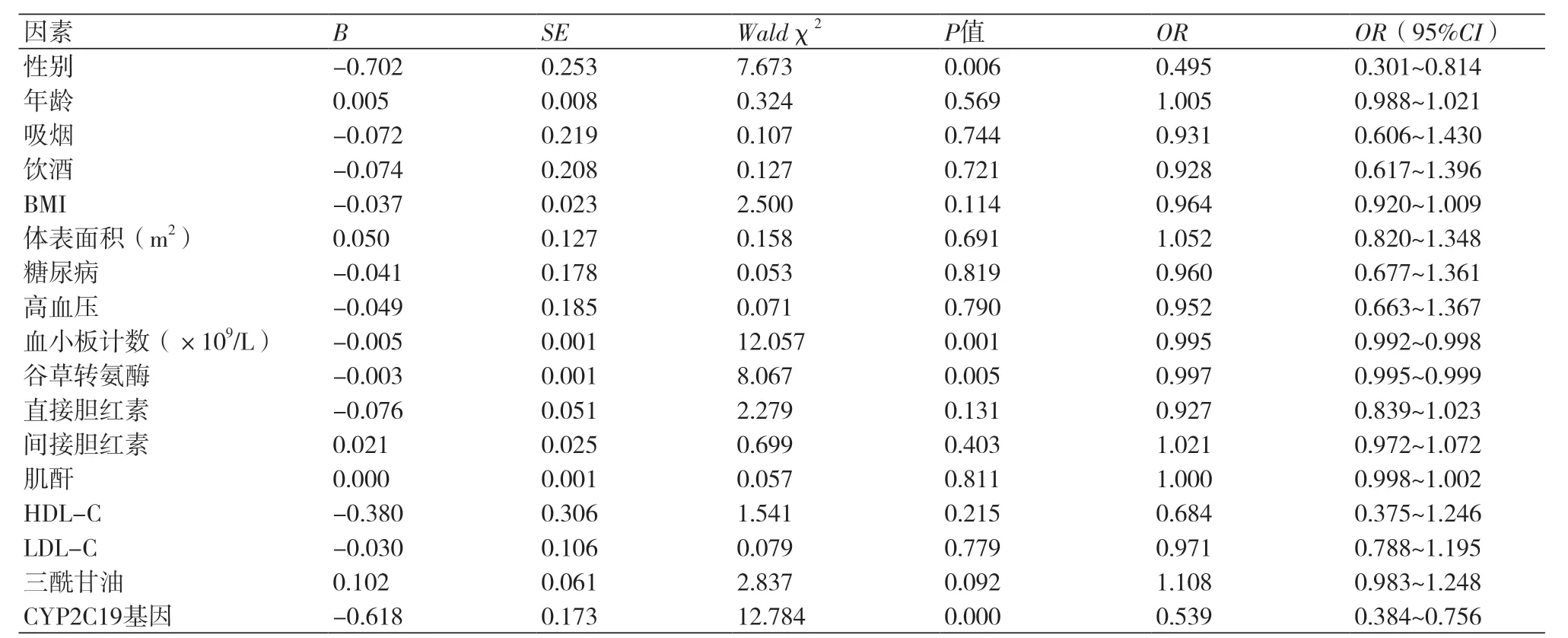
表4 多因素Logistic回归分析
氯吡格雷是一种噻吩吡啶类的抗血小板前体药物,须经肝脏内P450系列酶的作用生成具有活性的代谢产物来发挥抗血小板作用[14,15]。有临床研究发现,即使进行规范双联抗血小板治疗,仍有部分患者无法达到预期的抗血小板作用,出现氯吡格雷抵抗[2]。目前针对氯吡格雷抵抗的机制尚不明了,但有研究发现编码氯吡格雷代谢的关键酶[5]的CYP2C19基因存在两个重要的功能缺失型等位基因,即CYP2C19*2、CYP2C19*3,通过提前终止蛋白质的合成,使得氯吡格雷活性代谢产物减少,导致氯吡格雷低反应[16]。近年来,部分国内外专家对于CYP2C19基因多态性与氯吡格雷低反应的相关性存在质疑[17],故二者相关性目前尚未清楚。
本研究搜集规范服用氯吡格雷的冠心病患者,采用血栓弹力图检测评估其血小板抑制率的同时进行CYP2C19基因检测。探讨氯吡格雷低反应与CYP2C19基因型多态性之间的相关性。在本研究680例患者中氯吡格雷低反应的发生率为44.7%,与相关研究报道的氯吡格雷抵抗在不同人群的发生率4%~44%相近[18];快中慢三组代谢基因型间血小板抑制率及氯吡格雷低反应性发生率比较均有统计学差异,其中快代谢与中代谢或慢代谢比较均有统计学差异;而中代谢和慢代谢比较差异无统计学意义,即氯吡格雷正常反应组与低反应组比较,氯吡格雷正常反应组携带CYP2C19*1*1基因型的患者明显多于低反应组(P<0.05),氯吡格雷低反应组中等代谢型及慢代谢型较多(P<0.05)。
本研究中6 种不同C Y P 2 C 1 9 基因型间的氯吡格雷低反应性比较,差异有统计学意义,其中C Y P 2 C 1 9*1*1 型明显好于其他各型,CYP2C19*1*1型和CYP2C19*1*2型、CYP2C19*1*2型和CYP2C19*2*2型比较差异有统计学意义(P<0.05),结果显示CYP2C19*2更能影响氯吡格雷的抗血小板效果,这与CLOVIS-2实验[19]、ELEVATE-TIMI56[6]等研究一致。本研究中携带CYP2C19*1*3与CYP2C19*2*3基因型患者较少,氯吡格雷反应性受两基因型影响小,比较差异无统计学意义(P>0.05),但组间血小板抑制率绝对值相差较大。故结果表明,中慢代谢型患者的血小板抑制率偏低;氯吡格雷正常反应组快代谢型较多,而氯吡格雷低反应组中、慢代谢型较多;均提示携带CYP2C19*2和/或CYP2C19*3突变基因会影响氯吡格雷反应性,从而产生氯吡格雷抵抗。临床上氯吡格雷的抗血小板疗效还受到其他方面因素的影响,例如谷草转氨酶、直接胆红素、血小板计数(P<0.05)等。
综上所述,氯吡格雷低反应性与CYP2C19基因多态性相关,携带CYP2C19*2和/或CYP2C19*3突变基因者发生氯吡格雷低反应明显增多,因此基因检测对氯吡格雷的临床应用具有指导性意义。正如相关研究表明,CYP2C19基因多态性已被鉴定为氯吡格雷抵抗的强预测因子[20-22],并且基因指导抗血小板治疗能有效降低全因死亡率、心肌梗死及PCI后支架内血栓形成的风险[23,24]。并且研究发现CYP2C19基因多态性多见于约30%的白人,40%的黑人和超过55%的东亚人[20,25]。因此,在我国约超过半数患者存在因CYP2C19基因多态性引起氯吡格雷抵抗,故应广泛重视。氯吡格雷低反应性与临床心血管不良事件的发生及不良预后相关,建议对于口服氯吡格雷抗血小板治疗的患者行基因检测[26],目前临床上对于氯吡格雷处方前是否需常规行基因检测仍有争议,故需大规模临床试验进一步研究。
