Cullin7表达下调对结肠癌细胞增殖、凋亡的影响
2019-12-27介卫华李爱红
介卫华 赵 彬 李爱红
河南省漯河市中医院内三科(462000)
背景:结肠癌为常见的恶性肿瘤之一,发病率和死亡率均较高。Cullin7定位于染色体6p21.1,与恶性肿瘤的发生、发展密切相关。目的:探讨Cullin7表达下调对结肠癌细胞增殖、凋亡的影响。方法:采用qRT-PCR和蛋白质印迹法分别检测结肠癌组织、癌旁组织中Cullin7 mRNA和蛋白表达。以siRNA沉默Cullin7基因,并转染结肠癌HCT116细胞,qRT-PCR和蛋白质印迹法检测沉默效果。CCK-8法检测细胞增殖情况,流式细胞术检测细胞凋亡情况,蛋白质印迹法检测cleaved caspase-3、β-catenin、C-myc蛋白表达。以siRNA Cullin7联合Wnt信号通路抑制剂FH-535处理结肠癌细胞,流式细胞术检测细胞凋亡情况,蛋白质印迹法检测cleaved caspase-3、β-catenin、C-myc蛋白表达。结果:结肠癌组织中Cullin7 mRNA和蛋白表达明显高于癌旁正常组织(P<0.05)。与对照组相比,siRNA Cullin7 1组、siRNA Cullin7 2组、siRNA Cullin7 3组Cullin7 mRNA和蛋白表达均明显降低(P<0.05),尤其是siRNA Cullin7 2组。与对照组相比,沉默Cullin7表达后,结肠癌细胞增殖活性明显下降,细胞凋亡率明显增加,cleaved caspase-3蛋白表达明显上调,β-catenin、C-myc蛋白表达明显下调(P<0.05)。与siRNA Cullin7 2组相比,联合Wnt信号通路抑制剂FH-535后,结肠癌细胞凋亡率明显增加,cleaved caspase-3蛋白表达明显上调,β-catenin、C-myc蛋白表达明显下调(P<0.05)。结论:Cullin7基因参与了结肠癌HCT116细胞增殖和凋亡,沉默Cullin7可通过Wnt/β-catenin信号通路抑制细胞增殖,诱导细胞凋亡。
结肠癌为常见的恶性肿瘤之一,发病率和死亡率均较高,复发和转移是导致临床治疗失败的重要原因[1-2]。因此,寻求早期能够阻断癌细胞浸润和转移的靶向分子,对于结肠癌的临床治疗具有一定意义。Cullin7定位于染色体6p21.1,具有高度保守的Cullin结构域,为泛素连接酶亚基,在多种恶性肿瘤(如乳腺癌、肺癌、肝细胞癌、胰腺癌、卵巢癌等)中高表达,与恶性肿瘤的发生、发展密切相关[3]。已有研究[4]结果表明,与Cullin7低表达的肝癌患者相比,高表达的肝癌患者的预后不良。目前对于Cullin7在结肠癌的发生、进展、浸润和转移中的作用尚不明确。本研究采用siRNA沉默结肠癌细胞株中Cullin7表达,并观察Cullin7在结肠癌细胞增殖、凋亡中的作用,旨在分析其机制,从而为临床结肠癌的治疗提供新的靶点。
材料与方法
一、细胞株和主要试剂
人结肠癌细胞株HCT116(购自中国科学院典型培养物保藏委员会细胞库,编号TCHu99)。Cullin7 Human siRNA(OriGene Technologies),其中Cullin7 1-siRNA正义链序列:5’-CAA GCA GCA UCA UGA GAA ACC-3’,反义链序列:5’-UUU CUC AUG AUG CUG CUU GGA-3’;Cullin7 2-siRNA正义链序列:5’-GAG CGA GAA GGA AGA GGA AGC-3’,反义链序列:5’-UUC CUC UUC CUU CUC GCU CUU-3’;Cullin7 3-siRNA正义链序列:5’-GAU CGA AGA CCA CAG ACG AAC-3’,反义链序列:5’-UCG UCU GUG GUC UUC GAU CUG-3’;Cullin7阴性对照正义链序列:5’-AGU GAG AAC CGC ACA GAC CAA-3’,反义链序列:5’-UCU CUU GGU AUG CGG UCU GUC-3’;脂质体LipofectamineTM2000(美国Invitrogen公司);BeyoFastTMSYBR Green qPCR Mix (2X)(碧云天生物技术研究所);兔抗人Cullin7、cleaved caspase-3、β-catenin、C-myc蛋白抗体、羊抗兔HRP标记的二抗(碧云天生物技术研究所);CCK-8试剂盒(碧云天生物技术研究所);Annexin V-FITC/PI双染细胞凋亡检测试剂盒(南京建成生物工程研究所);Wnt信号通路抑制剂FH-535(美国Abcam公司)。
二、方法
1. 组织标本:标本源自2015年1月—2018年1月于河南省漯河市中医院接受手术治疗的15例结肠癌患者,诊断均经病理检查证实,且术前患者均未接受过化疗等相关肿瘤治疗。15例结肠癌组织和相应癌旁正常组织(取自距肿瘤边缘>5 cm处)均于术后30 min内置于液氮罐中冻存。标本使用前均取得患者的知情同意,研究方案通过漯河市中医院伦理委员会的审批。
2. 细胞培养、转染和分组:转染前24 h,取对数生长期细胞并调整细胞密度为1×104个/mL,接种于6孔板。将细胞随机分为siRNA Cullin7 1组、siRNA Cullin7 2组、siRNA Cullin7 3组、阴性对照组、对照组。加入含10%胎牛血清的DMEM培养基,每孔2 mL,当细胞达80%以上融合度时,更换为无血清无双抗的培养基培养。依据LipofectamineTM2000说明书,采用无血清无双抗培养基分别稀释LipofectamineTM2000和siRNA(Cullin7 1-siRNA序列、Cullin7 2-siRNA序列、Cullin7 3-siRNA序列、Cullin7阴性对照序列、空载体)至所需浓度,混匀,静置20 min,加入预先采用无血清无双抗的培养基培养1 h的细胞中,培养6 h后,更换为完全培养基继续培养。
3. qRT-PCR法检测Cullin7 mRNA表达:收集结肠癌及其相应癌旁正常组织以及各组结肠癌细胞,以Trizol试剂提取细胞总RNA,然后反转录生成cDNA。采用BeyoFastTMSYBR Green qPCR Mix (2X)试剂盒,选取2 μL cDNA于20 μL反应体系行qRT-PCR。循环条件:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 25 s,60 ℃ 30 s,共40个循环。以GAPDH作为内参基因,由上海英骏生物技术有限公司设计引物序列。Cullin7(NM_001168370.1)上游序列:5’-CCT ACC TGA GGG GCA CTT TG-3’,下游:5’-ATC TTG AGG ACC CCT CCT GG -3’,产物大小为187 bp;GAPDH(M17851.1)上游引物:5’-GAG CCA CAT CGC TCA GAA CAC-3’,下游:5’-TCA CAA GCT TCC CGT TCT CA -3’,产物大小为228 bp。采用2-△△Ct法计算目的基因mRNA相对表达水平。
4. 蛋白质印迹法检测Cullin7蛋白表达:收集结肠癌及其相应癌旁正常组织以及各组结肠癌细胞,常规方法提取蛋白质,调整各样本蛋白总量,行10% SDS-PAGE电泳,然后转移至PVDF膜,3% BSA阻断1 h,加入一抗(1∶1 000)4 ℃过夜,洗膜后添加二抗(1∶3 000),摇床上摇动1 h,Bio-Rad凝胶成像系统成像拍照,以β-actin蛋白条带灰度值为内参进行半定量分析。
5. CCK-8法测定细胞活力:取对照组、阴性对照组、siRNA Cullin7 2组细胞并调整细胞密度为1×104个/mL,接种于96孔板,置于37 ℃ 5% CO2培养箱中培养,待细胞融合度达70%~80%时,进行转染实验。转染后12 h、24 h、48 h、72 h,每孔分别加入10 μL CCK-8溶液,孵育2 h后上酶标仪测定450 nm波长处的每孔吸光度(A)值,以空白对照组调零,计算抑制率。
6. 流式细胞仪检测细胞凋亡情况:收集转染48 h的对照组、阴性对照组、siRNA Cullin7 2组细胞,以胰酶消化,1 000×g离心5 min,收集并重悬细胞,1 000×g离心5 min,加入500 μL结合液重悬细胞,加入5 μL Annexin V-FITC,然后加入5 μL PI,混匀,室温孵育10 min,上流式细胞仪检测各组细胞凋亡情况。
7. 蛋白质印迹法检测各组cleaved caspase-3、β-catenin、C-myc蛋白表达:取对照组、阴性对照组、siRNA Cullin7 2组细胞,采用蛋白质印迹法检测cleaved caspase-3(工作浓度为1∶2 000)、β-catenin(工作浓度为1∶2 000)、C-myc(工作浓度为1∶3 000)蛋白表达,具体步骤按试剂盒说明书进行操作。
8. Wnt信号通路抑制剂对沉默Cullin7结肠癌细胞增殖、凋亡的影响:取稳定转染siRNA Cullin7 2组的结肠癌细胞,并分为两组,其中一组给予正常培养,另一组在培养液中加入终浓度为20 μmol/L的Wnt信号通路抑制剂FH-535。培养24 h后,以流式细胞术检测细胞凋亡情况,蛋白质印迹法检测cleaved caspase-3(工作浓度为1∶2 000)、β-catenin(工作浓度为1∶2 000)、C-myc(工作浓度为1∶3 000)蛋白表达。
三、统计学分析
结 果
一、Cullin7在癌旁正常组织和结肠癌组织中的表达
与癌旁正常组织相比,结肠癌组织中Cullin7 mRNA和蛋白表达明显增加,差异均有统计学意义(P<0.05)(图1、表1)。
二、siRNA Cullin7下调HCT116细胞中Cullin7的表达
与对照组相比,siRNA Cullin7 1组、siRNA Cullin7 2组、siRNA Cullin7 3组Cullin7 mRNA和蛋白表达均显著降低(P<0.05)(图2、表2),其中siRNA Cullin7 2组下降幅度最大,故后续实验选择siRNA Cullin7 2组进行研究。

1:癌旁正常组织;2:结肠癌组织

组 别例数mRNA表达蛋白表达癌旁正常组织150.24±0.020.16±0.04结肠癌组织150.84±0.060.43±0.04t值16.4328.267P值0.0000.001

1:对照组;2:阴性对照组;3:siRNA Cullin7 1组;4:siRNA Cullin7 2组;5:siRNA Cullin7 3组
图2siRNA Cullin7下调HCT116细胞中Cullin7蛋白表达(蛋白质印迹法)
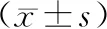
表2siRNA Cullin7下调HCT116细胞中Cullin7 mRNA和蛋白表达
三、siRNA Cullin7抑制HCT116细胞增殖
对照组、阴性对照组、siRNA Cullin7 2组之间HCT116细胞A值相比差异有统计学意义(F=4.029,P<0.05);随着时间延长,三组A值呈增长趋势,差异有统计学意义(F=95.648,P<0.05);且处理因素与时间之间存在交互作用(F=2.579,P<0.05)(图3)。
四、siRNA Cullin7诱导HCT116细胞凋亡
转染48 h后,对照组、阴性对照组和siRNA Cullin7 2组的细胞凋亡率分别为4.49%±0.03%、5.48%±0.05%、21.38%±0.74%,其中siRNA Cullin7 2组细胞凋亡率明显高于对照组(P<0.05)(图4)。

培养时间
五、siRNA Cullin7对HCT116细胞中cleaved caspase-3、β-catenin、C-myc表达的影响
与对照组相比,siRNA Cullin7 2组HCT116细胞中cleaved caspase-3蛋白表达明显增加,而β-catenin、C-myc蛋白表达明显降低,差异均有统计学意义(P<0.05)(图5、表3)。
六、抑制Wnt信号通路协同沉默Cullin7对HCT116细胞凋亡的影响
与siRNA Cullin7 2组相比,联合Wnt信号通路抑制剂FH-535处理后,结肠癌细胞凋亡率明显增加(36.14%±1.02%对23.92%±0.82%),差异有统计学意义(P<0.05)(图6)。
七、抑制Wnt信号通路协同沉默Cullin7对cleaved caspase-3、β-catenin、C-myc表达的影响
与siRNA Cullin7 2组相比,联合Wnt信号通路抑制剂FH-535处理后,cleaved caspase-3蛋白表达明显增加,β-catenin、C-myc蛋白表达明显降低,差异均有统计学意义(P<0.05)(图7、表4)。
讨 论
Cullin7为Cullin蛋白家族中较晚开始研究的成员,基因高度保守,其本身并不是促癌基因或抑癌基因,主要通过底物蛋白影响细胞信号通路,并进一步诱导肿瘤的形成[5-6]。有研究显示,Cullin7在绒毛膜癌、肝癌、乳腺癌等肿瘤细胞中高表达,为一种致癌基因,与肿瘤的增殖、凋亡、恶性进展等存在一定的联系,以Cullin7为靶点的药物和基因治疗也引起越来越多的重视[7]。Cullin7过表达在肝细胞癌的发病机制和进展中起有重要作用,可能是肝细胞癌管理的重要标志物,沉默Cullin7可显著降低肝癌细胞迁移、侵袭和转移的能力[8]。此外,有研究[9]发现Cullin7高表达与上皮性卵巢癌患者预后不良密切相关,并可下调p53表达,促进卵巢癌细胞增殖和侵袭。Men等[10]发现,Cullin7在肺癌中过表达是肺癌细胞增殖所必需的条件。本研究结果显示,Cullin7 mRNA和蛋白在结肠癌组织中的表达均明显高于癌旁正常组织,提示Cullin7表达增高在结肠癌的发生中可能起一定的促进作用。
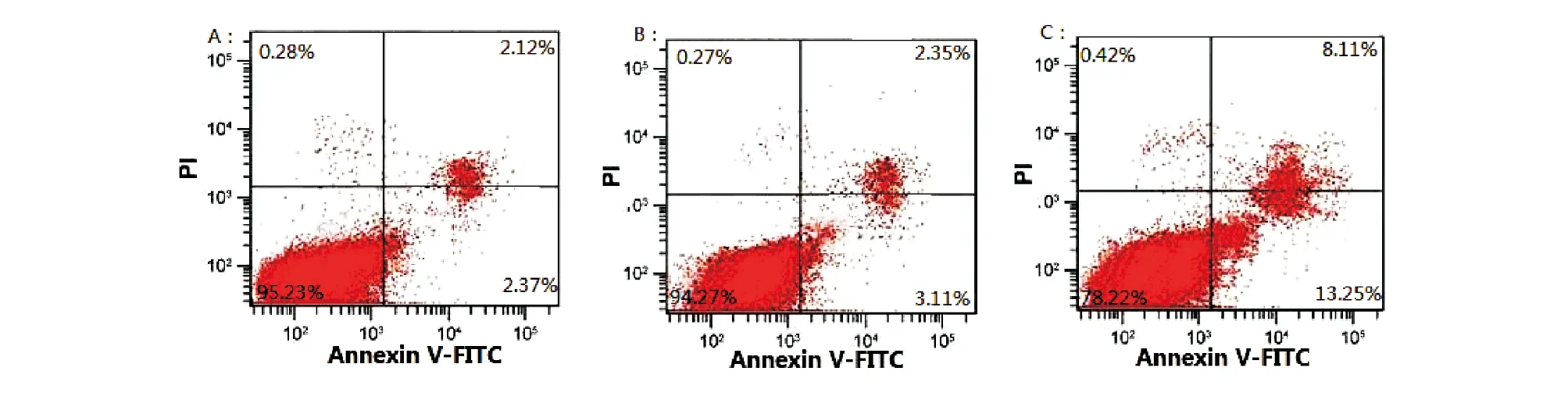
A:对照组;B:阴性对照组;C:siRNA Cullin7 2组
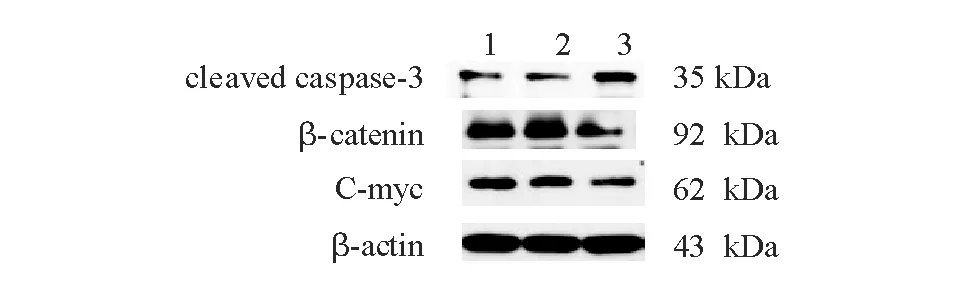
1:对照组;2:阴性对照组;3:siRNA Cullin7 2组
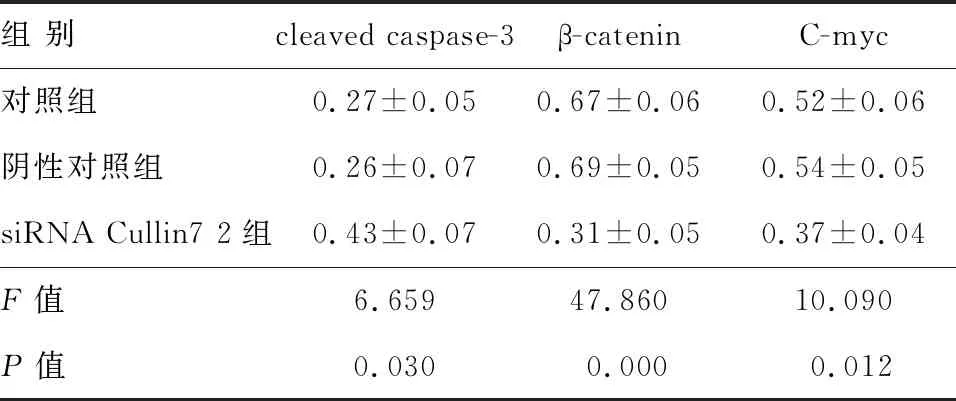
组 别cleaved caspase-3β-cateninC-myc对照组0.27±0.050.67±0.060.52±0.06阴性对照组0.26±0.070.69±0.050.54±0.05siRNA Cullin7 2组0.43±0.070.31±0.050.37±0.04F值6.65947.86010.090P值0.0300.0000.012

A:siRNA Cullin7 2组;B:siRNA Cullin7 2+FH-535组
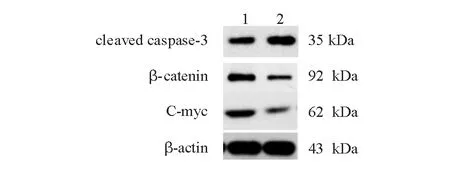
1:siRNA Cullin7 2组;2:siRNA Cullin7 2+FH-535组
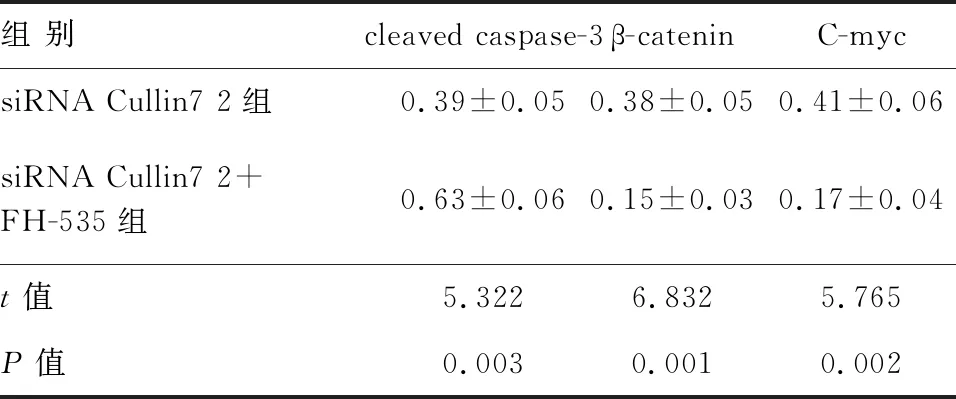
组 别cleaved caspase-3β-cateninC-mycsiRNA Cullin7 2组0.39±0.050.38±0.050.41±0.06siRNA Cullin7 2+FH-535组0.63±0.060.15±0.030.17±0.04t值5.3226.8325.765P值0.0030.0010.002
RNA干扰主要应用于转录后基因表达调控,广泛用于目前的科学研究。结肠癌是一种常见的恶性肿瘤,其发病原因比较复杂,机制目前尚不明确。因此,寻求一种新的治疗靶点对结肠癌的治疗、预后具有一定的临床价值[11]。本研究结果显示,转染Cullin7 siRNA 48 h后,结肠癌细胞中Cullin7 mRNA和蛋白表达均明显低于阴性对照组和对照组,提示siRNA可特异性下调结肠癌HCT116细胞中Cullin7表达。已有研究显示,Cullin7结构发生改变时,会导致细胞内泛素水平失衡,引起细胞凋亡紊乱,造成恶性增殖[12]。本研究进一步采用CCK-8法检测转染Cullin7 2-siRNA后的细胞增殖情况,结果显示siRNA Cullin7 2组在转染24 h、48 h和72 h的A值均明显低于对照组和阴性对照组;流式细胞术示siRNA Cullin7 2组细胞凋亡率明显高于对照组。提示阻断Cullin7表达可有效抑制结肠癌HCT116细胞增殖,并诱导细胞凋亡。此外,转染Cullin7 siRNA后,凋亡蛋白cleaved caspase-3表达显著增加,表明下调Cullin7表达可通过caspase信号通路诱导结肠癌HCT116细胞凋亡。
Wnt/β-catenin为一种比较保守的信号通路,从低等的果蝇到高等的哺乳动物中均具有高度保守的同源性,与细胞生长、凋亡、黏附存在一定的联系[13-14]。β-catenin是该经典通路的关键蛋白,通过调控包括C-myc等在内的下游靶基因的转录和表达影响癌细胞的生长过程[15]。β-catenin在多种恶性肿瘤细胞中过表达,抑制其表达可逆转恶性肿瘤的表型。潘安萍等[16]的研究发现,沉默β-catenin表达可促进胃癌MGC-803细胞凋亡,阻滞细胞周期,降低细胞侵袭转移能力,其作用机制可能与影响Wnt/β-catenin信号通路下游靶蛋白表达有关。本研究结果显示,沉默Cullin7表达后,β-catenin、C-myc表达明显降低,cleaved caspase-3表达明显增加;联合Wnt信号通路抑制剂FH-535后,β-catenin、C-myc表达进一步下调,cleaved caspase-3表达进一步上调,细胞凋亡率明显增加。提示下调Cullin7表达可通过抑制Wnt/β-catenin信号通路的激活,发挥抑制结肠癌细胞增殖、诱导细胞凋亡的作用。
综上所述,Cullin7基因参与了结肠癌HCT116细胞增殖和凋亡,沉默Cullin7表达可通过Wnt/β-catenin信号通路抑制细胞增殖,诱导细胞凋亡,表明Cullin7有望成为结肠癌基因治疗的新靶点。然而,肿瘤发生、转移是一个多因素、多阶段的复杂过程,涉及多种基因和多种信号传递的过程,尚存在许多未知的机制需行进一步研究。
致谢本实验均在漯河市医学生物工程重点实验室完成,在此表示感谢!
