MicroRNA-21在胰腺癌细胞增殖和迁移中作用的研究*
2019-12-27赵秋艳余兰婷谢浩然任迎春陈素敏李百文
赵秋艳 余兰婷 谢浩然 任迎春 陈素敏 李百文
上海交通大学附属第一人民医院(201620)
背景:大量研究表明microRNAs与肿瘤的发生、发展密切相关。MiR-21为最为常见的致癌性microRNAs分子之一,其对胰腺癌细胞增殖、迁移的具体作用及其机制尚未完全阐明。目的:探讨miR-21对胰腺癌细胞增殖、迁移的影响及其具体分子机制。方法:以PANC-1和MIA PaCa-2细胞为研究对象,通过转染慢病毒表达载体分别构建miR-21过表达和敲低的稳转株,以qRT-PCR法验证转染效率。采用CCK-8法检测细胞增殖能力,划痕实验检测细胞迁移能力,qRT-PCR和蛋白质印迹法分别检测Spry2 mRNA和蛋白表达,萤光素酶报告实验检测miR-21对Spry2的调控作用。结果:MiR-21过表达可明显促进PANC-1细胞增殖和迁移(P<0.05),miR-21表达下调可明显降低MIA PaCa-2细胞增殖和迁移(P<0.05)。与对照组相比,miR-21表达上调可明显降低Spry2 mRNA和蛋白表达(P<0.05),而敲低miR-21表达可明显升高Spry2 mRNA和蛋白表达(P<0.05)。上调miR-21表达可抑制含野生型Spry2 3’-UTR序列质粒的萤光素酶活性(P<0.05),下调miR-21表达则增强萤光素酶活性(P<0.05)。Spry2可逆转miR-21介导的细胞增殖和迁移(P<0.05)。结论:MiR-21能通过靶向调节Spry2的表达而影响胰腺癌细胞的生物学功能。
胰腺癌是严重危害人类健康的常见消化系统肿瘤,亦是预后最差的恶性肿瘤之一[1]。由于缺乏有效的早期诊断方法,大多数胰腺癌患者确诊时即处于疾病晚期,失去了手术治疗的机会。因此探讨胰腺癌发生、发展的分子机制,并寻找早期诊断和预后判断指标是胰腺癌研究中亟待解决的重大问题。微RNAs(microRNAs, miRNAs)是一类小分子非编码RNA,通过与靶基因mRNA 3’端非编码区(3’-UTR)的碱基互补配对,促进mRNA降解或抑制其翻译,在转录后水平负性调控相关基因的表达[2-4]。大量研究表明,miRNAs失调与肿瘤发生、细胞增殖、凋亡、侵袭、转移等密切相关[5-6]。MiR-21作为最为常见的致癌性miRNAs分子之一,在胰腺癌中高表达,然而其对胰腺癌细胞增殖、迁移的具体机制尚不清楚。本研究通过转染慢病毒表达载体构建miR-21过表达和敲低的稳转株,旨在探讨miR-21对胰腺癌细胞增殖和迁移的影响及其可能的分子机制。
材料与方法
一、细胞株和主要试剂
人胰腺癌细胞株PANC-1、MIA PaCa-2购于中国科学院细胞库;慢病毒的构建由汉恒生物技术(上海)有限公司完成;miR-21 mimics、阴性对照mimics NC、miR-21 inhibitor、阴性对照inhibitor NC、Spry2过表达质粒和空载质粒均由上海吉玛制药技术有限公司合成;Spry2敲低寡核苷酸(Si-Spry2)、阴性对照(Si-NC)和EdU试剂盒购于广州锐博生物技术有限公司;Trizol试剂、逆转录试剂盒、SYBR Green荧光定量PCR试剂盒均购自日本TaKaRa公司;兔抗人Spry2、GAPDH抗体购自美国CST公司;脂质体LipofectamineTM2000购自美国Invitrogen公司;CCK-8细胞增殖试剂盒购自日本同仁化学研究所;Annexin V-FITC/PI凋亡检测试剂盒购于杭州联科生物技术股份有限公司;萤光素酶报告质粒由和元生物技术(上海)股份有限公司构建。
二、方法
1. 细胞培养:PANC-1、MIA PaCa-2细胞置于含10%胎牛血清的DMEM培养基中,37 ℃、5% CO2条件下培养,每2 d更换一次培养基。当细胞生长至融合度为80%~90%时常规传代培养。
2. 慢病毒转染和稳转株的筛选:取对数生长期细胞接种于6孔板,当细胞汇合率为50%~70%时,加入适量病毒,感染48 h后更换含有适当浓度嘌呤霉素的新鲜完全培养基,筛选稳定转染的细胞株。每2~3 d更换一次含嘌呤霉素的完全培养基,直至不感染病毒的筛选对照组细胞被嘌罗霉素杀光,以实时荧光定量PCR(qRT-PCR)法验证转染效率。
3. 细胞转染:将稳转株分别接种于6孔板,当细胞汇合率达70%时,应用LipofectamineTM2000对miR-21过表达的PANC-1稳转株(LV-miR-21)瞬时转染Spry2过表达质粒(Spry2)和空载质粒(EV),对miR-21敲低的MIA PaCa-2稳转株(SP-miR-21)瞬时转染Si-RNA和Si-NC,6 h后更换培养基,继续培养24 h,以qRT-PCR法验证转染效率。
4. qRT-PCR法:收集各组转染后的细胞,用预冷的PBS清洗后加入Trizol试剂提取细胞内总RNA,反转录为cDNA,行实时荧光定量PCR。miR-21上游引物:5’-CGC GCG TAG CTT ATC AGA CTG A-3’,下游:5’-ATC CAG TGC AGG GTC CGA GG-3’;内参U6上游引物:5’-CAA GGA TGA CAC GCA AA-3’,下游:5’-TCA ACT GGT GTC GTG G-3’;Spry2上游引物:5’-AAG CCA CTG AGC AAG GAA GA-3’,下游:5’-TTG TCG CAG ATC CAG TCT GA-3’;内参GAPDH上游引物:5’-GGG AAG GTG AAG GTC GGA GT-3’,下游:5’-GGG GTC ATT GAT GGC AAC A-3’。引物由生工生物工程(上海)股份有限公司设计并合成。采用2-△△Ct法计算目的基因的相对表达量。
5. 蛋白质印迹法:收集各组对数生长期细胞,提取各组细胞的总蛋白,BCA法测定蛋白浓度,各组蛋白调整同一浓度,检测细胞内Spry2蛋白表达。兔抗人Spry2、GAPDH一抗稀释浓度为1∶1 000,羊抗兔二抗稀释浓度为1∶2 000。ECL法显影并保存图像。应用Image J软件进行分析。以目的条带与内参条带的灰度值比表示目的蛋白表达量。
6. CCK-8细胞增殖实验:取各组对数生长期细胞并接种于96孔板,培养1 d、2 d、3 d、4 d、5 d后,每孔分别加入10 μL CCK-8溶液,37 ℃孵育2 h,上酶标仪测定450 nm波长处的各孔吸光度值(A值)。实验重复3次,取均值。根据实验数据绘制生长曲线图。
7. 细胞迁移实验:取各组对数生长期细胞接种于6孔板,当细胞长满后,使用200 μL移液器吸头在细胞层进行划痕,PBS洗去细胞碎片,倒置显微镜下进行拍照(0 h)并记录拍摄位置。加入无血清培养基继续培养36 h,倒置显微镜下拍照。每组设置3个复孔,重复3次。应用Image J软件测量长度。
8. 萤光素酶报告实验:将状态良好的PANC-1、MIA PaCa-2细胞接种于24孔板,当细胞融合度达50%~70%时,用脂质体LipofectamineTM2000分别将miR-21 mimics或mimics NC与野生型Spry2 3’-UTR报告质粒(Wt-Spry2)或突变型Spry2 3’-UTR报告质粒(Mut-Spry2)共转染PANC-1细胞,将miR-21 inhibitor或inhibitor NC与Wt-Spry2或Mut-Spry2共转染MIA PaCa-2细胞,继续培养36 h后检测萤光素酶活性。
三、统计学分析
结 果
一、慢病毒转染后miR-21在胰腺癌细胞中的表达
qRT-PCR法结果显示,PANC-1细胞转染miR-21过表达的慢病毒载体(LV-miR-21)后,miR-21表达较对照组明显上调(P<0.05)(图1A);而MIA PaCa-2细胞转染miR-21敲低的慢病毒载体(SP-miR-21)后,miR-21表达较对照组明显下调(P<0.01)(图1B)。
二、MiR-21表达对胰腺癌细胞增殖的影响
CCK-8法结果显示,miR-21表达上调后PANC-1细胞增殖能力较对照组明显增强(P<0.05)(图2A),而miR-21表达下调后MIA PaCa-2细胞增殖能力较对照组明显降低(P<0.05)(图2B)。表明miR-21表达能增强胰腺癌细胞的增殖能力。
三、MiR-21表达对胰腺癌细胞迁移的影响
细胞划痕实验显示,与对照组相比,miR-21过表达可明显促进PANC-1细胞迁移(P<0.05)(图2C);与对照组相比,miR-21敲低能明显抑制MIA PaCa-2细胞迁移(P<0.05)(图2D)。提示miR-21表达能促进胰腺癌细胞迁移。
四、Spry2是miR-21的靶基因
采用预测软件TargetScan、miRBase、PicTa等进行生物学分析,发现在Spry2 mRNA的3’-UTR含有miR-21结合位点(图3A)。qRT-PCR和蛋白质印迹法结果表明,与对照组相比,miR-21 mimics组Spry2 mRNA和蛋白表达均明显下降(P<0.05),而miR-21 inhibitor组Spry2 mRNA和蛋白表达均明显上升(P<0.05)(图3B)。萤光素酶报告实验显示,同时转染miR-21 mimics和Spry2野生型质粒后,萤光素酶活性较对照组明显降低(P<0.05),同时转染miR-21 inhibitor和Spry2野生型质粒后,萤光素酶活性较对照组明显增强(P<0.01),而突变组中萤光素酶活性差异均无统计学意义(P>0.05)(图3C)。说明miR-21可直接靶向调控Spry2表达。
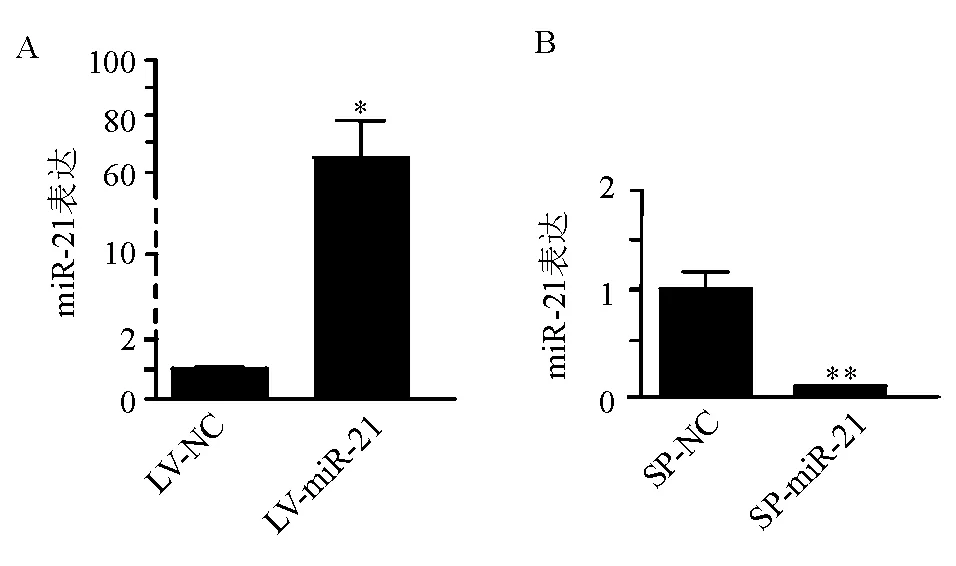
A:PANC-1细胞中miR-21表达;B:MIA PaCa-2细胞中miR-21表达
图1慢病毒转染后miR-21在胰腺癌细胞中的表达(qRT-PCR法)
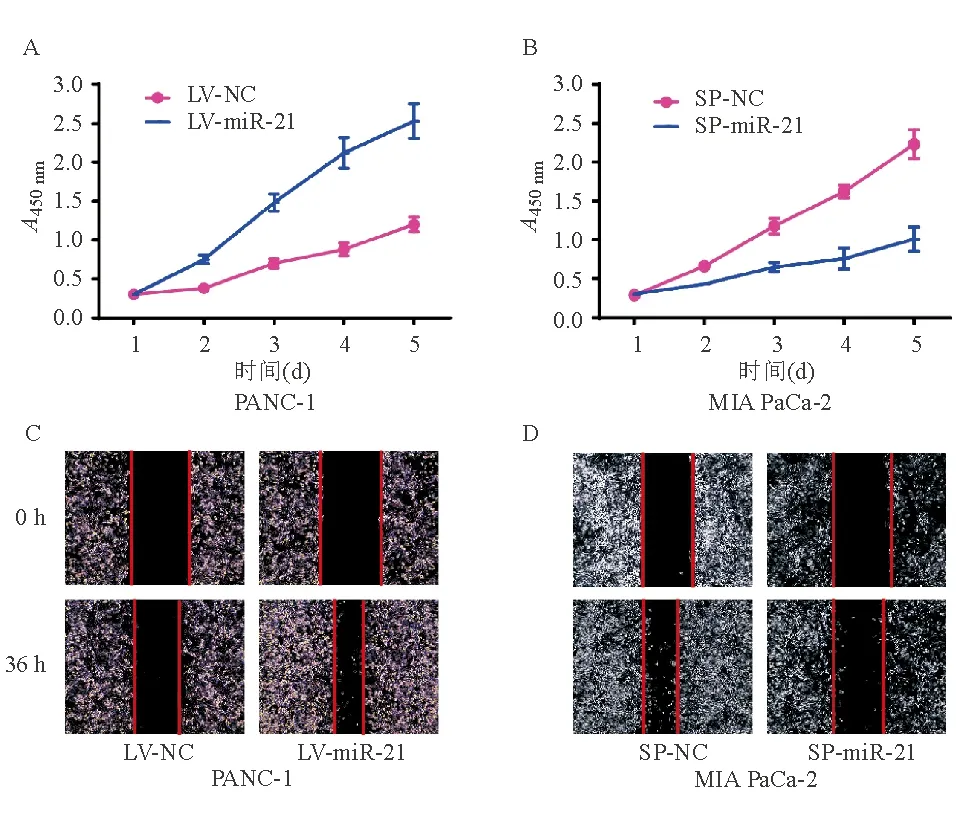
A:miR-21过表达促进PANC-1细胞增殖;B:miR-21敲低抑制MIA PaCa-2细胞增殖;C:miR-21过表达促进PANC-1细胞迁移;D:miR-21敲低抑制MIA PaCa-2细胞迁移
图2 miR-21表达对胰腺癌细胞增殖、迁移的影响
A:生物信息学软件预测miR-21与Spry2的结合位点;B:miR-21上下调后对Spry2 mRNA和蛋白水平的影响;C:萤光素酶报告实验结果
图3 Spry2是miR-21的靶基因
五、Spry2对miR-21介导的细胞增殖、迁移能力的影响
在PANC-1细胞中,与LV-miR-21+EV组相比,LV-miR-21+Spry2组细胞增殖、迁移能力明显降低(P<0.05)(图4A);在MIA PaCa-2细胞中,与SP-miR-21+Si-NC组相比,SP-miR-21+Si-Spry2组细胞增殖、迁移能力明显增强(P<0.05)(图4B)。
讨 论
胰腺癌具有高度侵袭性,预后极差,发病率接近于死亡率[7]。近年来,胰腺癌发生率和死亡率逐年上升,预计在2030年将成为癌症相关死亡的第二大常见原因[8]。目前已发现大量信号通路、生长因子、原癌基因、抑癌基因等参与胰腺癌的发生和发展[9],但仍未发现有效的治疗措施。有研究表明,miRNAs参与肿瘤细胞的增殖和分化,调控肿瘤细胞的侵袭和转移[10-11],有望成为肿瘤诊断和治疗的靶点。

A:Spry2逆转miR-21诱导的细胞增殖、迁移;B:Si-Spry2促进细胞增殖、迁移
图4 Spry2对miR-21介导的细胞增殖、迁移能力的影响
MiR-21在几乎所有恶性肿瘤中异常表达,并参与肿瘤的形成和进展。在结直肠癌中,miR-21通过转录后调控抑制抑癌基因Pdcd4表达而促进肿瘤细胞侵袭和转移[12]。在乳腺癌细胞中,miR-21通过调节凋亡蛋白Bcl-2表达而抑制癌细胞的凋亡,促进肿瘤形成[13]。大量研究显示,miR-21在胰腺癌中的表达升高[14-15],且与胰腺癌的化疗抵抗密切相关,下调miR-21表达可增强胰腺癌细胞对化疗药物吉西他滨的敏感性[16-17]。本研究成功构建了以慢病毒介导的miR-21过表达和敲低的稳转株。CCK-8和划痕实验结果显示miR-21过表达可促进胰腺癌PANC-1细胞增殖和迁移,而miR-21表达下调能抑制MIA PaCa-2细胞增殖和迁移。
MiRNAs通过调节下游靶基因而发挥生物学作用,一种miRNAs能调控多种靶基因的表达[18]。本研究中,通过生物学信息预测软件对miR-21的靶基因进行预测,筛选出Spry2作为潜在的目的基因。Spry2是受体酪氨酸激酶信号通路的抑制物[19-20],能抑制生长因子诱导的细胞增殖和转移[21],并作为抑癌基因在多种肿瘤中发挥作用[22]。近期一项研究[23]表明,Spry2在胃癌组织中的表达降低,且与患者的5年生存率呈正相关。Shukla等[24]的研究发现Spry2在慢性淋巴性白血病(CLL)中的表达下调,并通过负反馈调节B细胞受体和MAPK信号通路而促进CLL的发生、发展。本研究中,首先利用TargetScan、miRBase、PicTa等预测软件筛选出miR-21的靶基因Spry2。随后qRT-PCR和蛋白质印迹法表明Spry2可能是miR-21的靶基因。萤光素酶报告实验证实miR-21可与Spry2的3’-UTR结合,并调控Spry2的表达。进一步的细胞实验结果显示,Spry2能逆转miR-21诱导的细胞增殖和迁移。由此可见,miR-21可通过下调Spry2表达来促进肿瘤细胞增殖和迁移。
综上所述,本研究结果证实了miR-21能通过靶向调节Spry2表达而影响胰腺癌细胞的生物学功能,有望为胰腺癌的诊断和治疗提供更广阔的前景。
