重视肝脏良性肿瘤的规范化诊治
2019-12-26戴朝六贾昌俊史健
戴朝六,贾昌俊,史健
(中国医科大学附属盛京医院肝胆脾外科,辽宁 沈阳 110004)
肝脏良性肿瘤(benign liver tumors,BLTs)是一类包括各种不同细胞起源的多样化病变[1]。随着影像学技术的发展和体检保健意识的增强,BLTs的检出率不断提高。这些病变大多数生长缓慢,无需治疗。在临床实践中,不恰当地采用肝切除等侵袭性治疗会给病人造成过度治疗,增加经济负担,甚至因手术或其他治疗的风险危及病人的健康与生命;而对于具有潜在恶变风险的BLTs,一味地保守观察则可能贻误最佳的处理时机,造成不良后果,因此极有必要建立一套易于接受的规范化诊治体系。近年来,国内外有关肝脏良性占位病变的诊治指南或专家共识陆续发表[2-4],对推动肝脏良性占位病变的规范化诊治起到了积极的作用;但不可否认的是,在临床实际应用过程中,常常受到多种主、客观因素的制约,推广较为缓慢,实际效果有待评估。
一、BLTs的分类
BLTs常按肿瘤起源进行分类命名,如根据2010年版世界卫生组织(WHO)消化系统肝胆肿瘤组织学分类命名(表1),其中异型增生结节、胆管内乳头状瘤和胆管黏液囊腺瘤等属于癌前病变[5]。而国内丛文铭按真性、假性肿瘤将肝脏良性占位性病变分为真性肿瘤和瘤样病变两大类[6]。尽管肝脏瘤样病变并非真性肿瘤,但在WHO分类中仍将其放在了良性肿瘤中,因为该类病变术前往往难以明确其病变性质,甚至不易与肝脏恶性肿瘤相鉴别,归入肝脏良性肿瘤或良性占位病变符合临床实际,便于治疗决策。
二、BLTs的诊断
诊断BLTs主要依据详细的病史、体格检查、影像学和病理学检查。临床上必须明确的是,任何肝脏占位的确定性诊断,必须综合分析病史、慢性肝病背景、肿瘤标志物与影像学检查,重点是与恶性病变相鉴别。在没有基础肝病的情况下,女性口服避孕药的使用可能是肝细胞腺瘤(hepatocellular adenoma,HCA)诊断的重要参考依据,但并不是诊断的必要依据。尽管BLTs也可以发生在有慢性肝病背景的肝脏,但需要注意的是,即使有证据提示该占位为良性病变如血管瘤等的可能性较大,但在针对具体病人时亦应慎重,需重视对该病变的动态随访观察。尤需注意对慢性肝病基础上出现的新病灶的鉴别诊断。而仓促下良性肿瘤或占位病变的诊断结论,有可能延误恶性肿瘤的诊治,临床上此类教训并不鲜见。

表1 WHO常见BLTs的组织学分类
毋容置疑,影像学检查对评估良性肿瘤能够起到十分重要的作用,但在影像学诊断方法的选择上,还需要了解不同影像学检查的诊断价值与意义。超声检查对有经验的医生来说,尽管有一定的定性诊断价值,但由于其受主观因素的影响较大,从安全性和价格考虑,主要用于BLTs的筛查即发现病变和后期的随访观察。增强CT或MRI检查是BLTs诊断和分类的重要方法,可以较为全面了解肝脏病灶的部位、大小、数目,是确定病变性质的重要依据,而诸如普美显肝脏增强MRI等特殊检查则对慢性肝病基础上小结节或占位病变的鉴别定性意义重大,其价值要优于增强CT。超声造影则对已知目标病灶或占位病变的定性诊断有重要作用。临床上经常需要至少联合增强CT、增强MRI、超声造影三种确定性检查方法中的两种检查,才能做出综合判断,初步达成临床诊断。通常情况下,当病变大小≥2 cm时,影像学检查的准确率可在90%以上[7]。当确定性影像学检查出现矛盾或不能明确诊断时,如临床上确有必要,则可考虑病理学检查(细针穿刺活检)以明确诊断,对于特定类型的BLTs,肝穿刺还能进行免疫组织化学染色检测以获取组织分型并指导治疗[8],但对怀疑肝脏海绵状血管瘤的病人应避免活检,因有导致大出血的危险,甚至危及生命。需要指出的是PET-CT主要用于了解肝脏恶性肿瘤的淋巴或远隔脏器的转移情况,对肝脏占位病变本身的诊断价值总体上不如增强CT、增强MRI及超声造影,其对BLTs诊断与鉴别诊断价值不大,轻易选用还可能“困扰”诊断,如将一些炎性病变或良性占位误认为恶性肿瘤,从而误导临床决策,致使临床医生采取不必要的过度治疗,增加病人负担。至于腹腔动脉造影等有创检查则多在不得已情况下,作为肿瘤有效治疗手段如选择经肝动脉栓塞(TAE)时应用。
对于BLTs的诊断,最重要的仍然是与肝脏恶性肿瘤的鉴别以及对于有潜在恶变风险的BLTs的鉴别诊断,这关系到后续治疗中是“积极治疗”还是“随访观察”等方案的选择。值得一提的是,肝胆外科医师有着剖腹或腹腔镜探查的决策权,还有能将手术所见与影像学特点进行对比的得天独厚条件与优势。因此仔细的病例分析与术中观察,对于提高BLTs的诊断水平意义重大。至于常见BLTs的影像学特点,限于篇幅,此处不加论述。
三、BLTs的治疗原则
BLTs的治疗原则:通常根据有无明显症状和是否有恶变可能以及有无并发症等因素进行选择。无论是假性肿瘤(瘤样病变)或真性肿瘤,绝大多数诊断明确且无恶变可能的BLTs应严格控制手术适应证,如局灶性结节性增生(focal nodular hyperplasia,FNH)、炎性假瘤、海绵状血管瘤等多无需治疗;而对于具有恶变可能的病变,例如异型增生结节、HCA、胆管内乳头状瘤、肝脏囊腺瘤、肝脏血管平滑肌脂肪瘤(hepatic angiomyolipoma,HAML)等应选择择期手术治疗[9-10]。此外,对于巨大BLTs伴有影响生命质量的症状者,或者病变增长较快有破裂出血危险者,或者不能与肝脏恶性肿瘤相鉴别者亦应选择手术治疗。
目前临床上的确存在夸大 “无创”或“微创”的优势,不断扩大BLTs的治疗适应证,轻者给病人带来不必要的经济负担,重者则导致病人身心痛苦甚至生命危险,这一现象值得重视与探讨。而规范BLTs的治疗,可谓是避免或纠正临床乱象最为重要的手段或途径,具有极为重要的现实意义[11]。尤其是在肝脏外科进入精准化、微创化、数字化时代的当下,新的理念、方法、技术层出不穷,更有必要强调与明确BLTs的治疗原则与策略,而规范、科学、合理、个体化慎重选择治疗方法是肝胆外科医生的必修课与基本要求。至于各种BLTs具体治疗适应证的选择国内外指南与专家共识均有详细论述,此处不做赘述。
四、提高规诊治水平的途径
在实施BLTs规范化诊治的具体临床实践过程中则应重点遵循并做好以下几个方面,切实提高诊治水平:
1.熟悉并认真解读国内外有关BLTs的诊治指南或专家共识 任何指南与专家共识均有其权威性,是专家们集体智慧与经验的结晶,对指导临床病人制定治疗策略,选择治疗方法具有重要价值。但指南或专家共识不可能包括临床所有问题,况且不同国家或地区的指南或共识,在对待具体疾病上还存在不少分歧。以肝脏海绵状血管瘤为例,我国新近公布的专家共识[12],将血管瘤分成若干临床类型,并根据不同类型提出了治疗方法选择,还对肝血管瘤导致严重精神焦虑症状等都提出了治疗建议。而国内外其他共识或指南则没有提出相关建议,大多将血管瘤的适应证限定在有症状(不论大小),或者增长迅速、与恶性肿瘤难以鉴别等情况。以上腹部症状为例,要甄别其是血管瘤压迫引起抑或周围脏器的病变,或(和)精神焦虑引起常遇到困难,难以确切定论。有时需要多学科会诊,根据症状的特点、血管瘤位置和大小、与周围脏器关系以及相关检查,认真分析做出结论,需要严格避免主观武断,更不能以“血管瘤易破裂出血”为理由,任意扩大治疗适应证。必须清楚:对没有恶变风险、无症状的BLTs如血管瘤、FNH等的治疗风险往往来自手术本身。
2.重视对有恶变潜能的BLTs的生物学特性认识 近年分子生物学技术的发展,对一些常见BLTs的分子生物学特性研究不断深入,其中对HCA的探索最多[13-17]。研究表明HCA由各种类型的克隆性肝细胞增殖组成,包括多个分子亚型。这些分子亚型与并发症(出血、恶性转变)有着紧密的联系。常见的分子亚型包括:①肝细胞核因子-1α(HNF-1α)失活型-HCA(H-HCA);②炎症型腺瘤(I-HCA);③β-连环蛋白活化型-HCA(β-HCA);④音猬因子型-HCA(sh-HCA);⑤未分类的HCA[13]。前两种类型较为常见,占70%以上。不同分子类型的HCA其病理表现与影像学(MRI)特点存在明显差异(表2),且有不同的临床特点,如β-HCA多见于男性,容易恶变,一旦诊断即应手术切除。sh-HCA则易出血,且瘤内多含有出血灶,不建议轻易行穿刺活检[16]。其他类型的HCA则可以根据肿瘤的大小(女性病人,肿瘤<5 cm可以随访观察),增长速度,影像学有无恶变等多种因素决定是否手术切除。

表2 基于分子亚型的肝细胞腺瘤(HCA)诊断
再如HAML,属于较为罕见的间叶性良性肿瘤,但肿瘤本身具有潜在恶性行为,如侵袭性生长、切除后复发和转移等。其病理成分由畸形的血管、平滑肌细胞、成熟的脂肪细胞三种成分构成,根据三种成分比例的不同可分为四型:混合型、脂肪型、平滑肌型和血管型,其中混合型最多见。MRI中不同类型的HAML表现各异,需与不同的肿瘤相鉴别,例如脂肪型需要与脂肪瘤、脂肪肉瘤鉴别,平滑肌型需要与肝细胞癌鉴别,血管型需要与血管瘤鉴别[18-19]。
可见提高对具恶变潜能BLTs不同分型的生物学与影像学特性认识,对细化BLTs规范化处理流程,减少误诊误治,提升BLTs处理精准度,具有重要意义。
3.合理选择治疗方法 理论上对具有手术适应证的BLTs,手术切除应是最为理想的选择。但临床的实际情况往往较为复杂,因为治疗方法的选择不但受制于病人的一般情况、肿瘤的特点和类型、有无肝病背景、创伤大小等与手术风险相关的因素,也受治疗团队的技术水平限制。更需考虑良性肿瘤不同于恶性肿瘤的治疗目标,良性肿瘤病人及其家属对手术风险的承受能力往往较弱,一旦出现严重并发症或生命危险,容易引发纠纷。此时需要术者根据病情与医疗团队的水平,综合判断,做出个体化准确选择。例如对青年女性,近期有妊娠希望,且增长较快,可能存在妊娠期不利影响的肝血管瘤,可先选择TAE控制肿瘤增长[12]。待妊娠结束后再根据肿瘤的增长情况等,决定是否需要择期手术切除。不建议对FNH、血管瘤等良性肿瘤行多次的TAE治疗,因为多次的TAE很可能影响胆管血运,远期可能导致类似硬化性胆管炎的表现,严重者需要肝脏移植来挽救。对术中偶然发现的BLTs,如不存在手术难度,可以考虑予以切除。对多发肝血管瘤,在目标病灶切除后,对分布于其他部位的小病灶,如能简单处理,也可考虑予以剥除、电凝或射频、微波消融等处理。因为在临床上确实存在巨大血管瘤术后多年,残留的小血管瘤快速增大需要再次手术的情况。对紧邻肝门部主要管道的BLTs应禁止选择射频、微波等热消融治疗。实际上良性肿瘤的膨胀性生长仅对肝门管道产生推挤致使“包绕”移位,并不会侵犯管道,很容易手术剥离,此时如果采取热消融,极易损伤血管或胆管,引起严重后果。至于具体采用开腹抑或腹腔镜甚至机器人手术,则完全取决于手术团队的技术水平,其核心是保证病人的安全。应该注意的是对有明确手术适应证的BLTs尤其是囊腺瘤不管是否可疑恶变,如果腹腔镜手术在技术上存在困难,不宜行术前腔镜下活检,应直接开腹手术切除。切除标本再送冰冻病理即可。笔者曾遇1例巨大肝脏囊腺瘤病人,在外院只行腹腔镜下探查活检,致术后长时间感染、发热,严重影响病人的治疗,且增加手术难度。一旦肿瘤存在恶变,则势必导致种植转移,失去根治机会(图1)。

图1 肝脏巨大囊腺瘤腹腔镜下活检后瘤体与腹壁粘连、感染
4.新技术、新理念的引入与拓展 近几年数字医学发展迅速,三维可视化技术对肝脏外科的精准化发展起到了非常重要且无可替代的作用。对复杂BLTs的手术切除,三维可视化技术可以精确计算肝脏与肿瘤体积,了解肿瘤与血管、胆管的关系,对制定手术规划与治疗策略,确定具体术式,增加手术的安全性具有重要价值[20]。如我们通过对1例肝脏巨大血管瘤病人的三维可视化成像,明确了血管瘤与第一肝门重要管道的关系,通过制定精确的手术规划,在手术过程中尤其注意引入肝门板相关技术,沿着肿瘤与肝门板“间隙”,“切肝”与“剥瘤”相结合,在保证足够残留肝脏体积的情况下,安全切除肿瘤,避免了肝门血管、胆管的损伤(图2)。此外,自体血回输技术、围手术期加速康复外科(enhanced recovery after surgery,ERAS)理念的引入与应用,可为BLTs的规范化治疗增加新的内涵;尤其是BLTs多不合并肝硬化等慢性肝病,对探索、制定、推广ERAS技术在肝脏外科应用的规范化基本流程具有重要价值[21-22]。
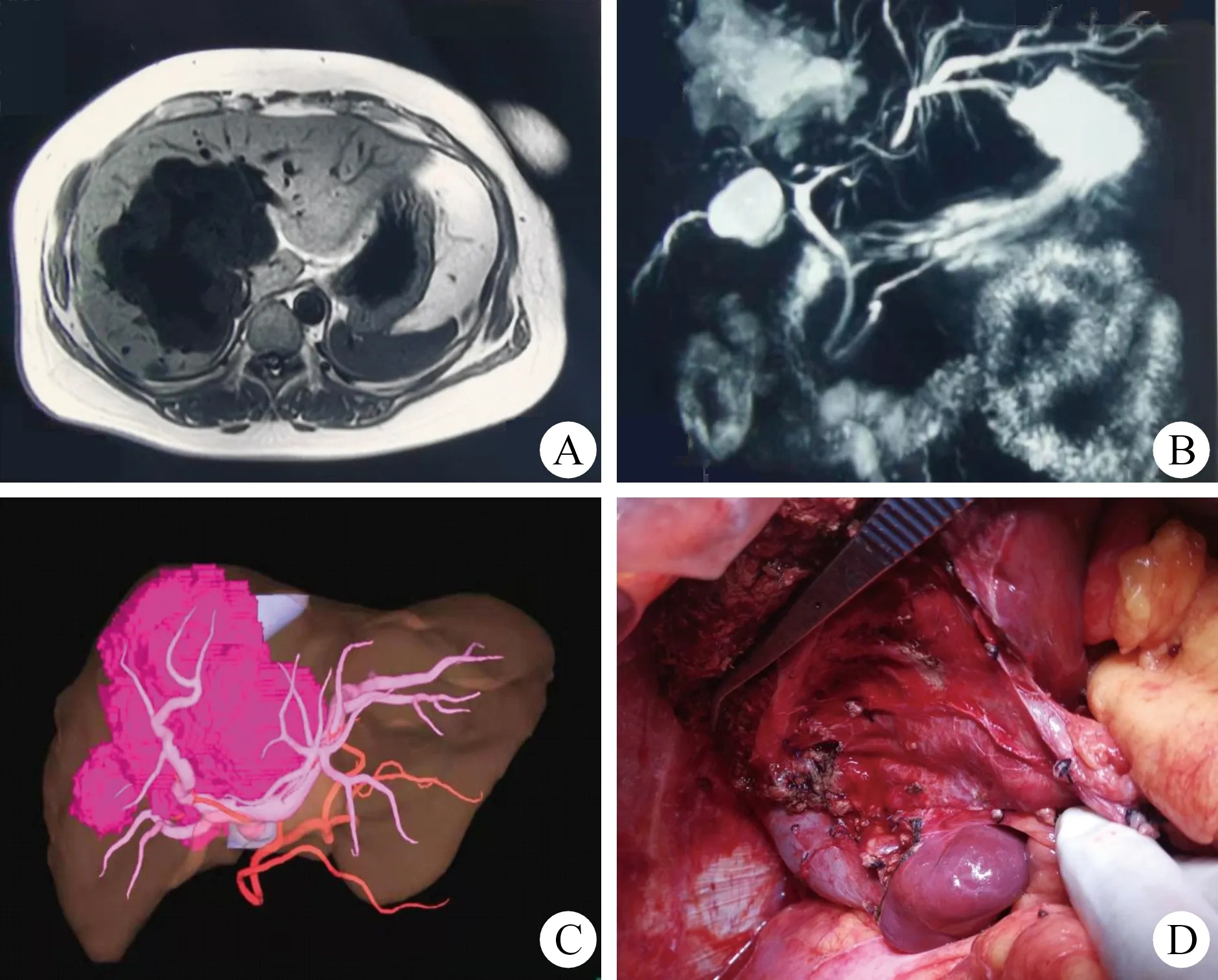
图2 三维可视化技术与肝门板相关技术在肝脏中叶巨大血管瘤手术中的应用 A.肝脏MRI横断面图像显示肝中叶巨大血管瘤;B.肝脏MRCP显示肿瘤和胆管走行间的关系;C.三维可视化成像显示肿瘤与门管系统的关系;D.肝中叶巨大血管瘤切除术后
总之,BLTs种类繁多,组织来源、生长速度、预后因素等不尽相同。近年来相关影像技术的快速发展为BLTs的诊断与鉴别诊断提供了较为可靠的依据,也对治疗术式的选择起到了决定性的作用。但术前要准确诊断所有的BLTs还存在技术难度,尚需更多的经验积累与深入研究。在充分了解国内外相关共识与指南的基础上,以现代精准肝脏外科理念为指导,开展多学科诊治模式做好临床症状的甄别,区别对待是否具恶变潜能的良性肿瘤,严格选择治疗适应证,是进一步提高BLTs规范化、个体化诊治水平的重要途径,也有必要制定一套行之有效,且相对简单易于操作执行的BLTs规范化诊治流程。
