响应面法优化紫甘蓝中花色苷提取工艺及抗氧化性研究
2019-12-26张笑菊蔡逸安李昕悦吴栋磊徐晓阳朱迎春
张笑菊,蔡逸安,李昕悦,吴栋磊,徐晓阳,朱迎春
(山西农业大学食品科学与工程学院,山西太谷030801)
紫甘蓝,又名紫卷心菜,属十子花科(Cmciferae),原产欧洲地中海地区,现在我国大部分地区都有栽种,具有营养丰富、易种、易采、产量大、生长期短、适应性强、价格低廉等特点[1]。
紫甘蓝中含有大量天然色素,其中呈紫色的主要成分是花色苷,是由花青素在自然状态下与各种糖及有机酸结合形成的糖苷,是良好的天然色素,除了做食品添加剂外,还有一定的药用价值[2]。大量研究表明:花色苷具有很强的抗氧化作用[3],可以清除体内的自由基,降低氧化酶的活性,降低甘油酯水平[4],降低低密度脂蛋白中胆固醇含量[5],改善脂蛋白的分解代谢,抑制胆固醇吸收[6],是治疗糖尿病性视网膜病变(diabetic retinopathy,DR)的有效分子,可以预防多种心血管疾病[7-8]。
有机溶剂萃取法被广泛的应用于色素的提取,根据相似相溶原理,提取极性分子花色苷通常使用的提取剂有甲醇、乙醇、丙酮、水等。为了防止提取过程中非酰基化的花色苷的降解,常在提取溶液中加入一定量的盐酸、磷酸等无机酸或酒石酸、柠檬酸等有机酸[9-10]。胡彦新采用单因素试验和三因素三水平的响应面分析法优化桑葚酒渣中花色苷的提取工艺为:加酶量0.2%、提取温度64℃、提取时间145 min,在此试验条件下花色苷的提取率为4.68 mg/g[11]。孟宪军用酸性乙醇作为提取剂,采用响应面分析优化法优化蓝莓花色苷提取工艺为:提取液乙醇体积分数60.65%,料液比1∶20.65(g/mL),提取时间122.53 min,提取温度 50℃[12]。
本试验以紫甘蓝为原料,研究乙醇浓度、料液比、pH值、提取温度和提取时间等因素对花色苷提取率的影响,利用单因素试验和响应面法优化紫甘蓝花色苷的提取工艺,并对其抗氧化性进行测定,以期为后期紫甘蓝花色苷的开发利用提供科学依据。
1 材料与方法
1.1 材料与试剂
鲜紫甘蓝:山西农业大学菜市场;95%乙醇、盐酸、氯化钾、三水合乙酸钠、磷酸二氢钠、磷酸氢二钠、三氯化铁、三氯乙酸、K3[Fe(CN)6]、DPPH、无水乙醇、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[diammonium 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonate),ABTS]、过硫酸钾(均为分析纯):天津市化学试剂一厂。
1.2 仪器与设备
7200型分光光度计:龙尼柯上海仪器有限公司;FA2004电子分析天平:上海华岩仪器设备有限公司;ST2100 pH计:奥豪斯仪器(常州)有限公司;LD5-2B低速离心机:北京雷勃尔医疗器械有限公司;HH恒温水浴锅:余姚市东方电工仪器厂;101-2电热恒温鼓风干燥箱:上海跃进机械厂。
1.3 试验设计与方法
1.3.1 原料处理
将新鲜紫甘蓝洗净晾干切碎,置于40℃鼓风干燥箱中烘干,研磨成粉,80目滤网过筛备用。
1.3.2 紫甘蓝中花色苷的提取
取锥心瓶加入一定量的乙醇为提取溶剂,置于水浴锅中预热,用稀盐酸预调pH值,称取定量紫甘蓝粉加入锥心瓶中,调节pH值,恒温水浴浸提。将浸提液用100目尼龙布过滤,滤液4 000 r/min条件下离心10 min,取上清液为待检样品。
1.3.3 花色苷含量的测定[13-14]
花色苷含量的测定采用紫外pH示差法,即在不同pH值下,花色苷基团发生变化,扫描紫外-可见光谱时,花色苷最大吸收峰发生相应的改变。将待测样品用pH 1.0 KCl溶液(0.025 mol/L)和pH 4.5乙酸钠缓冲溶液(0.4 mol/L)稀释到合适倍数,室温下避光平衡110 min,以蒸馏水作空白,分别在518 nm和700 nm波长处测定吸光度值,根据公式(1)、(2)计算样品中花色苷含量。45℃)对其提取率的影响,确定最佳温度。
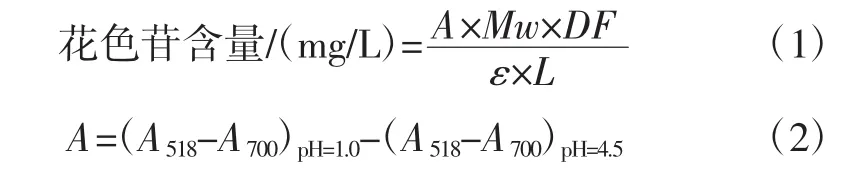
式中:Mw为花色苷的摩尔分子量,449.2 g/mol;DF为稀释倍数;ε为矢车菊素-3-O-葡萄糖苷的摩尔消光系数,26 900 L/(mol·cm);L为光程,0.5 cm;A518和A700分别为518 nm和700 nm处的吸光值。
1.3.4 单因素试验设计
1.3.4.1 乙醇浓度对提取率的影响
在固定料液比 1 ∶35(g/mL)、pH 2.0、提取温度 40 ℃和提取时间3 h条件下,考察不同的乙醇浓度(30%、40%、50%、60%、70%)对花色苷提取率的影响,确定最佳乙醇浓度。
1.3.4.2 料液比对提取率的影响
在固定乙醇浓度40%、pH 2.0、提取温度40℃和提取时间3 h条件下,考察不同的料液比[1∶25、1∶30、1 ∶35、1 ∶40、1 ∶45(g/mL)]对其提取率的影响,确定最佳料液比。
1.3.4.3 pH值对提取率的影响
在固定乙醇浓度40%、料液比1∶35(g/mL)、提取温度40℃和提取时间3 h条件下,考察不同的pH值(1、2、3、4、5)对其提取率的影响,确定最佳 pH 值。
1.3.4.4 温度对提取率的影响
在固定乙醇浓度40%、料液比1∶35(g/mL)、pH 2.0和提取时间3 h条件下,考察不同的温度(30、35、40、
1.3.4.5 时间对提取率的影响
在固定乙醇浓度40%、料液比1∶35(g/mL)、pH 2.0和提取温度40℃条件下,考察不同的提取时间(1、2、3、4、5 h)对其提取率的影响,确定最佳提取时间。
1.3.5 响应面试验设计
固定提取时间3 h和pH 2.0条件下,选取乙醇浓度、料液比和提取温度3个因素为自变量,以每克紫甘蓝粉中提取的花色苷毫克数为指标,进行Box-Behnken试验,试验因素及水平编码见表1。

表1 响应面试验因素水平及编码Table 1 Factor level and coding of response surface methodology experiment
1.4 紫甘蓝花色苷抗氧化活性的研究
1.4.1 总还原力的测定[15]
取0.5 mL待测溶液,0.6 mL 0.2 mol/L磷酸盐缓冲液(pH 6.6),1.5 mL 1.0%K3[Fe(CN)6]置于具塞试管中,迅速混匀,置于50℃水浴中反应20 min,冰水冷却,再加3 mL10%三氯乙酸,混匀后,取出3 mL上清液,加5 mL双蒸水和0.2 mL 0.1%FeCl3,混匀测定各样品在700 nm下的吸光度值A1,作为紫甘蓝的空白对照;然后取 1.5 mL 蒸馏水代替 1.5 mL1.0%K3[Fe(CN)6],测定其在700 nm下的吸光度值A2。紫甘蓝花色苷溶液的总还原力为A0=A1-A2。
1.4.2 DPPH自由基清除率的测定[16]
取1×10-4mol/L DPPH溶液3 mL,加入2 mL复合果蔬汁,摇匀,室温、避光保存下反应20 min,以50%乙醇做空白对照,在517 nm波长下测定吸光度,得吸光度A1。另取3 mLDPPH溶液与2 mL的无水乙醇溶液混合,步骤同上,测得吸光度A2。用2 mL无水乙醇代替DPPH溶液,与3 mL复合果蔬汁混合,避光反应20 min,517 nm下测得吸光度A3,然后按下式计算DPPH自由基清除率。

1.4.3 ABTS+自由基清除率的测定[17-18]
取 5 mL7 mmol/LABTS溶液与 88 μL140 mmol/L过硫酸钾溶液混合,室温、避光条件下静置过夜,形成ABTS+储备液。使用前,用水适当稀释成工作液,要求其在734 nm下的吸光度值为0.7±0.002。取2 mL花色苷样品(用蒸馏水稀释至一定浓度),加入8 mLABTS工作液,混合10 s,在30℃下静置6 min,于734 nm下测定吸光度,得吸光度值A1;空白组用2 mL水代替样品溶液,步骤同上测得吸光度值A2;对照组将2 mL花色苷样品液加入到8 mL蒸馏水中,摇匀、静置,734 nm下得到吸光度值A3。ABTS+自由基的清除率公式如下:

1.5 数据处理
试验均重复3次,结果用平均值±标准偏差表示。数据统计分析采用IBM SPSS Statistics 20.0和Statistix 8.1软件包(St Paul,MN)进行单因素方差分析、差异显著性检验,采用Design-Expert8.0.6软件进行响应面分析,采用SigmaPlot 10.0绘图软件作图。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 乙醇浓度对提取率的影响
图1为乙醇浓度对花色苷提取率的影响。
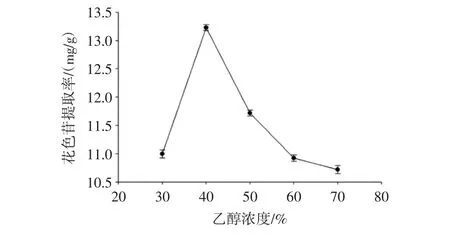
图1 乙醇浓度对花色苷提取率的影响Fig.1 Effect of ethanol concentration on the extraction rate of anthocyanin
由图1可知,当乙醇浓度低于40%时,随着乙醇浓度增加,花色苷提取率逐渐提高。乙醇浓度达到40%,花色苷提取率最高,为13.23 mg/g,当继续增大乙醇浓度时,花色苷的提取率下降,这是因为随着乙醇体积分数增大,提取剂极性变小,偏离了花色苷的极性,从而降低了花色苷的提取率。
2.1.2 料液比对提取率的影响
图2为料液比对花色苷提取率的影响。
由图2可知,料液比低于1∶35(g/mL)时,花色苷提取率随着料液比的增加而增大。料液比为1∶35(g/mL)时,花色苷的提取率达到相对较大的数值14.40 mg/g,继续增大料液比时,花色苷的提取率下降。当料液比大于1∶40(g/mL)时,反应体系较稀薄,既造成提取剂的浪费,也降低了花色苷的提取率。

图2 料液比对花色苷提取率的影响Fig.2 Effect of solid-liquid ratio on the extraction rate of anthocyanin
2.1.3 pH值对提取率的影响
图3为pH值对花色苷提取率的影响。

图3 pH值对花色苷提取率的影响Fig.3 Effect of pH value the extraction rate of anthocyanin
由图3可知,pH值低于2时,随着pH值的升高,花色苷提取率增加。当pH值为2时,花色苷的提取率达到最高值3.85 mg/g,当继续增大pH值时,花色苷的提取率显著下降,当pH值达到5时,花色苷的提取率降低至12.31 mg/g。
2.1.4 温度对提取率的影响
图4为提取温度对花色苷提取率的影响。

图4 提取温度对花色苷提取率的影响Fig.4 Effect of temperature on the extraction rate of anthocyanin
由图4可知,在提取温度低于40℃时,随着提取温度的升高,花色苷提取率逐渐增大并且在40℃时达到最高值13.26 mg/g,当提取温度高于40℃时,花色苷的提取率反而下降。每一种色素都对温度具有一定的耐受性,温度过高会破坏色素的结构和性质,所以40℃为较佳提取温度。
2.1.5 时间对提取率的影响
图5为提取时间对花色苷提取率的影响。

图5 提取时间对花色苷提取率的影响Fig.5 Effect of time on the extraction rate of anthocyanin
由图5可知,提取时间低于3 h时,花色苷提取率随着提取时间的延长而升高。提取时间为3 h时,花色苷的提取率较高,达到11.25 mg/g。提取时间继续延长,花色苷提取率反而下降,这可能是因为时间的延长导致更多的花色苷发生氧化而损失的缘故。
2.1.6 5个单因素试验的方差分析结果
表2为5个单因素试验的方差分析表。
通过 Student-Newman-Keuls(SNK)法计算可知,5个试验因素中的3个因素(温度、料液比和乙醇浓度)对花色苷提取率影响显著,是影响提取率的主要因素;而提取时间和pH值对花色苷提取率影响不显著,是影响提取率的次要因素。
2.2 响应面法优化紫甘蓝花色苷提取工艺
2.2.1 响应面模型的建立及其方差分析
虽然影响紫甘蓝中花色苷提取率的因素很多,但通过表2可知:温度、料液比和乙醇浓度是影响提取率的主要因素,因此,建立以温度、料液比和乙醇浓度为因素水平的响应面试验模型。采用Box-Behnken试验结果见表3,利用Design Expert8.0.6进行多元回归拟合,得到花色苷提取率(Y)对自变量X1(温度)、X2(料液比)、X3(乙醇浓度)的回归方程为:


表3 Box-Behnken响应面试验设计及结果Table 3 Design and results of the Box-Behnken response surface experiment
表4为回归模型的方差分析。

表4 回归模型方差分析Table 4 Variance analysis of regression model
由表4可知,模型极显著(P<0.000 1),失拟项不显著(P=0.823 4),回归模型的决定系数为0.991 6,说明该模型能解释99.16%的变化。该模型拟合度良好,试验误差小,用该模型对紫甘蓝花色苷提取工艺进行优化可以获得良好的效果。模型一次项X1、X2、X3极显著(P<0.01),二次项 X12、X22、X32极显著(P<0.01),交叉项 X1X3、X2X3显著(P<0.05),X1X2不显著。将二次回归方程中的一次项F值作为各参数对花色苷提取率影响的比较依据,得出3因素对花色苷提取率影响的大小依次为:X2>X3>X1,即料液比>乙醇浓度>提取温度。
2.2.2 交互效应分析
因素的交互作用可以从响应曲面坡度变化得到反映。响应面的坡度,表明紫甘蓝花色苷提取量在处理条件发生变化时其响应的灵敏程度。如果响应面坡度非常陡峭,表明当处理条件发生变化时,响应值非常敏感;反之,如果响应面坡度非常平缓,说明提取指标的变异对响应值不敏感。
通过二次多项式回归方程所得到的响应面交互效应如图6所示。

图6 交互效应图Fig.6 Interactive effect
由图6可知X1X3、X2X3对紫甘蓝花色苷提取率的影响极显著(P<0.01),X1X2对紫甘蓝花色苷提取率的影响不显著。
2.2.3 最佳工艺条件的确定与验证
将乙醇浓度、料液比、温度的取值范围分别设定为乙醇浓度为30%~50%,料液比为1∶30(g/mL)~1 ∶40(g/mL),温度 30℃~50℃,并将目标值设定为最大值,通过Design Expert 8.0.6软件获得最优组合为乙醇浓度 41.17%、料液比 1∶35.77(g/mL)、温度 41.13℃。在此最优组合中,理论最佳紫甘蓝花色苷的提取率为14.01%,根据实际条件的限制将最优组合修正为:乙醇浓度 40%、料液比 1∶36(g/mL)、温度 41.0℃,在此试验条件下的提取率为13.92 mg/g,与预测值接近。
2.3 紫甘蓝花色苷抗氧化性的结果与分析
2.3.1 总还原力的测定
紫甘蓝花色苷的总还原能力见图7。

图7 紫甘蓝花色苷的总还原能力Fig.7 Total reduction ability of anthocyanins from red cabbage
由图7可以看出,在试验所选浓度范围内(30 mg/L~180 mg/L),吸光值随着紫甘蓝花色苷浓度的增大而增大,这说明紫甘蓝花色苷的总还原能力(即抗氧化能力)随着浓度的增大而增大。
2.3.2 DPPH自由基清除率的测定
紫甘蓝花色苷对DPPH自由基的清除率见图8。

图8 紫甘蓝花色苷对DPPH自由基的清除率Fig.8 Scavenging rates of red cabbage anthocyanin on DPPH free radicals
由图8可以看出,在试验所选浓度范围内(30mg/L~180 mg/L),紫甘蓝花色苷对DPPH自由基的清除率随着紫甘蓝花色苷浓度的升高,呈现折线上升的趋势,当溶液浓度为150 mg/L时,清除能力达到了84.50%,说明紫甘蓝花色苷具有较强的清除DPPH自由基的能力。
2.3.3 ABTS+自由基清除率的测定
紫甘蓝花色苷对ABTS+自由基的清除率见图9。

图9 紫甘蓝花色苷对ABTS+自由基的清除率Fig.9 Scavenging rates of red cabbage anthocyanin on ABTS+free radicals
由图9可以看出,在试验所选浓度范围内(30mg/L~180 mg/L),紫甘蓝花色苷对ABTS+自由基的清除率随着紫甘蓝花色苷浓度的升高而升高,当溶液浓度为150 mg/L时,清除能力达到了97%,由此可以看出紫甘蓝花色苷具有较强的清除ABTS+自由基的能力。
3 结论
本试验以花色苷提取率为考察目标,利用响应面分析法对紫甘蓝花色苷的提取工艺进行优化,最终获得花色苷提取最佳工艺条件为乙醇浓度为40%、料液比为1∶36(g/mL)、温度41℃,在此试验条件下花色苷的提取率为13.92 mg/g。通过总还原力的测定、清除DPPH自由基和ABTS+自由基的体外抗氧化试验,证实紫甘蓝花色苷具有较好的体外抗氧化能力。其抗氧化水平随着浓度的增大而增加,尤其是对ABTS+自由基的清除能力较强,当紫甘蓝花色苷浓度为150 mg/L时,清除能力达到了97%。
