体外抗氧化试验筛选抗氧化肽的方法比较
2019-12-26
(1.河北农业大学食品科技学院,河北保定071000;2.河北科技大学生物工程学院,河北石家庄050000)
体外化学试验是筛选具有清除自由基活性物质的重要手段,目前报道的有4大类24种方法,这些方法在不同的研究中均有应用[1-6],由于不同实验室采用的方法不同,筛选得到的具有抗氧化活性物质的可比性和重复性存在一定的差异。特别是在抗氧化肽开发应用中,探索具有重复性较强的体外化学试验方法将有利于抗氧化肽高通量快速筛选。本研究以公认的体外抗氧化性较强的还原性谷胱甘肽[7-8]为研究对象,对在抗氧化肽开发过程中常用的清除DPPH·[9-10]、ABTS+·、·O2-、·OH,测定超氧化物歧化酶(superoxidedismutase,SOD),还原Fe3+和Cu2+能力试验进行对比研究验证,从而寻找出适合在抗氧化肽初筛中的最适方法。
1 材料与方法
1.1 材料与试剂
谷胱甘肽、ABTS、DPPH:北京博奥拓达科技有限公司;抗氧化肽 467(Pro-His-Cys-Lys-Arg-Met)、抗氧化肽568(Pro-Phe-Thr-Arg-Asn-Tyr-Tyr-Val-Arg-Ala-Val-Leu-His-Leu)、抗氧化肽 567(Val-Tyr-Gln-Phe-Leu)、抗氧化肽 580(Trp-Asn-Trp-Ala-Asp):上海强耀生物科技有限公司;维生素C(vitamin C,VC):北京索莱宝科技有限公司;无水乙醇、铁氰化钾、无水硫酸铜、新铜试剂、磷酸氢二钠、磷酸二氢钠、三氯乙酸、三氯化铁、醋酸铵、冰乙酸-脂肪酸蔗糖酯均为分析纯:天津市凯通化学试剂有限公司;超氧阴离子自由基(superoxide radical,·O2-)测试盒、羟自由基(hydroxyl free radical,·OH)测试盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒:南京建成生物工程研究所。
1.2 仪器与设备
UV-1700PC紫外可见分光光度计:上海美析仪器有限公司;HW·SY11型电热恒温水浴锅:北京市长风仪器仪表公司。
1.3 主要试剂配置
1.3.1 抗氧化肽母液配制
水溶性肽:蒸馏水直接溶解,配制成1 g/mL的溶液;水溶性较差的肽:加入乳化剂脂肪酸蔗糖酯配置成1g/mL的乳浊液。根据试验的实际需要,用蒸馏水稀释成一系列不同浓度的使用液。
1.3.2 VC对照品配制
将VC配制成0.1 mg/mL的VC母液。根据试验的实际需要,用蒸馏水将VC母液稀释至不同倍数,得到一系列不同浓度的使用液。
1.4 方法
1.4.1 清除DPPH·试验
DPPH·测定过程中试剂的加量见表1。按照表1加入配好的试剂,摇匀后室温避光反应30 min,517 nm测定其吸光度。按照公式(1)进行清除率计算。
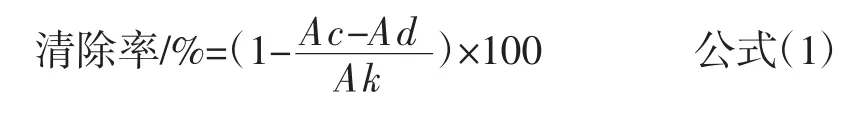

表1 DPPH·测定过程中试剂的加量Table 1 The amount of reagent in the DPPH·determination
式中:Ac表示3 mL DPPH·与1 mL待测样避光反应30 min,517 nm测定的吸光度;Ad表示1 mL待测样与3 mL乙醇避光反应30 min,517 nm测定的吸光度;Ak表示3 mL DPPH·与1 mL样品溶剂避光反应30 min,517 nm测定的吸光度。
1.4.2 清除ABTS+·试验
由于ABTS+·在734 nm处进行测定,多肽在该波长下对测定没有干扰。按照表2进行测定,根据公式(2)计算清除率。

表2 ABTS+·测定过程中试剂的加量Table 1 The amount of reagent in the ABTS+·determination
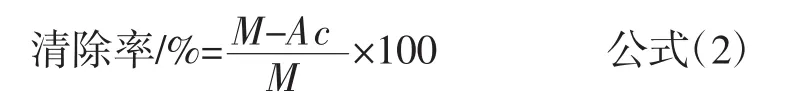
式中:Ac表示3.6 mL ABTS+·与0.4 mL待测样避光反应5 min,734 nm测定的吸光度;M表示3.6 mL ABTS+·与0.4 mL样品溶剂避光反应5 min,734 nm测定的吸光度。
1.4.3 清除羟自由基(·OH)试验
按照试剂盒使用说明进行试验,适当调整样品浓度。
1.4.4 清除超氧阴离子自由基(·O2-)试验
按照试剂盒使用说明进行试验,适当调整样品浓度。
1.4.5 铁离子还原能力试验
试验步骤和试剂配制参考文献[11]。
1.4.6 铜离子还原能力试验
试验步骤和试剂配制参考文献[12]。
1.4.7 测定超氧化物歧化酶(SOD)能力试验
按照试剂盒使用说明进行试验,适当调整样品浓度。
1.5 数据处理
数据处理采用orign8.0和SPSS15.0;其中DPPH·、ABTS+·、·O2-、·OH 和 SOD 采用被测量的拮抗剂的半抑制浓度(half maximal inhibitory concentration,IC50)评价清除效果,根据清除率与浓度的对数呈线性的关系利用orign8.0回归得到直线方程,而后计算得到;Fe3+和Cu2+还原能力采用吸光度在0.72(记做IC0.72)处的浓度评价比较,将吸光度与浓度做线性方程后求得0.72处吸光度的浓度。为了避免操作过程中造成的误差,以VC作为参考。最后对自由基清除评价采用相对清除率(relative clearance rate,RIC),即抗氧化肽的清除率与VC的清除率的比值见公式(3)。
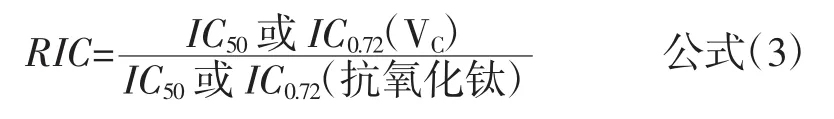
2 结果与分析
2.1 同一试验人员7种方法测定谷胱甘肽抗氧化能力结果比较
采用1.4的试验方法测定谷胱甘肽抗氧化能力,结果见表3。
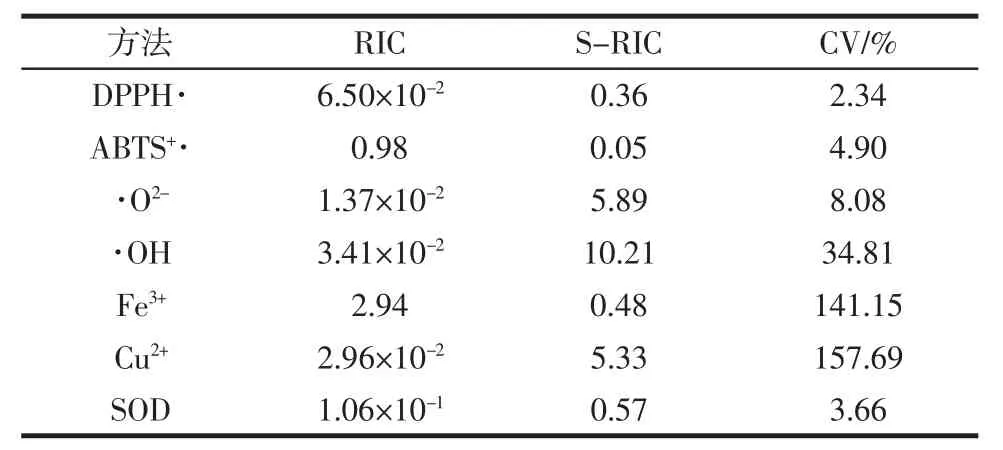
表3 谷胱甘肽抗氧化能力比较Table 3 The comparison of antioxidant capacity of glutathione
从表3中可知,采用不同方法评价谷胱甘肽的抗氧化能力结果存在较大的差异,这样对于新型抗氧化肽的开发存在无法比较的问题。从各种方法的标准偏差(standard deviation,S-RIC)和变异系数(coefficient of variation,CV)发现,采用化学性质较稳定的DPPH·和测定SOD活性的试验对谷胱甘肽的抗氧化性评价较为合理。
DPPH·作为一种稳定的化学自由基在测定过程中受外界因素影响小,精密度较高可以作为抗氧化肽筛查方法考虑;SOD具有较强的活性,在体内正常代谢过程中存在,黄嘌呤氧化法已经较为成熟,在较多的书籍中均有该方法的详细描述,试验结果发现无论是精密度还是变异系数均可以接受,也可以作为抗氧化肽筛选方法的一种。而·OH作为最活泼的羟自由基,其变异系数达到了34.81%,这样对于新型抗氧化肽的筛选非常不利。ABTS+·法虽然精密度高,但每进行一次测定均需重新校准测定液吸光度,这也是导致其变异系数较大的原因。采用·O2-筛选抗氧化肽的精密度和变异系数均不理想,采用金属离子铁和铜进行筛选,虽然精密度较好,但是变异系数较大,因此也不太适合新型抗氧化肽的筛选。
2.2 利用DPPH·和SOD法评价合成抗氧化肽568、580、467和 567
利用确定的DPPH·和SOD的方法测定4种合成的抗氧化肽的活性结果见表4。从表4中利用这两种方法测定4种肽的变异系数较低,说明这两种方法可以有效的作为筛选抗氧化肽的方法。
2.3 不同试验人员对7种方法测定谷胱甘肽抗氧化能力的作用结果
为了验证试验的稳定性另外3名试验人员按照试验步骤和方法进行试验,结果如表5所示。
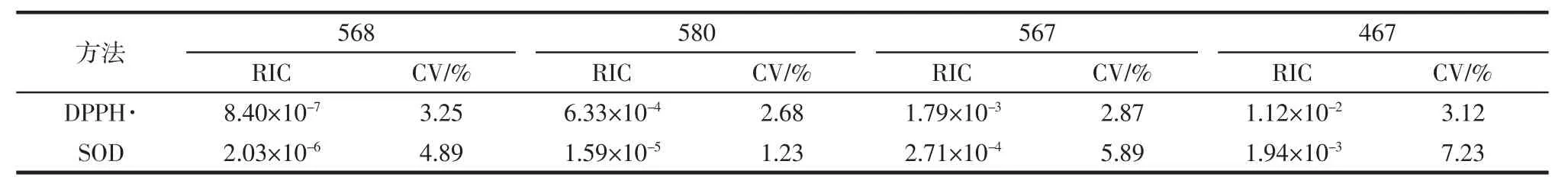
表4 4种合成抗氧化肽对DPPH·和SOD的作用结果Table 4 The removal of DPPH·and SOD by four synthetic antioxidant peptides
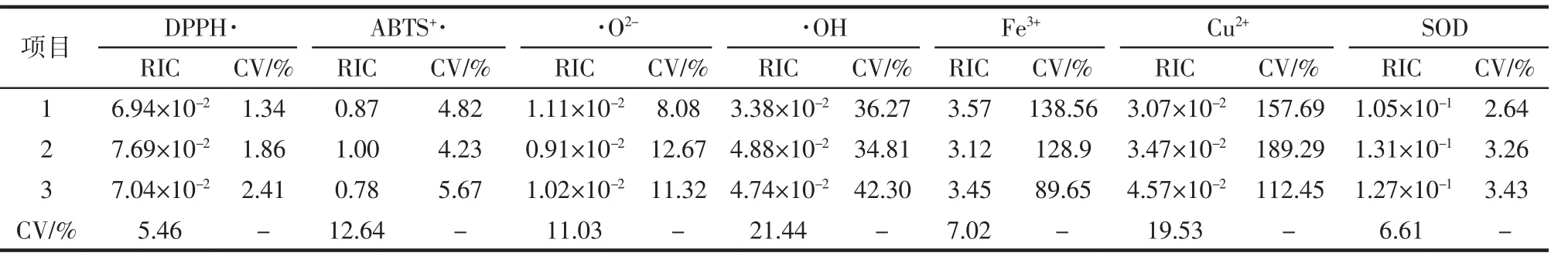
表5 谷胱甘肽抗氧化能力比较的验证试验结果Table 5 The verification test results of glutathione antioxidant capacity comparison
从表5中可知对于同一试验人员和不同试验人员来讲,DPPH·和SOD的变异系数都比较低,因此采用这两种方法进行抗氧化肽的筛选具有可行性。
2.4 不同试验人员对4种抗氧化肽作用DPPH·和SOD的试验结果
另外3名试验人员对合成的4种肽进行了验证试验,结果如表6所示。
从表6中可知无论是试验人员自己的变异系数还是不同试验人员之间的变异系数均在可接受范围内,从而证实采用DPPH·和SOD进行抗氧化肽的筛选具有可行性。
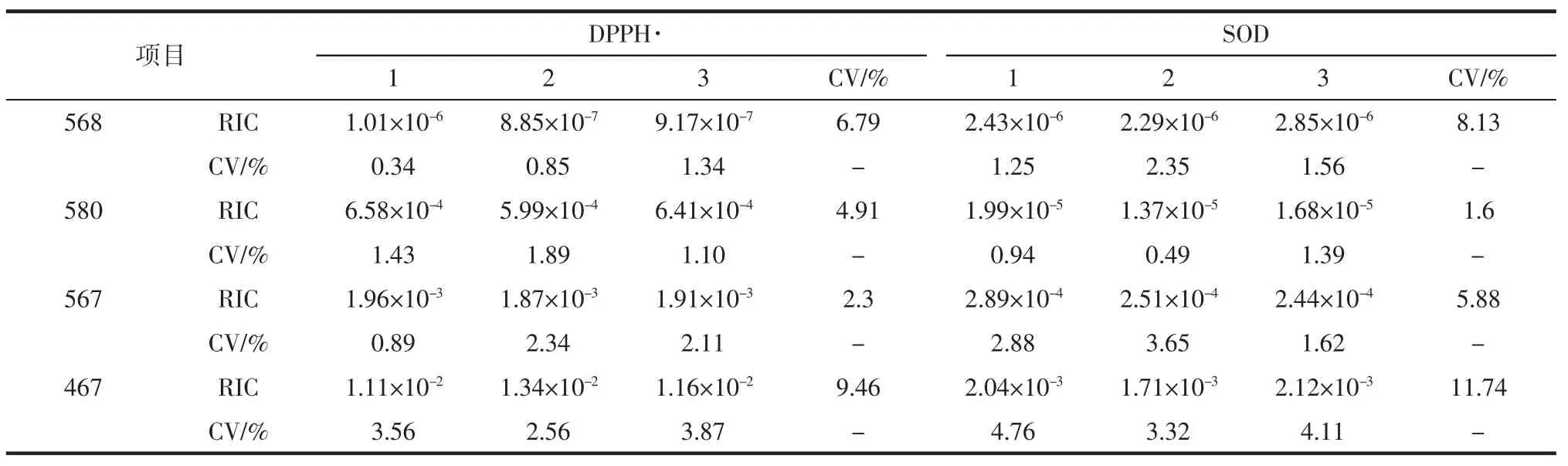
表6 验证4种合成抗氧化肽对DPPH·和SOD的作用结果Table 6 The verification of the effects of four synthetic antioxidant peptides on DPPH·and SOD
3 结论
在筛选抗氧化肽方法的试验中,·OH作为最活泼的羟自由基,其变异系数高达34.81%;ABTS+·法、采用金属离子铁和铜进行筛选,虽然精密度高,但变异系数较大;采用·O2-筛选抗氧化肽的精密度和变异系数均不理想。因此以上5种方法均不太适合抗氧化肽的筛选。
清除DPPH·和SOD无论是精密度还是变异系数均在可接受范围,具有良好的稳定性、易操作性及重现性,因此清除DPPH·和SOD可以作为抗氧化肽初步筛选的方法。
