手术机器人技术标准的现状与发展
2019-12-26茅龚丹
茅龚丹
上海电气集团股份有限公司 中央研究院 上海 200070
1 研究背景
国家中长期规划、国务院医药卫生体制改革以及战略新兴产业等都提出了高端医疗器械的发展。其中,手术机器人在现阶段已经实现产业化和商业化,且大规模用于临床。有数据显示,2016年全球遥控型手术机器人市场规模约38亿美元,预期到2021年可增长至93亿美元。美国为手术机器人最大的市场,最为典型的产品有美国直觉外科公司(Intuitive Surgical)的达芬奇外科手术机器人[1-2]。
2 手术机器人关键技术
手术机器人主要有以下关键技术。
优化设计技术:机器人的基础理论和关键技术,包括机构、控制、传感、人机交互、遥控操作和材料等。
系统集成技术:系统集成要面向具体的手术流程需求,考虑在手术室如何开展应用,注意人机功效学的研究。
远程手术技术:目前主流的手术机器人大多是主从操作式机器人,未来的趋势则为远程手术。
手术导航技术:基于机器人系统的三维手术规划,利用医学影像实时重建及融合处理,以及手术机器人高精度三维跟踪定位和可视化技术,实现在手术中实时标定及配准[3]。
软体机器人技术:软体机器人技术是现在比较流行的一项技术,未来在医疗领域的前景也会是非常好的。
辅助介入治疗技术:介入治疗的关键是将精密的手术器械准确地置入到病灶靶点,以达到治疗的目的,这就需要解决治疗前的科学设计,治疗中的准确定位、稳定穿刺和器械扶持等难题。机器人辅助系统是解决上述传统介入治疗问题的重要途径。
医疗与互联网大数据:由于新技术的出现,医用机器人也需要与时俱进,包括数字医疗、移动医疗、穿戴式医疗和远程医疗。
3 国内手术机器人相关政策动态
为了支持手术机器人的发展,在手术机器人的关键技术研发方向、产业政策和标准体系建设方面相继出台了系列文件[4]。表1列出了我国手术机器人相关的主要政策文件及要点。
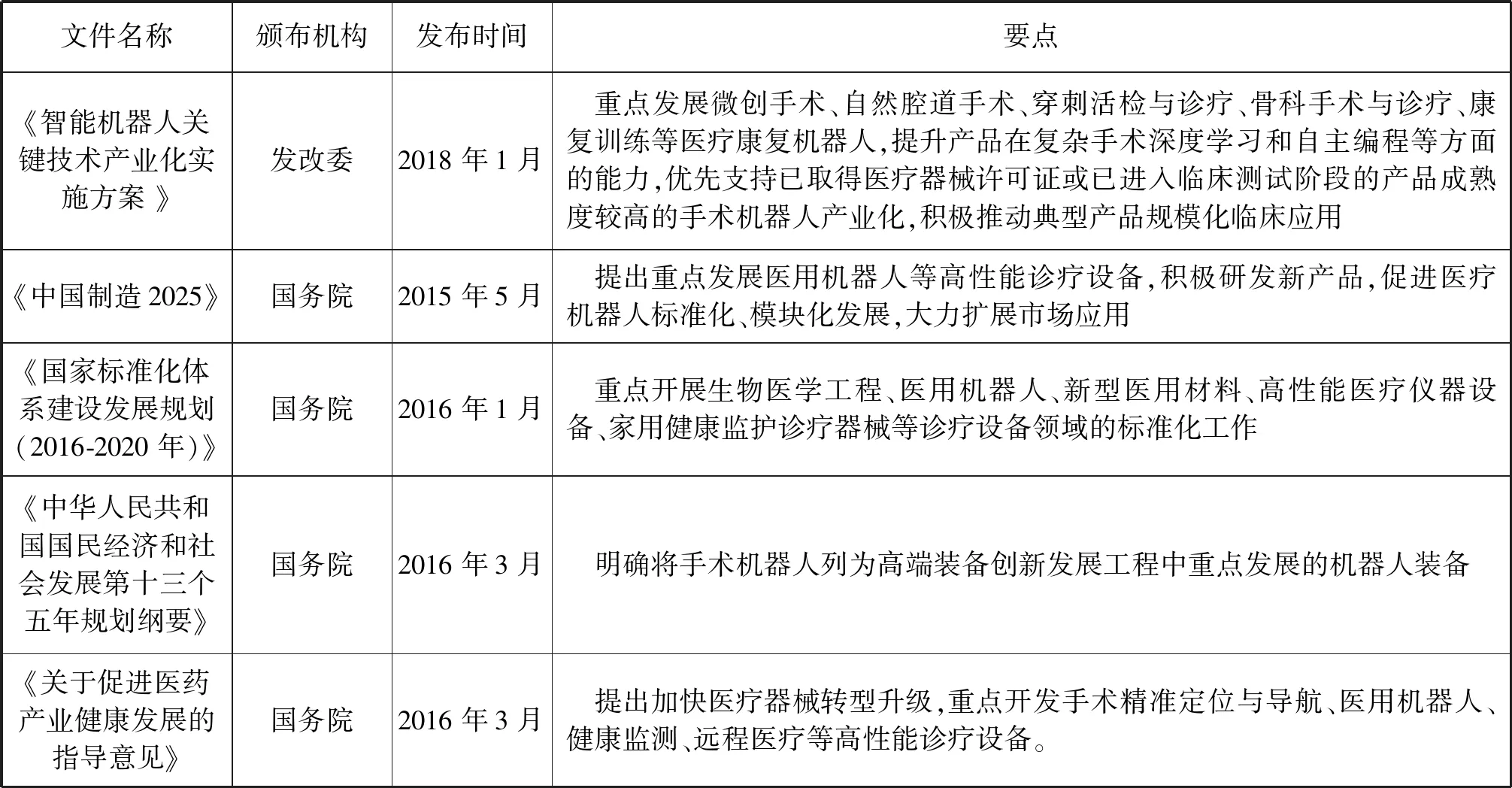
表1 手术机器人相关政策及要点
4 国外手术机器人标准研究现状
4.1 国际标准化工作情况
ISO/TC299/JWG35(医疗手术机器人工作组)和IEC/TC62(医用电气技术委员)正在联合进行医疗手术机器人的基本安全要求和性能特殊要求的制定[5]。
国际机器人技术联合会标准化委员会医疗机器人标准化委员会(ISO/TC184/SC2/JWG9),由ISO/TC184/SC2(国际机器人技术委员会)和IEC/SC62A(医用电气技术委员会)共同组成,针对采用机器人技术医疗设备的相关安全标准开展工作。由JWG9工作组针对医疗诊断和治疗中用于外科手术、康复、成像等方面的机器人和机器人装置开展相关标准制定工作,并正在机器人自主程度方面形成相关的技术报告。
4.2 IEC(国际电工委员会)标准化工作情况
IEC/TC62(医用电气技术委员会)主要负责制定医疗器械生产、安装和使用与电气设备相关的国际标准,包括应用于健康护理的电气设备,电气系统和软件,以及它们对患者、医生等相关人员和环境产生的影响。
5 国内手术机器人标准体系
由于手术机器人的标准及审评指导原则等规范性文件的缺失,导致国家对手术机器人的安全及性能的监管存在较大的风险,为了保障用械安全以及进一步推动手术机器人的行业发展,国家已启动医疗机器人的标准体系构建及标准的研究制定等工作。我们应该从以下两方面开展工作:① 加强手术机器人标准体系,建设开展手术机器人标准体系的顶层设计,加快研究制订产业急需的各项技术标准,支持手术机器人评价标准的研究和验证,积极参与国际标准制修订;② 建立手术机器人检测认证体系,建立并完善以国家手术机器人检测与评定中心为代表的手术机器人检验与认证机构,推动建立手术机器人第三方评价和认证体系,开展对手术机器人整机及关键功能部件的检测与认证工作[4]。
中国手术机器人技术领域相关的技术标准主要包括:腹腔微创手术机器人、骨科手术器械产品、关节置换手术设备等相关技术标准。
其中,腹腔微创手术机器人标准有:GB 9706.1—2007《医用电气设备 第1部分:安全通用要求》、GB 9706.15—2008《医用电气设备 第1-1部分:安全通用要求 并列标准:医用电气系统安全要求》、YY 0709—2009《医用电气设备 第1-8部分:安全通用要求 并列标准:通用要求,医用电气设备和医用电气系统中报警系统的测试和指南》、GB/T 14710—2009《医用电气环境要求及试验方法》、GB 11244—2005《医用内窥镜及附件通用要求》、YY 0068.1—2008《医用内窥镜 硬性内窥镜 第1部分:光学性能及测试方法》、YY 0068.2—2008《医用内窥镜 硬性内窥镜 第2部分:机械性能及测试方法》、YY 0068.3—2008《医用内窥镜 硬性内窥镜 第3部分:标签和随附资料》、YY 0068.4—2008《医用内窥镜 硬性内窥镜 第4部分:基本要求》、YY 1081—2011《医用内窥镜 内窥镜功能供给装置 冷光源》、YY/T 0708—2009《医用电气设备 第1-4部分:安全通用要求 并列标准:可编程医用电气系统》、YY/T 0664—2008《医疗器械软件 软件生命周期过程》、YY 0505—2012《医用电气设备 第1-2部分:安全通用要求 并列标准:电磁兼容 要求和试验》、GB/T 16886.1—2011《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》、GB 9706.4—2009《医用电气设备 第2-2部分:高频手术设备安全专用要求》、YY 91057—1999《医用脚踏开关通用技术条件》、YY 0316—2008《医疗器械 风险管理对医疗器械的应用》、IEC 62366—2007《医疗器械 将可用性工程应用于医疗器械》[6]。
骨科手术器械产品标准[7]有:GB/T 230.1—2009《金属材料 洛氏硬度试验 第1部分:试验方法(A、B、C、D、E、F、G、H、K、N、T标尺)》、GB/T 1220—2007《不锈钢棒》、GB/T 2965—2007《钛及钛合金棒材》、GB/T 3190—2008《变形铝及铝合金化学成分》、GB/T 3191—2010《铝及铝合金挤压棒材》、GB/T 3621—2007《钛及钛合金板材》、GB/T 3623—2007《钛及钛合金丝》、GB 4234—2003《外科植入物用不锈钢》、GB/T 5132.5—2009《电气用热固性树脂工业硬质圆形层压管和棒 第5部分:圆形层压模制棒》、GB 5133—1985《层压棒》、GB/T 8013.1—2007《铝及铝合金阳极氧化膜与有机聚合物膜 第1部分:阳极氧化膜》、GB/T 12672—2009《丙烯腈-丁二烯-苯乙烯(ABS)树脂》、GB/T 13810—2007《外科植入物用钛及钛合金加工材》、GB/T 16886.1—2011《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》、GB/T 16886.3—2008《医疗器械生物学评价 第3部分:遗传毒性、致癌性和生殖毒性试验》、GB/T 16886.5—2003《医疗器械生物学评价 第5部分:体外细胞毒性试验》、GB/T 16886.10—2005《医疗器械生物学评价 第10部分:刺激与迟发型超敏反应试验》、GB 18278.1—2015《医疗保健产品灭菌 湿热 第1部分:医疗器械灭菌过程的开发、确认和常规控制要求》、GB 18279.1—2015《医疗保健产品灭菌 环氧乙烷 第1部分:医疗器械灭菌过程的开发、确认和常规控制的要求》、GB 18280.1—2000《医疗保健产品灭菌 辐射 第1部分:医疗器械灭菌过程的开发、确认和常规控制要求》、GB/T 19633—2005《最终灭菌医疗器械的包装》、YY/T 0149—2006《不锈钢医用器械 耐腐蚀性能试验方法》、YY/T 0294.1—2016《外科器械 金属材料 第1部分:不锈钢》、YY 0341—2009《骨接合用无源外科金属植入物通用技术条件》、YY/T 0316—2008《医疗器械 风险管理对医疗器械的应用》、YY/T 0466.1—2009《医疗器械 用于医疗器械标签、标记和提供信息的符号 第1部分:通用要求》、YY/T 0806—2010《医用输液、输血、注射及其他医疗器械用聚碳酸酯专用料》、YY 0904—2013《电池供电骨组织手术设备》、YY/T 1052—2004《手术器械标志》、YY 1122—2005《咬骨钳(剪)通用技术条件》、YY/T 1127—2006《咬骨钳》、YY/T 1135-2008《骨剪》、YY 1137—2005《骨锯通用技术条件》、YY 0904—2013《电池供电骨组织手术设备》、YY 0346—2002《骨接合植入物 金属股骨颈固定钉》、YY 91071—1999《平骨凿》、YY 91072—1999《圆骨凿》、YY 91073—1999《医用凿凿切性能测试方法平凿、圆凿》、YY 0117.1—2005《外科植入物 骨关节假体锻、铸件Ti6Al4V钛合金锻件》、YY 91133—1999《手枪式手摇骨钻》、YY 0017—2016《骨接合植入物 金属接骨板》、YY 0018—2016《骨接合植入物 金属接骨螺钉》、HG/T 4070—2008《硅橡胶板》、JB/T 7991.4—2001《电镀超硬磨料制品磨头》等。
手术导航控制系统标准的制定还在起步阶段,暂没有直接相关的技术标准。目前,应用较广泛的光学定位系统制造商主要有加拿大NDI公司、德国博医来Brain Lab公司和美国Medtronic公司等。其中,NDI公司的Polaris系统被认为是手术导航定位系统的国际标准,精度可达0.1 mm。
关节置换手术设备标准有:GB/T 12417.1—2008《无源外科植入物 骨接合与关节置换植入物 第1部分:骨接合植入物特殊要求》、GB/T 12417.2—2008《无源外科植入物 骨接合与关节置换植入物 第2部分:关节置换植入物特殊要求》、WS/T 335—2011《人工髋、膝关节置换术》、YY 0118—2016《关节置换植入物 髋关节假体》等[9]。
综上所述,在腹腔微创手术机器人、骨科手术器械产品、关节置换手术设备等相关的标准比较多,填补了我国手术机器人领域标准的空白,为手术机器人的研发及其性能评价发挥了非常大的作用。在手术导航控制系统方面标准制定的还比较少,相关标准的制定还处于起步阶段。
6 结束语
Research &Market发行的《全球手术机器人市场报告书》中预测分析了全球外科用机器人市场规模截至2025年将达到127亿美元。近年来,国内企业也在制定相应的技术标准,如上海爱立峰医疗科技有限公司、新博医疗技术有限公司、新奥博为技术有限公司、深圳安科高技术股份有限公司、北京天智航医疗科技股份有限公司等,都制定了手术导航控制系统的企业标准。会后的手术机器人,在工作空间分析与路径规划系统方面,向着个性化方向发展;在虚拟现实手术系统方面,向着远程化方向发展;在人机交互系统方面,向着智能化方向发展[10]。与此同时,手术机器人在智能控制、集成设计、远程通信、整机检验方面的技术标准也在加快制定中。
