对虾白斑综合征病毒可视化环介导等温扩增(LAMP)快速检测方法的建立
2019-12-26吴丽云
吴丽云
(福建省水产研究所,福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门 361013)
凡纳滨对虾(Litopenaeusvannamei),属十足目(Decapoda)、对虾科(Penaeidae),又称南美白对虾[1],原产地南美洲,喜好泥沙底质,为广温广盐性热带性种类,具有生长迅速、抗逆能力较强、适合高密度养殖等特点[2]。自1988年引入中国以来,凡纳滨对虾的养殖在国内逐渐推广,市场对凡纳滨对虾产品的需求量日益增加,对虾养殖业不断发展,其产量也随技术的日趋成熟而不断提高。据2019年的中国渔业统计年鉴显示,2018年我国凡纳滨对虾养殖产量达176×104t,占对虾养殖总产量的85.8%,成为我国对虾养殖最主要的品种[3]。
近年来,在对虾养殖业集约化、高密度养殖过程中,一些负面影响也在逐渐显现,如养殖环境恶化、种质退化、病害频发等问题日益严重,影响了我国对虾养殖业稳定可持续发展[4]。其中,对虾病害的大范围、广泛性的暴发对产业的危害尤为严重,导致经济效益大幅下滑,给行业带来难以估量的损失。目前对对虾养殖业危害较大的病原有白斑综合征病毒(White spot syndrome virus,WSSV)、虾血细胞虹彩病毒(Shrimp hemocyte iridescent virus,SHIV)、传染性皮下及造血组织坏死病毒(Infectious hypodermal and hematopoietic necrosis virus,IHHNV)及急性肝胰腺坏死综合征(Acute hepatopancreatic necrosis syndrome,AHPNS)等,而对虾病毒病是养殖过程中的主要病害,对产业造成了巨大的威胁,已成为制约对虾养殖的主要问题之一[5-9]。
白斑综合征病毒属于线头病毒科(Nimaviridae),是危害较为严重的水生动物病毒之一[10]。该病毒粒子包被双层囊膜,基因组为环状、双链DNA,大小约为300 kb,预测编码约180种蛋白[11]。它的宿主范围广泛,包括所有养殖和野生的海洋虾蟹、虾蛄、桡足类和淡水虾[12],该病毒传播迅速,致病性强,感染该病毒后在3~10 d内死亡率最高可达到100%[13],对我国及世界对虾养殖业造成巨大经济损失。1995年世界动物卫生组(Office International Des Epizooties,OIE)、联合国粮农组织(Food and Agriculture Organization,FAO)和亚太地区水产养殖发展网络中心(Network of Aquaculture Centres in Asia-Pacific,NACA)同时将WSSV列为需要监测的重要水生动物疫病。2009年被我国农业部公告第1125号《一、二、三类动物疫病病种名录》列为水生生物一类动物疫病病毒。因此开发新的操作简单、快速、准确度高、灵敏性好的检测WSSV技术,加强对SPF亲虾及产生的幼虾、成虾携带感染情况的实时监测,对预防和降低该病的暴发,保障我国对虾养殖业的持续健康发展具有重要意义。
环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP)是一种灵敏的链置换反应,它可以在恒温下不到1 h内将几个拷贝扩增至109拷贝的一种新型等温扩增技术。Notomi等[14]在2000年报道,可在恒温条件下(60~65℃左右)对目标基因进行高效扩增,因此可在水浴锅或者普通的金属浴内完成扩增反应;与其他技术相比,该技术具有明显优势,如诊断特异性强、分析灵敏度高、仪器设备要求低、操作方法简单等。许多针对特定病原的诊断方法己经开发为体外诊断试剂盒并进入常规检测应用[15-17]。
本文基于环介导等温扩增技术(LAMP)建立了对虾白斑综合征病毒(WSSV)现场快速高灵敏度检测试剂盒。根据WSSV基因组保守区序列,设计合成5条LAMP特异性引物,利用钙黄绿素为检测指示剂,建立了直观、可视化的WSSV-LAMP快速检测方法。通过临床检测验证适用性,以期在对虾基层养殖场实现对虾WSSV诊断特异、简便、快速以及高效的目标。
1 材料与方法
1.1 材料和试剂
凡纳滨对虾采自于厦门市海沧厦兴龙水产种苗有限公司。NNV(神经坏死病毒核酸)、IHHNV(传染性皮下及造血组织坏死病毒核酸)、MCP(细胞肿大虹彩病毒核酸)、柠檬酸杆菌、绿脓杆菌、沙门氏菌、金黄色葡萄球菌、虾核酸(凡纳滨对虾总核酸)和鱼核酸(斜带石斑鱼总核酸)等核酸均由本实验室保存。BstDNA聚合酶购自纽英伦(NEB)生物技术(北京)有限公司;DNA提取试剂盒购自天根生化科技(北京)有限公司;pMD18-T载体购自宝生物工程(大连)有限公司;序列合成和DNA测序委托上海捷瑞生物工程有限公司完成;其余试剂为国产或进口分析纯。
1.2 对虾DNA提取及PCR检测
取健康凡纳滨对虾鳃部组织约20 mg,参照天根基因组DNA提取试剂盒说明书提取DNA。并以此为模板参照GB/T 28630.2—2012白斑综合征(WSD)诊断规程中套式PCR检测法,同时以双蒸水作为阴性对照进行PCR扩增[18]。
1.3 白斑综合征病毒阳性质粒的构建
根据GenBank数据库公布的白斑综合征病毒基因,委托上海捷瑞生物工程有限公司合成该病毒的部分核酸序列。将该合成的核酸序列与克隆载体pMD18-T连接,转化至E.coliDH5α感受态细胞。细胞涂布在含有100 μg/mL氨苄青霉素的LB固体培养平板上。从平板挑选30个单菌落进行菌落PCR鉴定重组子(pMD18-WSSV),产物经1.2%琼脂糖凝胶电泳检测后,交由上海捷瑞生物工程有限公司测序,鉴定重组质粒pMD18-WSSV中的插入序列,以用作后续LAMP体系建立的阳性核酸标准模板。
1.4 白斑综合征病毒LAMP引物及序列
根据白斑综合征病毒基因保守序列,采用PrimerExplorer V4(http://primerexplorer.jp/e/)设计LAMP引物,选取内引物FIP/BIP的Tm值在65℃左右,外引物F3/B3的温度为60℃左右,FIP/BIP的5′端dataG值小于等于-4 kcal/mol,F3/B3的3′端dataG值小于等于-4 kcal/mol,GC含量在40%~60%之间,引物扩增片段在200 bp左右的引物作为初筛引物,并分别记为WSSV-1、WSSV-2、WSSV-3和WSSV-4,每套引物分别包含2条内引物(FIP和BIP)、2条外引物(F3和B3)和1条环引物(LF或LB)(表1)。所有引物交由上海捷瑞生物工程有限公司合成。
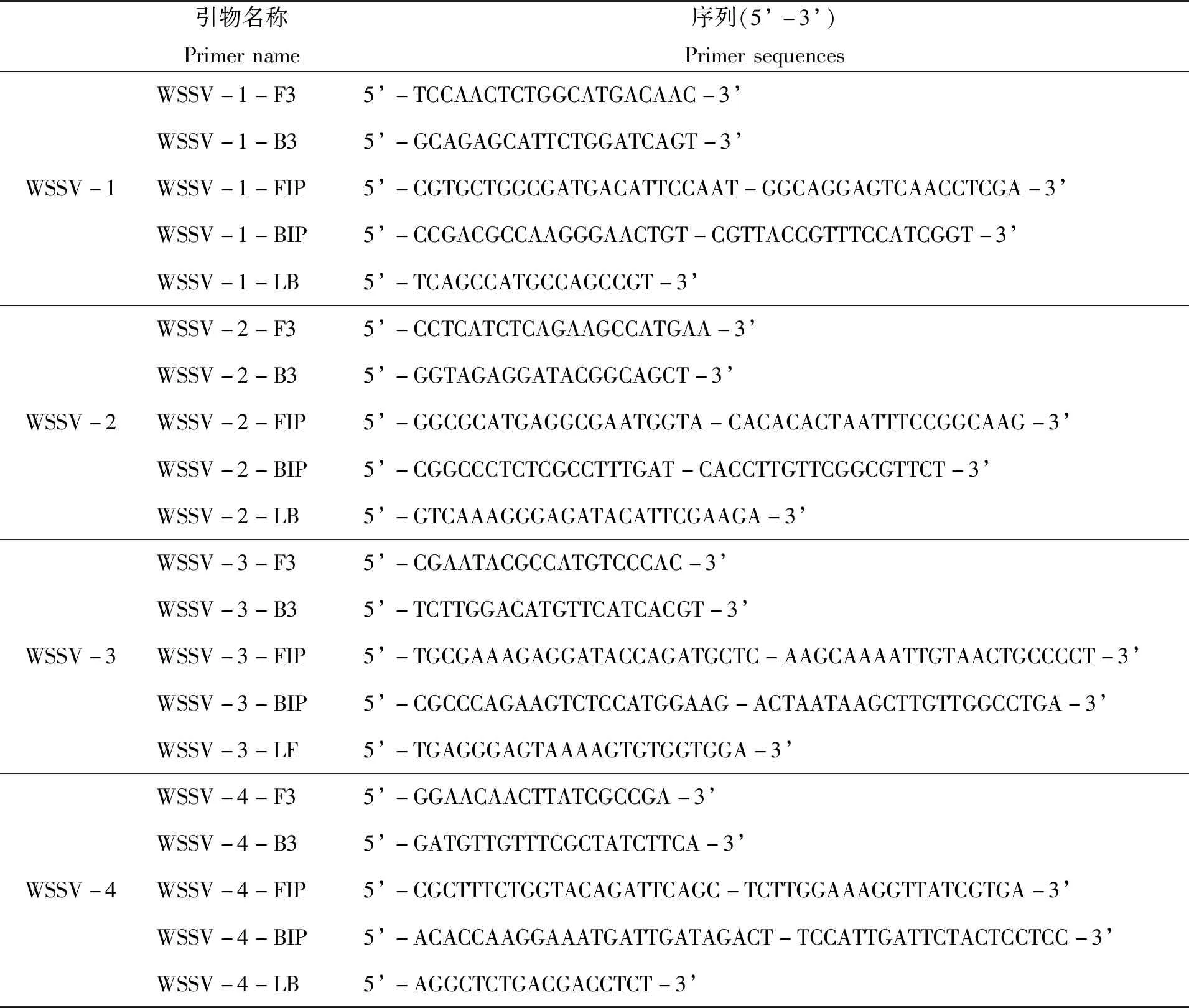
表1 LAMP引物及序列Tab.1 The primer sequences of LAMP
1.5 白斑综合征病毒LAMP引物初步筛选
采用总体积为25 μL的反应体系,其中包括:FIP、BIP各40 pmol,F3、B3各5 pmol,LF或LB 20 pmol,BstDNA聚合酶(8U)1.0 μL,钙黄绿素(FD)1.0 μL,dNTPs(10 mM) 2.5 μL,2×反应缓冲液(20 mM Tris-HCl pH 8.8,10 mM(NH4)2SO4,10 mM KCl,2 mM MgSO4,0.1% Triton X-100和0.8 M甜菜碱)12.5 μL,模板2 μL,双蒸水补齐。将第1套(WSSV-1)、第2套(WSSV-2)、第3套(WSSV-3)和第4套(WSSV-4)引物组分别以1.3中制备的重组质粒pMD18-WSSV为阳性核酸样本和双蒸水为模板,在63℃下进行LAMP反应60 min,反应结束后,通过观察扩增曲线分析扩增结果。
1.6 白斑综合征病毒LAMP引物的假阳性验证
采用1.5中建立的25 μL反应体系,将WSSV-1、WSSV-2、WSSV-3和WSSV-4引物组分别以1.2中制备的阴性核酸样本和双蒸水为模板,在63℃下进行LAMP反应60 min,反应结束后,通过观察扩增曲线分析扩增结果。
1.7 白斑综合征病毒引物特异性实验
采用1.5中建立的25 μL反应体系,分别对WSSV-2、WSSV-3和WSSV-4引物组进行特异性试验。通过在添加和不添加FD的条件下(添加FD的为在反应体系中加入1.0 μL的钙黄绿素),分别以阳性核酸、水、NNV(神经坏死病毒核酸)、IHHNV(传染性皮下及造血组织坏死病毒核酸)、MCP(细胞肿大虹彩病毒核酸)、柠檬酸杆菌、绿脓杆菌、沙门氏菌、金黄色葡萄球菌、虾(凡纳滨对虾总核酸)和鱼(斜带石斑鱼总核酸)为模板,在63℃下进行LAMP反应60 min。反应结束后,通过观察扩增曲线和紫外下观察扩增产物的颜色变化,分析检测结果,验证3套引物组在LAMP检测方法中的特异性。
1.8 白斑综合征病毒引物灵敏度检测
将1.3中制备的pMD18-WSSV阳性质粒(5 μg)加入500 μL双蒸水,终浓度为10 ng/μL;并以双蒸水将其进行10倍递进稀释,使其浓度依次为1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL、10 fg/μL、1 fg/μL、100 ag/μL、10 ag/μL、1 ag/μL、0.1 ag/μL等。
采用1.5中建立的25 μL反应体系,分别对WSSV-2、WSSV-3和WSSV-4引物组进行灵敏度检测。分别以1 ng/μL(2.25×108copies/μL)、100 pg/μL(2.25×107copies/μL)、10 pg/μL(2.25×106copies/μL)、1 pg/μL(2.25×105copies/μL)、100 fg/μL(2.25×104copies/μL)、10 fg/μL(2.25×103copies/μL)、1 fg/μL(225 copies/μL)、100 ag/μL(22.5 copies/μL)、10 ag/μL(2.25 copies/μL)以及1 ag/μL(0.225 copies/μL)浓度的pMD18-WSSV阳性质粒为模板,在LAMP实时浊度仪上63℃反应60 min。反应结束后,通过观察扩增曲线和紫外下观察扩增产物的颜色变化,分析检测结果,验证3套引物组在LAMP检测方法中的特异性。
2 结果
2.1 白斑综合征病毒LAMP引物初步筛选
根据设计的4套引物组对WSSV保守序列进行LAMP扩增结果(图1)显示,LAMP引物组WSSV-1在60 min内未能扩增出阳性核酸,故舍弃。引物组WSSV-2、WSSV-3和WSSV-4在30 min左右能够有效扩增阳性核酸,且以双蒸水作为检测模板的阴性对照在60 min内未出现非特异扩增,所以该3套引物初步能够使用,待后续继续验证。

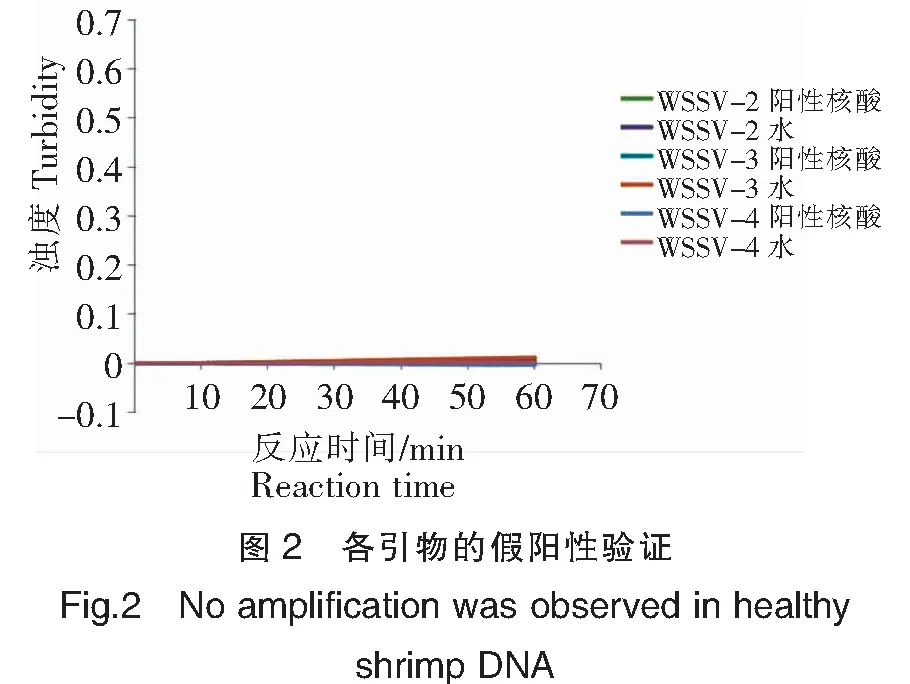
2.2 白斑综合征病毒LAMP引物的假阳性验证
LAMP引物验证结果(图2)显示,在以阴性核酸为模板时,3套LAMP引物检测结果均未出现非特异性扩增。结合2.1初步筛选的结果,将WSSV-1引物舍弃,进一步验证WSSV-2、WSSV-3和WSSV-4三套引物的特异性和灵敏度。
2.3 白斑综合征病毒引物特异性实验
采用建立的LAMP反应体系检测3套引物的特异性,结合浊度仪获得的扩增曲线(图3,未加FD)与紫外光下扩增产物的颜色变化结果(图4,加FD)可知:WSSV-2引物对阳性核酸样本检测呈阳性,而对双蒸水、NNV、IHHNV、MCP、柠檬酸杆菌、绿脓杆菌、沙门氏菌、金黄色葡萄球菌、虾和鱼等样本的检测均呈阴性,无交叉反应,与预期结果一致,具有高的特异性。


注:1.阳性核酸;2.水;3.NNV;4.IHHNV;5.MCP;6.柠檬酸杆菌;7.绿脓杆菌;8.沙门氏菌;9.金黄色葡萄球菌;10.虾;11.鱼。图6、8同此。
Notes.1.Positive control;2.Water;3.NNV;4.IHHNV;5.MCP ;6.CitrobacterWerkman and Gillen;7.Pseudomonas;8.Salmonella;9.Staphylococcusaureus;10.Shrimp;11.Fish.Figure 6 and Figure 8 were the same as Figure 4.
结合获得的扩增曲线(图5,未加FD)与紫外光下扩增产物的颜色变化结果(图6,加FD)可知:WSSV-3引物对阳性核酸样本检测呈阳性,而对双蒸水、NNV、IHHNV、MCP、柠檬酸杆菌、绿脓杆菌、沙门氏菌、金黄色葡萄球菌、虾和鱼等样本的检测均呈阴性,无交叉反应,与预期结果一致,具有高的特异性。


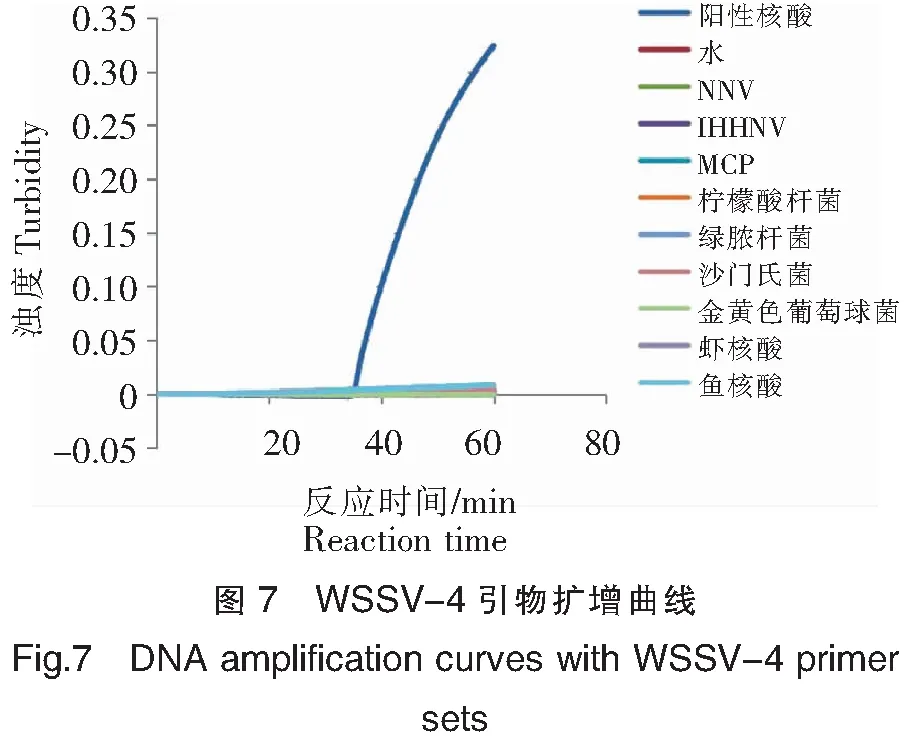
结合获得的扩增曲线(图7,未加FD)与紫外光下扩增产物的颜色变化结果(图8,加FD)可知:WSSV-4引物对阳性核酸样本检测呈阳性,而对双蒸水、NNV、IHHNV、MCP、柠檬酸杆菌、绿脓杆菌、沙门氏菌、金黄色葡萄球菌、虾和鱼等样本的检测均呈阴性,无交叉反应,与预期结果一致,具有高的特异性。

2.4 白斑综合征病毒引物灵敏度检测
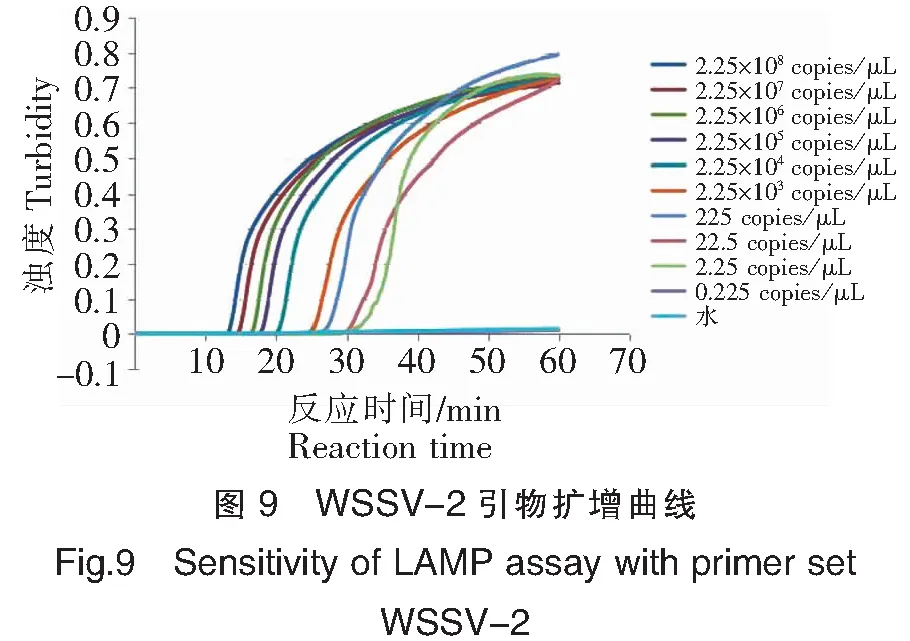
以10倍系列稀释的pMD18-WSSV阳性质粒模板进行LAMP检测引物灵敏度结果(图9和图10)显示:阳性质粒含量在2.25×108~2.25 copies/μL均能检测到扩增,而双蒸水对照未见扩增,可见WSSV-2引物组的最低检测限约为2.25~0.225 copies/μL。

注:1.2.25×108copies/μL;2.2.25×107copies/μL;3.2.25×106copies/μL;4.2.25×105copies/μL;5.2.25×104copies/μL;6.2.25×103copies/μL;7.225 copies/μL;8.22.5 copies/μL;9.2.25 copies/μL;10.0.225 copies/μL;11.水。下图同此。
Notes:1.2.25×108copies/μL;2.2.25×107copies/μL;3.2.25×106copies/μL;4.2.25×105copies/μL;5.2.25×104copies/μL;6.2.25×103copies/μL;7.225 copies/μL;8.22.5 copies/μL;9.2.25 copies/μL;10.0.225 copies/μL;11.Water.The same as below.
以10倍系列稀释的pMD18-WSSV阳性质粒模板进行LAMP检测引物灵敏度结果(图11和图12)显示:阳性质粒含量在2.25×108~2.25 copies/μL均能检测到扩增,而双蒸水对照未见扩增,可见WSSV-3引物组的最低检测限约为2.25~0.225 copies/μL。
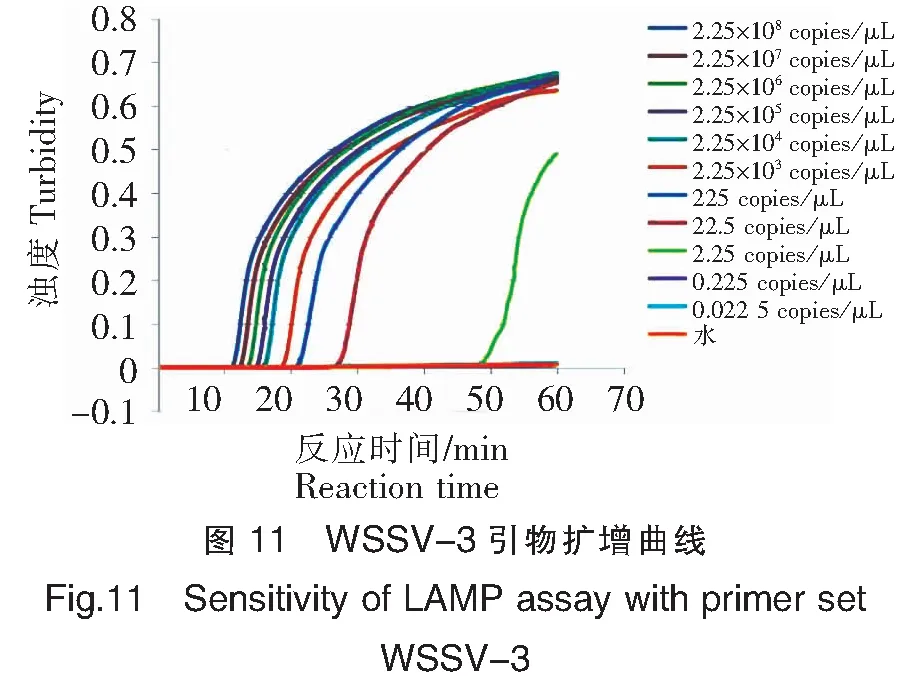

注:11.0.022 5 copies/μL;12.水。
Notes:11.0.022 5 copies/μL;12.Water.
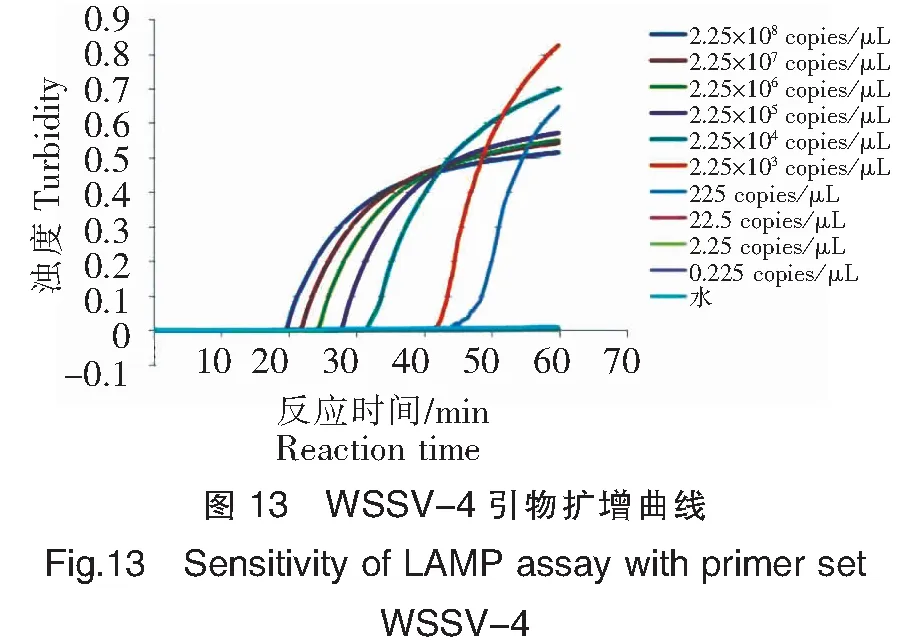
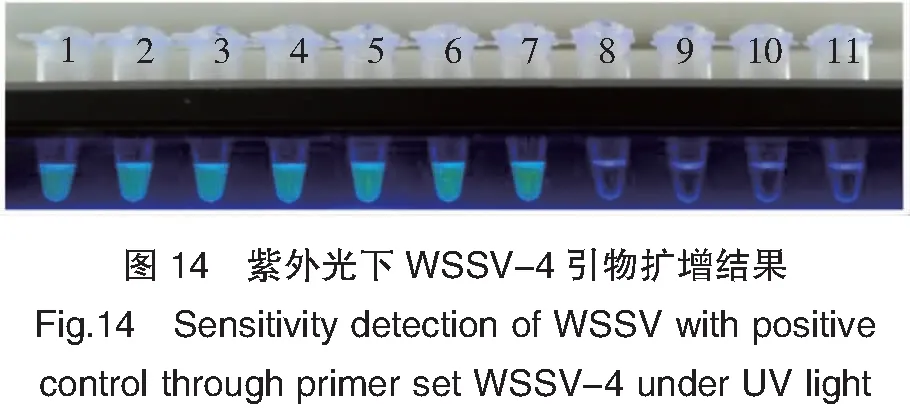
WSSV-4灵敏度试验结果如图13和14所示,病毒阳性质粒含量在2.25×108~225 copies/μL均能检测到扩增,而双蒸水对照未见扩增,可见WSSV-4引物组的最低检测限约为225~22.5 copies/μL。
3 讨论
随着中国对虾养殖业的蓬勃发展,产业面临着诸多问题和挑战,例如病原微生物大量繁殖、高密度养殖导致对虾抗病力下降、野生资源匮乏等严重影响了我国水产养殖业的发展。20世纪90年代初,对虾白斑综合征(White Spot Disease,WSD)暴发于我国台湾地区,此后迅速传播至整个亚洲及欧美的主要对虾养殖地区,对对虾养殖业造成了重大损失。对虾养殖业中,WSSV在个体间或群体间的主要传播方式是水平传播,研究表明口和消化道是宿主感染WSSV的主要途径[19]。如对虾病发病养殖场排出的废水、育苗时期购入的携带WSSV病毒的虾苗、运输过程中盛放感染WSSV病害水产品的设备等,都会造成WSSV大范围的水平传播。目前市面上仍没有针对WSSV病毒非常有效的阻断或防治手段,尽早检出和清除病原携带者、培育或选择无病原种苗、切断传播途径等是最有效的预防措施,因此早期快速的诊断和筛查在疫病防控中起到了决定性作用[20],而建立快速简便的体外诊断技术则为疫病监测提供了必要的保障。
目前,已建立了许多诊断WSSV的方法,包括:目视检查法、传统组织学检测方法、电子显微技术、生化检验法、细胞培养方法、免疫学的 ELISA 技术、分子生物学的核酸探针和PCR技术等。近年来,巢式PCR作为一种有效的检测方法已经被广泛应用于WSSV的检验中,然而PCR对试验的要求高,复杂的变温过程消耗了较长时间(4~8 h),同时需要较高的检测费用、昂贵的PCR仪器以及对检测人员较高的技术要求,导致无法对疫情做到早期、快速的预测,从而大大限制了其在对虾养殖场的实际应用。2000年Notomi等[14]研发的LAMP技术,针对靶基因设计特殊引物和应用具有链置换活性的BstDNA聚合酶,高效扩增靶基因。LAMP扩增过程依赖识别靶序列6个独立区域,反应特异性很强,并且核酸扩增过程是在恒温条件下进行,普通水浴锅或有稳定热源的设备就能满足反应要求,检测成本大大降低;反应形成一系列不同长度茎环结构的 DNA 产物,可以通过电泳、SYBR Green I染色、观察沉淀等方法检测。LAMP快速检测方法是目前最简便、快捷的病毒检测技术,快捷且成本低,结果判定形象直观,特别适用于现场快速诊断病毒性疾病。
本研究建立了一种对虾白斑综合征病毒的LAMP检测方法,利用3套引物(内引物、外引物和环引物)识别、扩增靶核苷酸序列,极大提高了反应的特异性。根据WSSV引物的初步筛选和验证的LAMP实验结果显示,LAMP引物组WSSV-1在60 min内未能扩增出阳性核酸,故舍弃。其余3套引物(WSSV-2、WSSV-3、WSSV-4)能在30 min左右将阳性核酸扩增出来,且以双蒸水为对照60 min内未出现非特异扩增,同时,LAMP引物的假阳性实验结果显示,WSSV-2、WSSV-3、WSSV-4对阴性核酸样品没有出现非特异性扩增,说明该3套引物能够使用。特异性实验结果显示,未加FD和加入FD的WSSV-2、WSSV-3、WSSV-4引物组对阳性核酸样本都能够有效检测出,而对NNV、IHHNV、MCP、柠檬酸杆菌、绿脓杆菌、沙门氏菌、金黄色葡萄球菌、虾、鱼和双蒸水等都未检测出,特异性高。灵敏度实验结果显示,WSSV-2引物组的最低检测限约为2.25~0.225 copies/μL;WSSV-3引物组的最低检测限约为2.25~0.225 copies/μL;WSSV-4引物组的最低检测限约为225~22.5 copies/μL。其中WSSV-2和WSSV-3引物组的最低检测限均低于何琳等[21]建立的LAMP方法最低检测限100 copies/μL;冯华等[22]建立的LAMP方法最低检测限10 copies /μL;马芳等[23]建立的LAMP方法最低检测限100 copies /μL。综上结果表明,本研究建立的LAMP检测方法具有操作简便、快速、灵敏度高、特异性强等优点,能够满足实际应用中的WSSV高灵敏度检测需求。可以检出对虾白斑综合征发病早期或隐性感染阶段养殖对虾体内携带的较低数量的病毒,可在现场对养殖对虾进行及时检测,于白斑综合征发病早期检测出 WSSV 的存在,为养殖者和管理者采取必要的措施提供参考,降低白斑综合征暴发的概率。
