光周期对四指马鲅视网膜结构和视蛋白表达的影响及其生物信息学分析
2019-12-26区又君温久福李加儿蓝军南
周 慧,区又君*,温久福,李加儿,蓝军南,2
(1.中国水产科学研究院南海水产研究所,农业农村部南海渔业资源开发利用重点实验室,广东 广州 510300;2.上海海洋大学,水产与生命学院,上海 201306)
视觉是生物重要的感觉之一。由于生存环境复杂多样,硬骨鱼类的视觉器官在形态学以及细胞学方面呈现出高度的多样性,是研究鱼类生态习性及鱼类对环境适应性的良好素材。四指马鲅(Eleutheronematetradactylum)隶属于鲻形目(Mugiliformes)马鲅亚目(Polynemoidei)马鲅科(Polynemidae)四指马鲅属[1],是一种暖温性的海水鱼类,亦能在咸淡水和淡水中生存,喜栖息于近海、江河入海口、泥沙质海底等地带[2-3]。其体长而侧扁,胸鳍下方具有4条长短不一的丝状鳍条,能用于探测食物[4-5]。四指马鲅具有生长迅速、肉质细嫩鲜美等特点,且养殖空间和消费群体巨大,具有广阔的经济前景。目前有关该鱼的研究主要集中在基础生物学、渔业资源调查、形态分类学、遗传学以及人工繁育等方面[6-10],该鱼的视觉器官对环境的适应性研究尚未见报道。
脊椎动物视觉系统中结构和功能之间有着特定的关系。视觉器官是从中枢神经系统发生的,有眼球及其辅助装置两大部分构成,眼球由屈光系统、视网膜和眼球壁组成[11-12]。视网膜是一层透明的薄膜,是形成视觉的生理基础[13]。视网膜上的感光细胞承担着将光信号转换为电信号重要作用。对鱼类视觉特性的研究发现,感光细胞的细胞种类和排列方式的不同反映了不同的视觉特性。由单锥细胞和双锥细胞形成的镶嵌结构能提高视网膜对运动物体的敏感性,有利于鱼类在弱光条件下分辨运动的物体[14-15]。视觉系统作为感觉系统重要组成部分,与生物体的进化是密不可分的。如进化地位较为低等的两栖类和爬行类生物的感光细胞,虽然在数量上不占优势,但其外节直径却较长,以此来增加感光细胞外节膜盘的面积和对光能的吸收,进而提高视敏度[16-17]。
视蛋白(Opsin)是一种跨膜蛋白[18],约含有350个左右的氨基酸残基,属于G蛋白偶联受体家族[19]。根据其对视觉成像是否有直接作用而分视觉系统视蛋白和非视觉系统视蛋白两大类[20]。视觉系统视蛋白主要存在于视杆细胞和视锥细胞中,在视觉图像形成方面起着至关重要的作用。视杆细胞中的视蛋白为视紫红质(Rhodopsin,RH1)。视锥细胞中的视蛋白根据吸收光谱范围的不同又可分为以下4种:长波长敏感视蛋白(Long wave sensitive opsin,LWS),又可称之为红色敏感视蛋白(Red opsin);中波长敏感视蛋白(Rhodopsin-like,RH2),又可称之为绿色敏感视蛋白(Green opsin);短波长敏感视蛋白(Short wave sensitive opsin 2,SWS2),又可称之为蓝色敏感视蛋白(Blue opsin);超短波长敏感视蛋白(Short wave sensitive opsin 1,SWS1),又可称之为紫外敏感视蛋白(Ultraviolet opsin)[21-22]。
本文以四指马鲅为研究对象,研究了在不同光照周期下饲养的四指马鲅视网膜的组织结构、细胞超微结构的变化,运用生物信息学和分子生物学的方法研究了四指马鲅RH1、LWS、RH2、SWS2视蛋白的核酸序列和氨基酸序列及其在不同光照周期条件下表达量的变化,以期了解视觉器官的结构和功能,以及视蛋白对不同光照周期的适应性变化,为深入了解视觉器官对不同光照周期的适应性机制奠定基础,同时有利于阐明其行为机制,为其资源保护及模式的选择提供理论依据,亦为鱼类视觉特性和动物视觉器官的进化研究提供参考。
1 材料与方法
1.1 样本来源
四指马鲅仔鱼由本课题组在南海水产研究所珠海试验基地培育所得。光照周期分别设置为昼夜比0 h∶24 h和24 h∶0 h共2个光照周期组,12 h∶12 h为对照组。每组3个平行组,每个平行组30尾。实验在光照强度为(500±100) lux、水温25℃、盐度5的条件下养殖60 d。在养殖的第30天和第60天时摘取眼球组织(每组取6尾)并迅速放入液氮中冷冻,24 h后转移至-80℃超低温冰箱保存,用于转录组测序及荧光定量PCR。每组另取9尾,分别用于光学显微结构观察和透射电子超微结构观察。用于光学显微结构观察的眼球组织置于10%的中性福尔马林中固定。固定24 h后转入70%的乙醇中保存。用于透射电子超微结构观察的眼球组织先用2.5%戊二醛(pH 7.4)于4℃固定24 h,而后在解剖镜下剥离视网膜,再置于2.5%戊二醛(pH 7.4)4℃固定24 h。
1.2 四指马鲅视网膜组织学切片和超微切片
制作组织学切片的样品的脱水、透明、浸蜡和包埋等过程参考马定昌等[23]的方法,先将样品经24 h流水冲洗,然后置于70%~100%乙醇梯度脱水、二甲苯透明、石蜡包埋。而后进行厚度为5 μm的连续石蜡切片,H.E染色后用中性树脂封片。在德国Axio Scope A1型光学显微镜下对染色切片进行观察分析并拍照。制作超微切片的样品的脱水、包埋、切片及染色的过程参考林先智的方法[24]。
1.3 视蛋白核酸序列分析
在四指马鲅眼球组织的转录组数据库(百迈克生物科技有限公司)中筛选得到RH1、RH2、SWS2、LWS的核酸序列,运用美国国立生物技术信息中心(NCBI)的ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)预测和翻译视蛋白序列的开放阅读框,使用ExPASy的Protparam tool(http://web.expasy.org/protparam/)预测视蛋白氨基酸序列的相对分子质量、等电点和稳定性指数,利用ExPASy的ProtScale(http://web.expasy.org/protscale/)对视蛋白氨基酸序列的疏水性进行预测,通过欧洲生物信息研究所(EMBL-EBI)的InterProScan 5(http://www.ebi.ac.uk/Tools/pfa/iprscan5/)预测视蛋白氨基酸的结构域,使用SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html) 预测视蛋白氨基酸的二级结构。
1.4 荧光定量PCR
使用RNAiso Plus(Total RNA提取试剂)并参照说明书提取于-80℃超低温冰箱保存的四指马鲅眼球总RNA。其后用琼脂糖凝胶电泳检测RNA分子的完整性,再通过NanoDrop 2000测量RNA的纯度。按照PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒的方法合成cDNA。使用SYMR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒的方法来进行四指马鲅RH1、RH2、SWS2和LWS的荧光定量PCR,每个样品设3个重复。选用从四指马鲅眼球组织的转录组数据库中筛选的β-actin核酸序列作为内参基因。使用Primer Premier 5.0软件设计四指马鲅RH1、RH2、SWS2和LWS和内参基因的表达引物。引物序列见表1。

表1 RH1、RH2、SWS2、LWS和β-actin的引物序列Tab.1 Primer sequence of RH1、RH2、SWS2、LWS and β-actin
1.5 数据分析
采用2-ΔΔCt法来分析四指马鲅RH1、RH2、SWS2和LWS基因在不同光照周期下相对于内参基因水平的表达变化。运用R语言对实验数据进行单因素方差分析(One way ANOVA),结果以平均值±标准差(X±SD)表示,P<0.05表示差异显著。
2 结果与分析
2.1 四指马鲅视网膜在不同光照周期下组织学结构和超微结构的变化
图1为四指马鲅在不同光照周期条件下视网膜的显微结构图。由图1可以看出,在不同光照周期条件下饲养的四指马鲅的视网膜十层结构完整,从外向内依次为:色素上皮层(Retinal pigment epithelium,PEL)、感光层(即视锥视杆层)(Photoreceptor layer,RCL)、外界膜(External limiting membrane,OLM)、外核层(Outer nuclear layer,ONL)、外网层(Outer plexiform layer,OPL)、内核层(Inner nuclear layer,INL)、内网层(Inner plexiform layer,IPL)、神经节细胞层(Ganglion cell layer,GCL)、神经纤维层(Nerve fiber layer,NFL)和内界膜(Inner limiting membrane,ILM)。不同光照周期下,视网膜并无明显结构异常。

注:1.0 h∶24 h条件下第30天视网膜(20×10);2.12 h∶12 h条件下第30天视网膜(20×10);3.24 h∶0 h条件下第30天视网膜(20×10);4.0 h∶24 h条件下第60天视网膜(20×10);5.12 h∶12 h条件下第60天视网膜(20×10);6.24 h∶0 h条件下第60天视网膜(20×10)。PEL.色素上皮层;RCL.视锥视杆层;OLM.外界膜;ONL.外核层;OPL.外网层;INL.内核层;IPL.内网层;GCL.神经节细胞层;NFL.神经纤维层;ILM.内界膜。
Notes:1.Retina structure in the light cycle of 0 hour light and 24 hours dark on thirtieth day(20 × 10);2.Retina structure in the light cycle of 12 hour light and 12 hours dark on thirtieth day(20 × 10);3.Retina structure in the light cycle of 24 hour light and 0 hours dark on thirtieth day(20 × 10);4.Retina structure in the light cycle of 0 hour light and 24 hours dark on sixtieth day(20 × 10);5.Retina structure in the light cycle of 12 hour light and 12 hours dark on sixtieth day(20 × 10);6.Retina structure in the light cycle of 24 hour light and 0 hours dark on sixtieth day(20 × 10).
图2为四指马鲅在不同光照周期条件下视网膜视杆细胞和视锥细胞的外节和内节的透射电镜图。由图2可以看出,在第30天时,0 h∶24 h和12 h∶12 h条件下,视锥细胞和视杆细胞的外节结构排列整齐,膜盘结构完整,内节排列整齐,结构完整。而在24 h∶0 h条件下,视锥细胞和视杆细胞外节膜盘弯曲,间隙增大,排列混乱,内节肿胀,排列较为混乱。在第60天时,在12 h∶12 h光照条件下,视锥细胞和视杆细胞的外节和内节结构与第30天时并无明显差异。在0 h∶24 h光照条件下,视锥细胞和视杆细胞外节膜盘结构较为完整,但排列较为混乱,内节排列未见明显异常。在24 h∶0 h光照条件下,虽然视锥细胞和视杆细胞外节排列较为整齐,但膜盘可见断裂,内节线粒体脊断裂消失呈空泡状,细胞间出现大量的空泡样结构。

注:1.0 h∶24 h条件下第30天视锥细胞和视杆细胞外节;2.0 h∶24 h条件下第60天视锥细胞和视杆细胞外节;3.12 h∶12 h条件下第30天视锥细胞和视杆细胞外节;4.12 h∶12 h条件下第60天视锥细胞和视杆细胞外节;5.24 h∶0 h条件下第30天视锥细胞和视杆细胞外节;6.24 h∶0 h条件下第60天视锥细胞和视杆细胞外节;7.0 h∶24 h条件下第30天视锥细胞和视杆细胞内节;8.0 h∶24 h条件下第60天视锥细胞和视杆细胞内节;9.12 h∶12 h条件下第30天视锥细胞和视杆细胞内节;10.12 h∶12 h条件下第60天视锥细胞和视杆细胞内节;11.24 h∶0 h条件下第30天视锥细胞和视杆细胞内节;12.24 h∶0 h条件下第60天视锥细胞和视杆细胞内节。
Notes:1.Outer segment of cones and rods in the light cycle of 0 hour light and 24 hours dark on thirtieth day;2.Outer segment of cones and rods in the light cycle of 0 hour light and 24 hours dark on sixtieth day;3.Outer segment of cones and rods in the light cycle of 12 hours light and 12 hours dark on thirtieth day;4.Outer segment of cones and rods in the light cycle of 12 hours light and 12 hours dark on sixtieth day;5.Outer segment of cones and rods in the light cycle of 24 hours light and 0 hour dark on thirtieth day;6.Outer segment of cones and rods in the light cycle of 24 hours light and 0 hour dark on sixtieth day;7.Inner segment of cones and rods in the light cycle of 0 hour light and 24 hours dark on thirtieth day;8.Inner segment of cones and rods in the light cycle of 0 hour light and 24 hours dark on sixtieth day;9.Inner segment of cones and rods in the light cycle of 12 hours light and 12 hours dark on thirtieth day;10.Inner segment of cones and rods in the light cycle of 12 hours light and 12 hours dark on sixtieth day;11.Inner segment of cones and rods in the light cycle of 24 hours light and 0 hour dark on thirtieth day;12.Inner segment of cones and rods in the light cycle of 24 hours light and 0 hour dark on sixtieth day.
2.2 四指马鲅RH1、RH2、SWS2和LWS基因的生物信息学分析
四指马鲅RH1、RH2、SWS2和LWS的核酸序列均已上传至NCBI数据库,登录号分别为KY949237、KY949238、KY949239、KY949236。RH1的cDNA开放阅读框为1 059 bp,编码352个氨基酸(图3);RH2的cDNA开放阅读框为1 059 bp,编码352个氨基酸(图4);SWS2的cDNA开放阅读框为1 056 bp,编码351个氨基酸(图5);LWS的cDNA开放阅读框为1 074 bp,编码357个氨基酸(图6)。

注:上面为核酸序列,下面为氨基酸序列;小写字母表示编码序列;Rhodopsin_N结构域用下划线表示;7tm结构域用灰色部分表示。以下同此。
Notes:The deduced amino acid sequence was shown below the nucleotide sequence;The lowercase letter indicated the open reading frame sequence;Rhodopsin_N domain was underlined;7tm domain was shown in grey.The same as below.



利用ProParam、SOPMA和欧洲生物信息研究所(EMBL-EBI)的InterProScan 5等在线分析程序对四指马鲅RH1、RH2、SWS2、LWS进行蛋白质序列分析、预测蛋白二级结构和功能结构域,结果如表2。
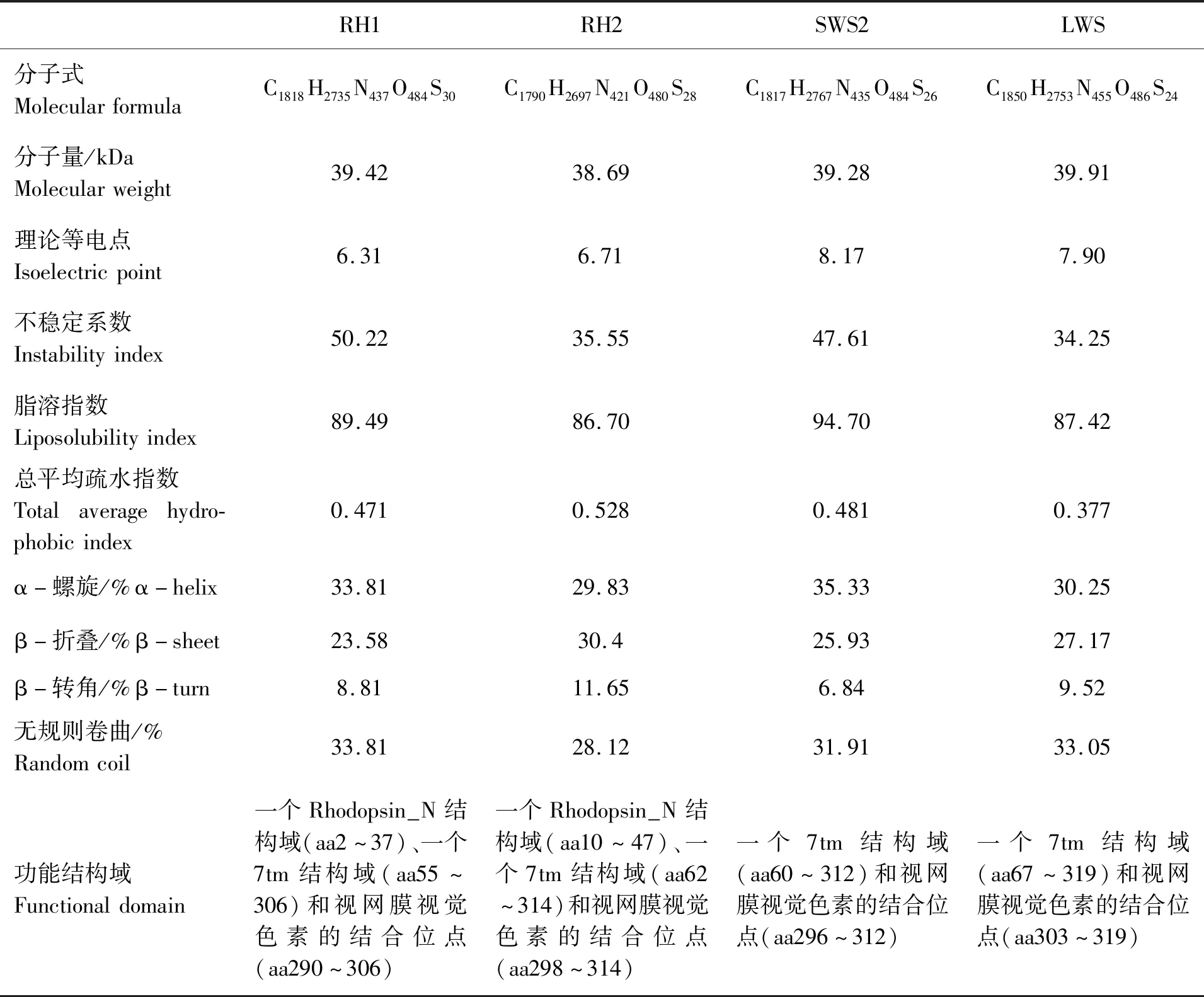
表2 四指马鲅RH1、RH2、SWS2、LWS的蛋白质序列分析Tab.2 Protein sequence analysis of RH1、RH2、SWS2 and LWS of E.tetradactylum
2.3 四指马鲅视蛋白在不同光照周期下的表达
由图7可以看出,经过不同的光照周期饲养30 d后,RH1、RH2、SWS2和LWS基因在0 h∶24 h和12 h∶12 h这两组的表达差异均不显著,而在24 h∶0 h光照条件下则显著增高。说明在24 h光照周期中,当光照时长大于暗黑时长时,光照时间的增加能促进RH1、RH2、SWS2和LWS基因的表达。
由图8所示,随着饲养时间的延长,RH1、RH2、SWS2和LWS基因的表达量出现不同的变化。RH1基因在0 h∶24 h和12 h∶12 h这两组的表达量有所增加,在第60天时,RH1在0 h∶24 h、12 h∶12 h、24 h∶0 h这三组的表达量差异不显著。同样,SWS2基因在12 h∶12 h组表达量显著增加,使得其在60 d的表达量差异不显著。LWS基因在0 h∶24 h组显著降低,而在12 h∶12 h组显著增加,在第60天时,LWS基因在12 h∶12 h和24 h∶0 h这两组的表达量显著高于0 h∶24 h组的表达量。而RH2基因在0 h∶24 h组显著增加,而在12 h∶12 h和24 h∶0 h这两组变化不显著,使得其在第60天时在0 h∶24 h组的表达量是最高的。但RH1、SWS2和LWS基因在0 h∶24 h、12 h∶12 h、24 h∶0 h这三组表达量的总体趋势是12 h∶12 h组最高。

注:不同的小写字母表示显著性差异(P<0.05)。以下同此。
Notes:Different lowercase letters indicated statistically significant differences(P<0.05).The same as below.

在0 h∶24 h条件下,RH1、RH2、SWS2和LWS基因在第30天的表达量分别为0.64、1.04、0.47、0.80,而在第60天的表达量分别为0.89、0.43、1.71、0.86。在12 h∶12 h条件下,RH1、RH2、SWS2和LWS基因在第30天的表达量分别为1.01、0.35、0.73、0.62,而在第60天的表达量分别为1.34、1.58、0.71、1.19。在24 h∶0 h条件下,RH1、RH2、SWS2和LWS基因在第30天的表达量分别为1.69、2.83、3.90、2.74,而在第60天的表达量分别为1.12、1.12、1.05、1.07。由实验结果可以看出,在24 h∶0 h条件下RH1、RH2、SWS2和LWS基因的表达量都是降低的。在12 h∶12 h条件下,RH1、SWS2和LWS基因的表达量是增加的。在0 h∶24 h条件下,RH1、RH2和SWS2基因的表达量也是增加的。
3 结论与讨论
视网膜承担着将光信号转化为电信号并传递电信号的作用,当光照的强度和光照的持续时间超过了其自身所能承受的阈值时,视网膜就会损伤[25]。由本文实验结果可以看出,在一定的光照强度下,四指马鲅在0 h∶24 h、12 h∶12 h和24 h∶0 h的光照周期条件饲养60 d,组织学切片显示其视网膜的结构完整并无明显差异。而在透射电子显微镜下观察发现,其视网膜的超微结构有一定差异。在12 h∶12 h的间歇光照下,第30天和第60天的视网膜结构无明显差异,视锥细胞和视杆细胞的外节和内节均排列整齐,结构完整。有研究表明,光子被视蛋白吸收时产生自由基,而自由基极易攻击构成膜盘的不饱和脂肪酸的亚甲基结构,进而使膜盘结构以及线粒体等发生过氧化,从而造成视网膜组织的光性损伤[26]。在正常情况下,视网膜组织能够使其内自由基的含量维持在一定水平,但是当外界条件发生变化时,视网膜无法维持其内自由基的动态平衡,进而使视网膜受到损伤[27]。在24 h∶0 h的持续光照条件下,视网膜的视锥视杆层在第30天和第60天有着不同程度的变化。目前还无法明确造成这种结果的具体机制,可能的原因是,在持续的光照条件下,视网膜内产生了大量的自由基,自由基产生的速率高于其被清除的速率,从而破坏了自由基动态平衡,进而造成了视网膜膜盘的断裂和损伤。
SWS1能吸收的入射光的最大光谱范围在紫外线的光谱范围内,而紫外线在生物的觅食、交流以及配偶选择等方面起着重要作用[28]。但是,在四指马鲅眼球组织的转录组中,并没有发现与SWS1基因有关的序列。有研究发现,SWS1基因是否存在与该生物生活环境中是否有紫外光有一定关系,且一个氨基酸的替换就可以使SWS1蛋白的敏感光谱从紫外光谱向蓝紫色光谱偏移[29-33]。四指马鲅喜栖息于近海、河口及泥沙质海底,紫外光等短波长的光在这种水质中高度发散,不能使其形成较好的视觉,因此,四指马鲅对紫外光的敏感性下降,这有可能是四指马鲅眼球组织转录组中没有检测到SWS1基因相关序列的原因。
由于水体环境复杂多样,且随着深度的变化而有着明显的环境梯度,其中的入射光光谱会有明显差别,因此不同梯度水环境内鱼类可通过视蛋白的差异表达和视蛋白的复制和分歧来增加视蛋白的多样性,从而使鱼类视觉系统和自适应发生变化。有研究发现,丽鱼科(Cichlidae)不同种属间视蛋白的差异表达导致了其视觉系统明显的种间差异[34]。而群体间的生殖隔离和体色的多样性有可能是视觉系统对不同区域光环境的适应性造成的[35]。如珊瑚礁鱼类警戒体色的进化,可能是由于其视蛋白对不同色彩的响应偏差导致的[36]。不同的光照时长,会引起视网膜神经元的生理活动发生变化,这种变化传递到神经中枢,经中枢神经的分析和整合,使动物的体温、心率和激素水平发生改变,同时引起机体生物节律发生变化[37]。鱼类在海洋和淡水之间迁徙和产卵的行为和生理特性,可能与感觉系统随个体发育而变化有关。本应顺流而下的花鳗鲡(Anguillamarmorata)却在特定时期向上游迁移的行为可能是由于其根据月亮周期促使其视蛋白差异表达而导致的[38]。不仅仅是繁殖行为,生物的其他行为活动同样受到光照周期的影响,但这并不是一种短暂的现象,而是生物体在漫长的进化过程中对光照时长的适应性变化。本研究选取0 h∶24 h、12 h∶12 h、24 h∶0 h这三种差别较大的光照周期作为实验组,研究视网膜感光视蛋白表达量的变化,初步探讨视蛋白对光照周期的适应性变化。由实验结果可以看出,经过不同的光照周期饲养30 d后,RH1、RH2、SWS2和LWS基因在0 h∶24 h和12 h∶12 h这两组的表达差异均不显著,而在24 h∶0 h光照条件下则显著增高。这说明在24 h光照周期中,当光照时长大于暗黑时长时,光照时间的增加能促进RH1、RH2、SWS2和LWS基因的表达。当生物体所处的光环境发生变化时,其视觉系统中视锥细胞和视杆细胞所接受的光谱信号就会不同,光敏感性视蛋白的表达量就会随之变化。而光敏感性视蛋白含量的增高,能够为生物体提供较好的视觉,从而满足生物体觅食、躲避敌害等行为活动。养殖60 d后,RH1、SWS2和LWS基因的表达量在12 h∶12 h条件下是最高的,而RH2的则是在0 h∶24 h条件下表达量最高。RH2可能在黑暗或者弱光条件下发挥了某些重要作用。与第30天相比,这4种视蛋白的基因在不同的光照周期下的表达量有所不同。从总体趋势看,RH1、SWS2和LWS基因的表达量在0 h∶24 h和12 h∶12 h条件下是增加的,而在不间断的连续光照条件下,其表达量反而是降低的。导致这种变化的具体机制目前还并不清楚,但是这变化与武静等对小鼠的研究结果相似[39]。武静等认为视蛋白的表达量在持续的光照条件下的下降可能是机体为了维持正常的昼夜节律而做出的一种代偿性的减少。虽然本研究结果的总体趋势是视蛋白的表达量在持续的黑暗条件下增加而在持续的光照条件下降低,但是LWS基因的表达量在持续的黑暗条件下是降低的,导致与其他视蛋白表达量变化不一致的原因目前并不清楚,可能的原因是LWS对光照强度的敏感性与其他视蛋白不一致。因为本实验所研究的3个光照周期中0 h∶24 h组的光照强度为0,即是完全无光的,而另外两组都有光照刺激。但以上推断还需要有进一步的实验来证实。
