鱼腥草提取物去甲头花千金藤二酮B对H2O2诱导的海马神经元损伤的作用及可能机制
2019-12-26曹桂花李娟王晓明贾新
曹桂花,李娟,王晓明,贾新*
(空军军医大学第一附属医院,1老年病科,2神经外科,西安 710032)
氧化应激与中枢神经系统多种疾病如脑卒中、帕金森病、阿尔兹海默病等的发生发展密切相关[1,2]。氧化应激所导致的机体内氧化系统和抗氧化系统失衡,可引起细胞内蛋白质、脂质及DNA过氧化修饰,继而引发线粒体功能障碍,导致细胞损伤或死亡,而脑组织的氧代谢率极高,其抗氧化活性较低,且再生能力差,对氧化应激更为敏感,因此保护脑细胞、抵抗氧化损伤具有重要意义[3,4]。去甲头花千金藤二酮B (norcepharadione B,NB)是提取自传统中草药鱼腥草的一种阿朴菲型生物碱。既往研究表明,NB具有诸多器官保护功效,其在抗氧化、改善心肌缺血、改善神经功能方面作用显著;除此之外,NB还有较强的抗病毒、抗炎及抗血小板聚集功效[5]。但目前关于NB是否具有抗氧化及抵抗氧化应激损伤的神经保护作用还未可知。因此,本实验采用H2O2诱导小鼠海马HT22神经细胞制备氧化损伤模型,探讨NB发挥神经元保护作用的可能分子机制。
1 材料与方法
1.1 材料与试剂
HT22细胞系由空军军医大学西京医院神经外科实验室馈赠。NB(纯度>98%)购自中国武汉天植生物技术公司;DMEM培养基及PBS缓冲液购自美国Corning公司;胎牛血清购自英国Gibco公司;DMSO及H2O2购自美国 Sigma公司;CCK-8试剂盒购自美国MCE公司;RIPA裂解液、BCA蛋白浓度测定试剂盒、超敏ECL化学发光试剂盒购自广州碧云天生物技术研究所;乳酸脱氢酶(lactate dehydro-genase,LDH)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde malonic dialdehyde,MDA)及谷胱甘肽(glutathione,GSH)试剂盒均购自南京建成生物工程研究所;N-乙酰-L-半胱氨酸(N-acetyl-L-cysteine,NAC)和PI3K抑制剂Ly294002购自碧云天生物技术研究所;蛋白激酶B(protein kinase,Akt)、磷酸化的Akt(p-Akt)、B细胞淋巴瘤/白血病-2原癌蛋白(B-cell lymphoma/leukemia-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体购自美国Cell Signaling 公司;β-actin及血红素氧合酶1(heme oxygenase-1,HO-1)抗体购自美国Santa Cruz公司。
1.2 细胞培养及处理
将HT22细胞置于5% CO2、37℃培养箱,用含10%胎牛血清的高糖DMEM 培养基(含 1%青链霉素)培养,隔天换液一次。当细胞成长融合至80%以上时用0.25%胰蛋白酶消化传代;当细胞进入对数生长期即可进行后续加药处理。将细胞分为正常对照组、H2O2处理组、NB干预组(H2O2+ NB)、单独NB组和阳性药物对照组(H2O2+ NAC,NAC是一种含巯基的抗氧化剂,具有基于巯基功能的抗氧化特性,能保护机体免受氧化应激损伤,亦可抑制神经细胞凋亡)。根据预实验结果,H2O2组是加入终浓度为300 μmol/L的H2O2与细胞共孵育24 h;H2O2+ NB组是于H2O2处理前2小时加入100 μmol/L的NB共孵育24 h;H2O2+ NAC组是H2O2处理前2小时预先给予5 mmol/L的NAC共孵育24 h,然后进行下一步实验。
1.3 细胞形态观察及细胞活性检测
HT22细胞以5×103个/ml、100 μl每孔接种于96孔板,经过不同处理后,各组细胞置于相差显微镜下观察细胞生长情况及形态变化。细胞的存活率用CCK-8试剂盒检测,酶标仪震荡溶解后于490 nm波长下测各孔光密度值。
1.4 细胞上清指标检测
将各处理组细胞吸掉培养基,PBS清洗3次,加入0.25%胰蛋白酶消化细胞,待其收缩变圆时终止消化,移入EP管中,加入适量细胞裂解液于冰上裂解20 min,4℃ 12 000转/min离心10 min,将上清液移至预冷的离心管中,严格按照试剂盒说明书操作,测定反映细胞损伤的指标LDH,及氧化应激指标(MDA、SOD 及 GSH)水平。
1.5 细胞凋亡率检测
将各处理组的HT22细胞培养基吸弃,加入PBS 清洗2~3遍后,加0.25%的胰酶消化细胞,待其收缩变圆时终止消化,加入PBS重悬细胞,制成 3×105/ml的细胞悬液,用Annexin V-FITC/PI标记细胞(根据试剂盒说明操作),用流式细胞仪检测各组细胞凋亡率。
1.6 Western blotting检测相关蛋白
将HT22细胞接种于6孔培养板上,密度为5×106个/孔,各组处理完毕后,每孔加入100 μl含有10%蛋白酶抑制剂(100 mmol/L)的RIPA细胞裂解液,冰上裂解30 min,然后将细胞用细胞刮收集至离心管,4℃、12 000转/分,离心15 min,收集上清蛋白溶液。BCA蛋白定量法定量后用于检测。蛋白质经聚丙烯酰胺凝胶电泳后,转移至聚偏氟乙烯(polyviny-lidene fluoride, PVDF)膜上。5%脱脂奶粉封闭,37℃孵育1 h,分别加入稀释的兔抗鼠一抗凋亡相关蛋白Bcl-2(1∶800))、Bax(1∶800),及相关信号通路蛋白Akt(1∶1 000)、p-Akt(1∶1 000)、HO-1(1∶1 000),4℃过夜;再加上山羊抗兔二抗,室温孵育1 h。采用化学发光法显色,凝胶成像系统(Bio-Rad公司,美国)进行图像分析。应用β肌动蛋白(β-actin)作为内参。
1.7 统计学处理
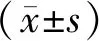
2 结 果
2.1 5组细胞损伤情况比较
本试验通过检测细胞存活率、LDH释放量,并通过相差显微镜观察细胞形态,评价NB对HT22细胞的保护作用。结果显示,与空白对照组比较,H2O2组细胞存活率明显下降,细胞上清中LDH含量显著增加,细胞形态出现明显皱缩、空泡变性及细胞减少。而NB或NAC干预可显著增加细胞活性、减少LDH释放,细胞形态的破坏得到明显改善。而单纯使用NB(NB组)并未对细胞造成影响,提示NB确实对H2O2诱导的HT22细胞损伤具有一定的保护作用(图1)。
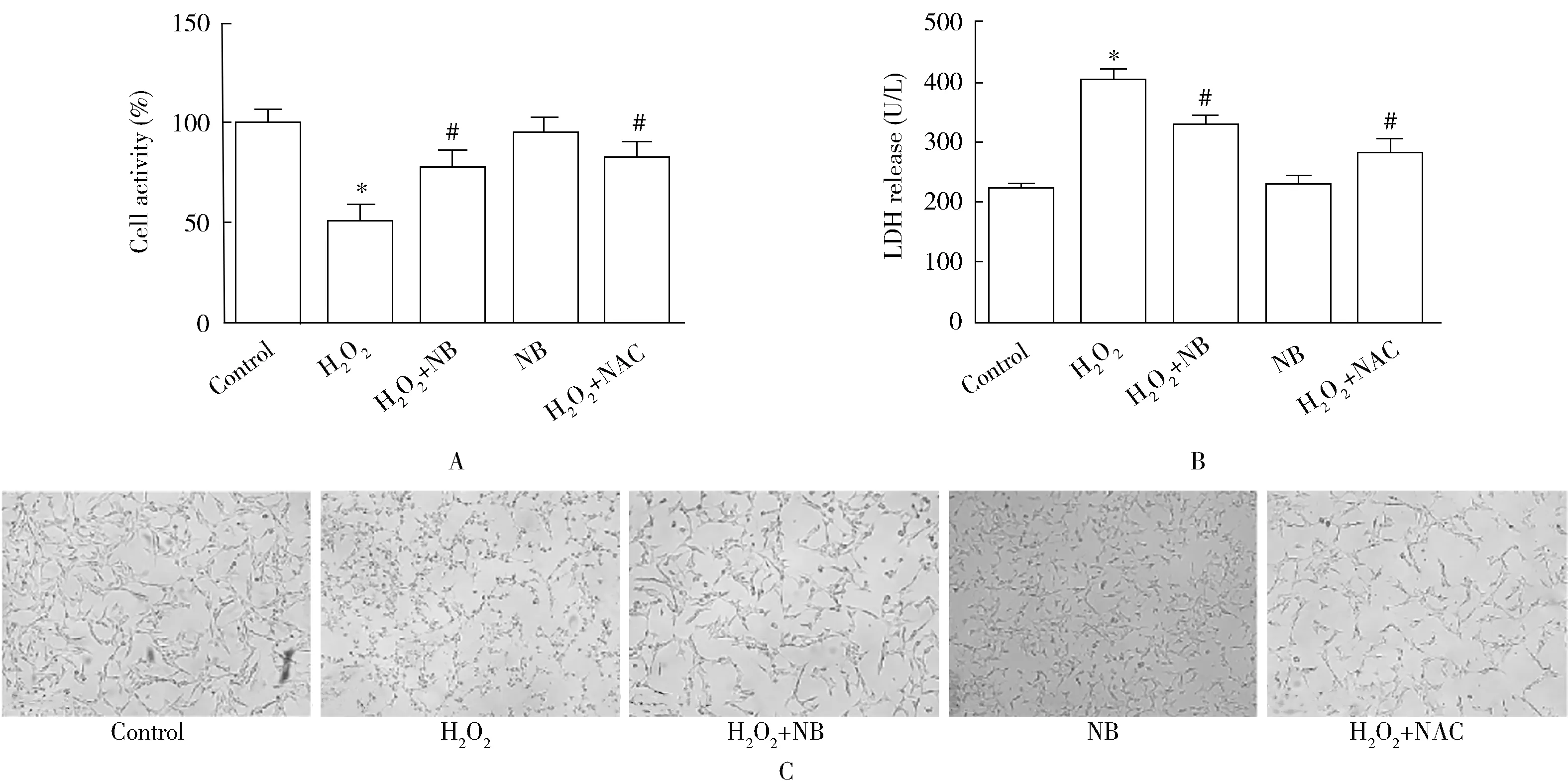
图1 5组HT22细胞损伤情况比较Figure 1 Comparison of cell injury among 5 groups (n=5) A: cell activity by CCK-8; B: LDH release level; C: cytomorphology (×200). NB: norcepharadione B; LDH: lactate dehydrogenase. Compared with control group, *P<0.05; compared with H2O2 group, #P<0.05.
2.2 5组细胞SOD、MDA及GSH水平比较
与正常对照组比较,H2O2组细胞MDA水平显著增加,SOD及GSH活性显著降低;与H2O2组比较,加入NB或NAC干预后,细胞MDA漏出量显著降低,SOD、GSH活性显著升高;而单纯NB处理与正常对照组比较差异不显著,提示单纯NB对细胞SOD、MDA及GSH水平影响不大(表 1)。
2.3 5组细胞凋亡情况比较
流式细胞术检测结果显示(图2A,2B),与正常对照组比较,H2O2组细胞凋亡率明显增高,加入NB或NAC处理后,与H2O2组比较,细胞凋亡率显著降低,差异有统计学意义(P<0.05)。Western blotting检测结果显示(图2C-2E),与正常对照组比较,H2O2处理组Bcl-2表达显著下降,Bax水平显著升高;与H2O2处理组比较,给予NB或阳性药物NAC处理的细胞Bcl-2显著升高,Bax水平显著下降;而NB单独处理组对细胞凋亡率无明显影响。
2.4 NB对H2O2诱导的HT22细胞PI3K/Akt/HO-1信号通路的调节
为进一步探讨NB发挥神经保护的潜在机制,本研究采用Western blotting技术检测了磷脂酰肌醇-3激酶/Akt/HO-1(phosphatidylinositol 3-kinase/Akt/HO-1,PI3K/Akt/HO-1)信号通路在H2O2诱导细胞损伤中相关蛋白的表达。与正常对照组比较,H2O2组p-Akt水平升高,提示一定剂量的H2O2可诱导Akt的磷酸化;与H2O2组相比,给予NB处理后的细胞p-Akt水平有显著升高,表明NB可明显增强Akt的磷酸化水平(P<0.05);而单纯NB处理组与正常组相比,p-Akt水平变化不明显(图3A;P>0.05)。我们还检测了抗氧化酶HO-1蛋白的表达,结果显示,H2O2处理组细胞HO-1水平较正常对照组显著升高,加入NB处理后,与H2O2处理组比较,HO-1表达亦显著升高,同时H2O2+ NAC组的HO-1表达水平稍低于H2O2+ NB处理组,但差异无统计学意义(P>0.05);单纯NB处理组与模型组比较差异亦无统计学意义(P>0.05;图3B)。为了明确PI3K/Akt/HO-1途径是否参与了NB的神经保护作用,我们对细胞给予PI3K抑制剂Ly294002预处理30 min,然后加入NB及H2O2共孵育24 h。结果显示(图3C),加入Ly294002的细胞p-AKT及HO-1表达水平均较H2O2+ NB处理组显著降低,提示PI3K/Akt/HO-1信号通路确实参与了NB的神经保护作用。
表1 NB对H2O2诱导细胞氧化损伤指标的影响
Table 1 Effect of NB on oxidative damage indicators
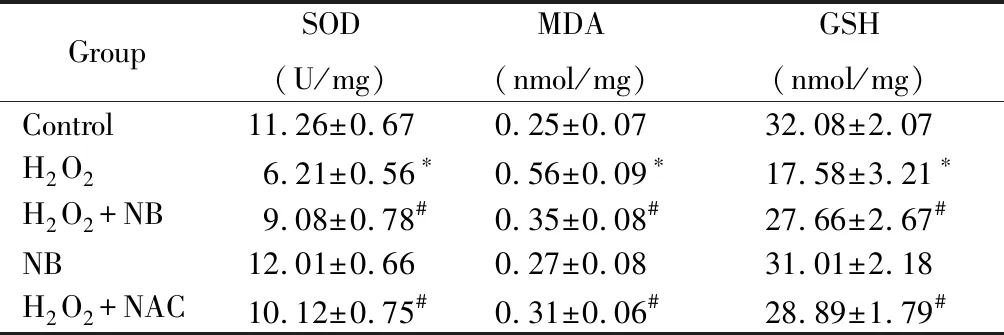
GroupSOD(U/mg)MDA(nmol/mg)GSH(nmol/mg)Control11.26±0.670.25±0.0732.08±2.07H2O26.21±0.56∗0.56±0.09∗17.58±3.21∗H2O2+NB9.08±0.78#0.35±0.08#27.66±2.67#NB12.01±0.660.27±0.0831.01±2.18H2O2+NAC10.12±0.75#0.31±0.06#28.89±1.79#
NB: norcepharadione B; SOD: superoxide dismutase; MDA: malondialdehyde malonic dialdehyde; GSH: glutathione. Compared with control group,*P<0.05; compared with H2O2group,#P<0.05.
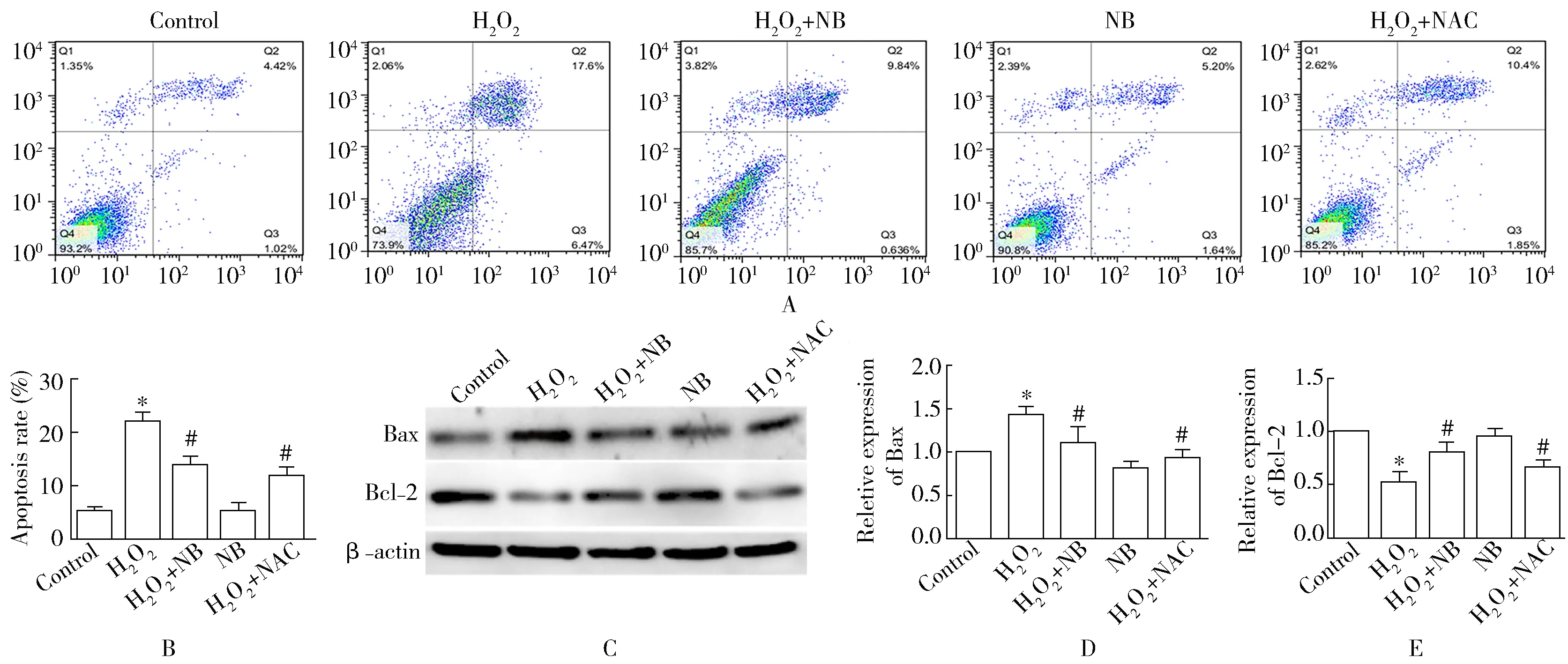
图2 5组细胞凋亡情况比较Figure 2 Comparison of apoptosis among 5 groups (n=3)
A: detection of apoptosis rate by flow cytometry; B: quantitative analysis of the percentage of apoptotic cells by histogram; C-E: quantitative analysis of Bax and Bcl-2 expression by Western blotting. NB: norcepharadione; Bcl-2: B-cell lymphoma/leukemia-2; Bax: Bcl-2 associated X protein. Compared
with control group,*P<0.05; compared with H2O2group,#P<0.05.

图3 NB通过激活PI3K/Akt/HO-1信号途径发挥神经保护作用Figure 3 Role of NB in neuroprotection through PI3K/Akt/HO-1 signaling pathway (n=3) A: expression and quantitative analysis of p-Akt and total Akt; B: expression and quantitative analysis of HO-1; C: effect of PI3K inhibitor Ly294002 on expression of p-Akt and HO-1. NB: norcepharadion B; Akt: protein kinase B; p-Akt: phosphorylated Akt; HO-1: heme oxygenase-1. Compared with control group, *P<0.05; compared with H2O2 group, #P<0.05; compared with H2O2 +NB group, △P<0.05, △△P<0.01.
3 讨 论
鱼腥草是一种传统中草药,具有广泛的生物活性和较高的食用价值,在临床上具有广阔的应用前景。NB是从鱼腥草中提取的一种生物碱。既往研究表明,NB具有较强的抗菌、抗炎、抗病毒和抗血小板聚集作用,其中抑制血小板聚集的潜在机制可能与NB抑制了环氧合酶的活性有关[6-8]。最近的研究表明,鱼腥草提取物可以改善痴呆、帕金森病和癫痫患者的记忆功能[9],为NB在神经系统的作用研究提供了理论支持。本实验采用H2O2诱导HT22海马神经细胞制备氧化损伤模型,首次阐明了NB这一生物碱的抗氧化、抗凋亡的神经保护作用,为天然类中药提取物的临床应用提供了理论依据。
氧化应激损伤在多种中枢神经系统疾病引起的神经损伤中起着重要作用,如脑缺血-再灌注损伤、脑外伤和阿尔兹海默病等。氧化应激损伤发生后,神经元细胞内的抗氧化物质可被大量消耗,引起细胞内的氧化还原状态失衡,继而引起神经元细胞的损伤死亡,因此减少自由基产生、减轻氧化应激损伤是降低上述疾病危害的重要途径[10-11]。SOD和GSH 是机体内的主要自由基清除酶,前者能通过歧化作用清除病理状态下产生的氧自由基,减轻细胞损害,后者能抑制脂质过氧化反应,对脑缺血脑缺氧损伤起到保护作用。MDA能导致细胞功能受损,且细胞受损程度与MDA 含量成正比,因此上述三者能有效反映细胞受损程度[12,13]。在本实验中,我们首先观察了NB对H2O2作用下HT22细胞形态、存活率及凋亡率的影响,结果显示,H2O2作用于细胞24 h后,镜下可见细胞形态出现细胞皱缩、空泡变性及细胞减少,而给予NB处理后细胞受损形态明显减轻,细胞数目减少不明显。细胞活力及凋亡率结果显示,与H2O2组比较,给予NB或NAC处理后细胞存活率显著增加,细胞凋亡率显著减少,并且LDH 释放减少。为明确NB对氧化应激所致细胞损伤的作用,我们检测了细胞内SOD、GSH及MDA的变化。结果显示,H2O2刺激可诱导细胞内SOD活性及GSH水平明显降低,MDA 含量显著增加;而给予NB或NAC处理后MDA水平显著降低,SOD、GSH活性较H2O2组升高。同时,我们也观察了抗氧化酶HO-1蛋白的变化,结果显示,H2O2处理组细胞HO-1的表达水平较正常对照组升高,加入NB处理后,HO-1的表达亦显著升高,表明NB可以对抗氧化应激产生的损伤。而在本实验中,H2O2+ NAC组HO-1的表达稍低于H2O2+ NB处理组,这可能与不同的实验条件有关。
线粒体凋亡途径主要通过Bcl-2家族和Caspase家族进行调控,Bcl-2作为Bcl-2家族蛋白的抗凋亡蛋白,存在于线粒体外膜上,以保护线粒体膜的完整性,抑制神经元的凋亡[14,15]。为进一步明确NB发挥抗凋亡的潜在机制,我们检测了Akt下游信号通路蛋白Bcl-2和Bax的变化,结果表明,H2O2处理组Bax的表达明显升高,而Bcl-2的水平显著下降,给予NB处理可减轻H2O2诱导的神经元损伤,上调 Bcl-2的蛋白表达,下调Bax表达,提示NB可能通过抑制线粒体凋亡保护受损神经元。
PI3K/Akt是重要的细胞存活信号通路,与中枢神经系统损伤的保护机制密切相关,可通过促使凋亡相关因子磷酸化而失活、磷酸化Bcl-2家族成员、影响转录因子家族(Forkhead、核因子κB、cAMP反应元件结合蛋白、p53等)、阻止线粒体释放细胞色素C等方面发挥抗凋亡的调控作用[16]。有研究发现,依达拉奉可通过激活PI3K/Akt信号传导抑制氧化反应、清除自由基及降低脑水肿途径, 发挥拮抗细胞凋亡的作用[17]。此外,大量研究表明,PI3K/Akt信号通路参与了Nrf2的活化和核转位过程,可促使下游一系列抗氧化酶基因的表达,如过氧化氢酶(catalase,CAT)、SOD、GST以及HO-1等[18-20]。NB是否通过调控PI3K/Akt信号通路来发挥抗氧化的神经保护作用呢?我们采用Western blotting方法进一步探讨相关分子蛋白的表达,结果发现,H2O2可诱导HT22细胞的Akt磷酸化水平,而加入NB后可进一步增强Akt的磷酸化程度;且下游HO-1表达明显升高。为了进一步验证NB是否增强了Akt的磷酸化水平,我们给予PI3K抑制剂Ly294002预处理30 min,然后给予NB及H2O2共培养24 h,结果显示,抑制剂处理后的细胞p-Akt表达明显降低,HO-1表达显著下降,提示PI3K/Akt/HO-1信号通路参与了NB的神经保护作用。
综上所述,NB对H2O2诱导损伤的海马神经元细胞具有良好的保护作用,其作用机制可能通过激活PI3K/Akt/HO-1信号通路而抑制了氧化应激、增强了机体抗氧化能力及减少了细胞凋亡。
