槲皮黄酮通过Sphk2抑制人皮肤鳞状细胞癌A431细胞的增殖
2019-12-25雷淑英
吕 君 雷淑英
人皮肤鳞状细胞癌(human skin squamous cell carcinoma,SCC)已经成为与癌症相关的人类死亡的重要原因[1]。流行病学统计发现,大约20%人口一生中可能发生皮肤癌,并且其发病率每年呈逐渐增高的趋势[2]。目前,皮肤癌的治疗手段主要包括手术、放疗和化疗[2,3]。对于晚期、复发性或转移性SCC的预后不理想,可能的原因是缺乏有效药物的治疗[4]。因此,开发治疗皮肤癌的新型高效化合物具有重大意义。
槲皮黄酮(quercetin,Qu)是一类黄酮类化合物,主要分布在蕨类植物、裸子植物及被子植物中,具有较强的抗炎活性、参与免疫调节及具有抗肿瘤的功效[5];早期已有研究证实Qu对辐射诱导的皮肤纤维化具有保护作用[6]。然而,Qu对SCC细胞的增殖活性是否具有抑制作用,尚未见报道。鞘氨醇激酶2(sphingosine kinase 2,SphK2)是SCC或其他肿瘤治疗的重要药物靶点[7,8],SphK2活化可诱导1-磷酸神经鞘氨醇(sphingosine-1-phosphate,S1P)的产生,进而导致肿瘤细胞增殖、生存、血管生存及凋亡抵抗[9]。然而,SphK2基因沉默则会引起S1P前体鞘氨醇和神经酰胺的积累,后者会诱导肿瘤细胞凋亡及分裂周期停滞[10]。因此,本文观察了Qu对SCC细胞活力、增殖及凋亡的影响,并初步探讨其作用机制。
1 材料及方法
1.1 药品与试剂 槲皮黄酮、Akt激动剂SC79、S1P和JNK抑制剂SP600125均购自美国Sigma公司;Annexin V-FITC/PI和CCK8试剂盒购自江苏碧云天生物技术研究所;Caspase-glot-3/-9活性测定试剂盒购买于美国Promega公司;BrdU试剂盒购自上海Roche Diagnostics公司;兔anti-t-PARP、兔anti-Cle-PARP、兔anti-Cle-PARP、兔anti-Akt、兔anti-p-Akt、兔anti-S6K1、兔anti-p-S6K1、兔anti-JNK1/2、兔anti-p-JNK1/2、兔anti-Sphk2和兔anti-β-actin购自英国Abcam公司;羊抗兔IgG二抗购自上海谷歌生物公司。
1.2 主要仪器 单人超净台(苏州华新空调净化有限公司);细胞培养箱(上海医用分析仪器厂);Victor3 1420 Multilable Counter酶标仪(DX540,美国);SDS-PAGE凝胶电泳仪(型号DYCZ-24DN,北京六一仪器厂);成像系统(BIO-RAD,美国),FACS-Calibur流式细胞仪(BD公司,美国)。
1.3 A431细胞培养 A431细胞购买于武汉巴菲尔生物有限公司,采用含10%胎牛血清的DMEM培养基培养,培养箱条件为5% CO2、37℃、恒湿,显微镜观察细胞生长至90%左右时,便可开始传代培养。
1.4 A431细胞增殖实验 将对数期A431细胞接种于96孔板,每孔1×104个细胞,培养过夜,然后加入10~200 μg/mL的Qu处理细胞24、48、72、96 h后,弃去旧培养液,每孔加入100 μL含10 μL的CCK8试剂的DMEM培养液,放入培养箱中继续孵育1.5 h,在酶标仪450 nm波长处检测细胞吸光度OD值,并计算A431细胞相对活力。计算公式如下:细胞相对活力(%)=OD实验组/OD对照组×100%。
1.5 细胞克隆实验 将对数期A431细胞接种于6孔板,每孔1000个细胞,培养过夜,然后加入10~200 μg/mL的Qu处理细胞9 d后,每3 d更换一次含药的新鲜培养液;然后对克隆细胞进行染色并计数。
1.6 BrdU ELISA实验 将对数期A431细胞接种于96孔板,每孔1×104个细胞,培养过夜;Qu(10~200 μg/mL)处理细胞48 h后,加入BrdU试剂孵育12 h;再采用ELISA试剂盒检测BrdU偶联的细胞,并在酶标仪405 nm处测定其吸光度OD值。
1.7 细胞凋亡及周期检测 将对数期A431细胞接种于6孔板,每孔5×104个细胞,培养过夜,然后加入10~200 μg/mL的Qu处理细胞48 h后,PBS清洗2次,收集细胞,采用2.0 mg/mL的PI染液和RNase I染色30 min,流式细胞仪立即检测A431细胞周期分布情况。另外,收集细胞,PBS重悬后,分别加入Annexin-V FITC和PI处理细胞(按照试剂盒操作说明书进行),最后用流式细胞仪检测细胞凋亡情况。
1.8 Western blotting实验 收集各组细胞,每组加入200 μL的裂解液,置于冰上充分裂解30 min,收集细胞裂解液,12000 rpm、4 ℃条件下离心12 min,收集上清。BCA法检测上清中总蛋白浓度,每孔上样40 μg进行电泳分离,恒压70 V,电泳3 h。然后在恒流275 mA条件下电转70 min,5%脱脂牛奶封闭1 h后,将印迹膜放入对应的一抗溶液(稀释比1∶1000)中,4℃摇床孵育过夜。TBST洗膜3次,每次10 min,再把条带放入盛二抗(稀释比1∶3000)的平皿中室温孵育1 h,TBST洗膜3次,每次10 min。加入4 mL的ECL显影液显色3 min,凝胶成像系统曝光。
1.9 组蛋白DNA水平检测 收集各组细胞,每组加入200 μL的裂解液,置于冰上充分裂解30 min,收集细胞裂解液,12000 rpm、4℃条件下离心12 min,收集上清。然后采用组蛋白DNA ELISA试剂盒分析细胞凋亡情况,酶标仪405 nm处测定其吸光度OD值。
1.10 Caspase活性试验 收集Qu处理后的各组A431细胞,采用Caspase-glot-3/-9活性测定试剂盒检测Caspase-3/9活性,酶标仪在405 nm处测定其吸光度值。
1.11 S1P水平检测 收集Qu处理后的各组A431细胞,充分裂解后,离心,收集上清。取20 μg细胞裂解液与20 mM的D-erythro-Sphingosine(溶于0.1% Triton X-100)、2 mmol/L的ATP和[Y-32P]ATP在37℃条件下反应30 min。然后,加入20 mL的HCl终止反应;再加入氯仿/甲醇/HCl(100∶200∶1,v/v),充分振荡、离心;采用薄层色谱法(溶剂为氯仿/丙酮/甲醇/乙酸/水(10∶4∶3∶2∶1,v/v))分离S1P,采用闪烁计数器对其进行定量。
1.12 神经酰胺水平检测 收集各组细胞裂解液,采用神经酰胺ELISA试剂盒检测分析A431细胞中神经酰胺水平,其操作步骤严格按照说明书进行。
1.13 统计学方法 采用SPSS 19.0统计软件进行统计分析,组间比较采用单因素方差分析检验,P<0.05为差异具有统计学意义。
2 结果
2.1 槲皮黄酮抑制A431细胞活力、周期及增殖 为了观察槲皮黄酮对人皮肤鳞状细胞癌细胞A431生长的影响,CCK8法检测了A431细胞活力,发现槲皮黄酮呈时间和浓度依赖性抑制槲皮黄酮细胞活力(P<0.05),见图1a。进一步对A431细胞克隆分析发现,槲皮黄酮处理细胞9 d后,药物呈浓度依赖性抑制细胞克隆(P<0.05),见图1b。采用BrdU联合ELISA法分析了A431细胞增殖情况,发现槲皮黄酮呈浓度依赖性抑制细胞增殖(P<0.05),见图1c。对A431细胞分析发现,G1期的A431细胞数明显增多,而S期和G2期细胞数明显减少,与对照组相比,差异有统计学意义(P<0.05),见图1d。
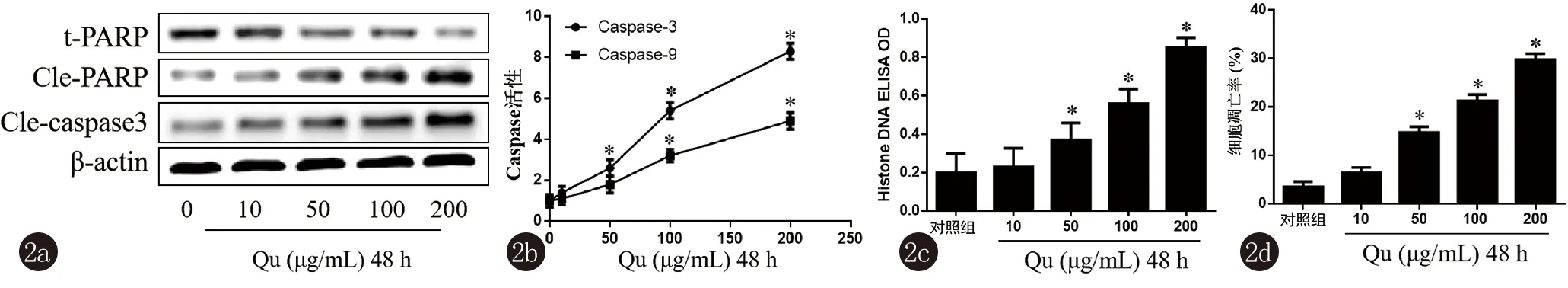
2.2 槲皮黄酮诱导A431细胞凋亡 槲皮黄酮能够诱导A431细胞凋亡,主要表现在槲皮黄酮明显抑制抗凋亡蛋白t-PARP表达,诱导促凋亡蛋白Cle-PARP和Cle-caspase3表达,与对照组相比,差异有统计学意义(P<0.05),见图2a;同时,槲皮黄酮明显增强Caspase-3和Caspase-9活性,与对照组相比,差异有统计学意义(P<0.05),见图2b。另外,槲皮黄酮还能明显诱导A431细胞中组蛋白DNA水平,并显著增强细胞凋亡率,与对照组相比,差异有统计学意义(P<0.05),见图2c、2d。
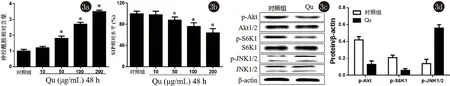
2.3 槲皮黄酮调节A431细胞中Akt/S6K1和JNK信号传导 槲皮黄酮呈浓度依赖性的诱导A431细胞中神经酰胺积累,抑制S1P水平,与对照组相比,差异有统计学意义(P<0.05),见图3a、3b。进一步分析了槲皮黄酮对A431细胞中Akt/S6K1和JNK信号通路的影响,发现槲皮黄酮明显抑制Akt和S6K1的磷酸化水平,明显诱导JNK1/2蛋白的磷酸化,与对照组相比,差异有统计学意义(P<0.05),见图3c、3d。

注:与对照组比较,*P<0.05
图1槲皮黄酮抑制A431细胞活力、细胞周期进展和增殖
注:与对照组比较,*P<0.05
注:与对照组比较,*P<0.05
2.4 槲皮黄酮通过Akt/S6K1和JNK信号通路调节A431细胞生长 为了观察槲皮黄酮是否通过Akt/S6K1和JNK信号通路调节A431细胞生长,实验采用了Akt激动剂SC79、S1P和JNK抑制剂SP600125与Qu共同干预细胞,发现槲皮黄酮能明显降低细胞活力,增加细胞凋亡(P<0.05),见图4;另外,SC79、S1P和SP600125与Qu共同处理细胞后,发现A431细胞活力相比于单纯Qu组明显增高,而细胞凋亡率明显降低(P<0.05)。由此说明,槲皮黄酮可通过Akt/S6K1和JNK信号通路调节A431细胞生长。
2.5 槲皮黄酮对Sphk2信号的影响 进一步检测了槲皮黄酮对Sphk2信号通路的影响,发现药物呈浓度依赖性的抑制Sphk2蛋白表达(P<0.05)。接着采用SiRNA对Sphk2基因进行过表达和沉默发现,Qu+Sphk2 mimics组细胞活力相比于单纯Qu组明显增高,细胞凋亡明显降低(P<0.05);Qu+Sphk2 inhibitor组细胞活力相比于单纯Qu组明显降低,Qu+Sphk2 inhibitor组细胞凋亡明显增高(P<0.05),说明Sphk2过表达能部分逆转槲皮黄酮对A431细胞增殖的抑制作用;另外,Qu+Sphk2 mimics组S1P水平相比于单纯Qu组明显升高,Qu+Sphk2 inhibitor组S1P水平明显降低(P<0.05)。Qu+Sphk2 mimics组p-Akt和p-S6K1表达水平相比于单纯Qu组升高,而p-JNK1/2表达水平降低;Qu+Sphk2 inhibitor组p-Akt和p-S6K1表达水平降低,p-JNK1/2表达水平升高,说明Sphk2过表达能部分逆转Qu对Akt/S6K1信号的抑制作用及对JNK信号的激活作用(图5)。
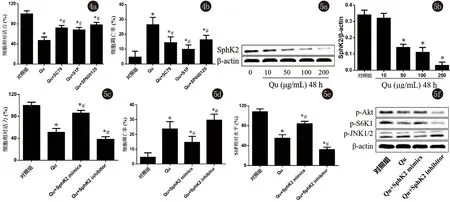
注:与对照组比较,*P<0.05;与Qu组比较,#P<0.05
图4SC79、S1P和SP600125对A431细胞活力和凋亡的影响图5槲皮黄酮对Sphk2信号传导的影响
3 讨论
研究发现鳞状细胞癌和基底细胞癌患者组织中Sphk2信号通路处于高度活化的状态,提示该信号通路参与了皮肤癌的发病机制[11]。Sphk2在SCC的发生中起着重要的致癌功能,其过表达诱导了肿瘤的恶化及化疗或放疗的耐药。早期研究报道在皮肤黑素细胞、角质细胞和成纤维细胞中Sphk2表达量非常低,而在原代SCC细胞和细胞系中Sphk2呈高表达状态[11],其可成为SCC治疗的靶点。
Qu属于一种药理活性较强的天然成分,在多种病理反应中均起着较好的作用。研究发现槲皮黄酮不仅对多种致癌剂、促癌剂有拮抗作用,而且可以抑制多种恶性肿瘤细胞的生长;并且Qu对人卵巢癌细胞、乳腺癌细胞、肝癌细胞、结肠癌细胞、前列腺癌细胞等生长均有较好的抑制作用[12]。本实验发现Qu对A431细胞具有抗生存、抗增殖和促凋亡的药理活性,提示Qu可能成为治疗SCC的潜在药物。
Akt/S6K1和JNK信号通路参与了肿瘤的发生发展[13,14],并且在皮肤癌组织中发现Akt信号通路异常活化及JNK信号传导的异常失活[15,16],并且该信号传导与多个关键的癌变行为关系密切,包括肿瘤细胞存活、增殖、迁移、细胞凋亡抵抗、癌细胞转移及血管生成和转化等[13,14]。因此这两个通路在皮肤癌的治疗和预防中常被作为靶点[17]。本实验发现Qu可以显著抑制A431细胞中Akt/S6K1信号传导,并激活JNK信号通路。采用分子靶标药物对Akt信号进行抑制,在体内外实验中均表现出较好的抗SCC的作用[18]。Qu对Akt/S6K1信号通路进行抑制,可能是其诱导SCC细胞凋亡的原因之一;采用Akt特异性激动剂SC79处理细胞时,可明显减弱Qu诱导肿瘤细胞凋亡的活性。SphK2基因沉默能诱导神经酰胺的积累,还会诱导Akt的去磷酸化[19]。同样,Qu处理A431细胞在降低Akt/S6K1信号传导时伴随着S1P水平的降低,与前期报道结果类似[20]。早期研究也表明,Qu可通过抑制Akt信号传导进而降低乳腺癌细胞侵袭[21],也可通过降低S6K1磷酸化水平抑制增殖表皮癌细胞生长[22];另外,Qu可通过调节JNK信号活化诱导结肠癌细胞凋亡[23]。既往研究已证实,Akt/S6K1和JNK通路为SphK2的下游信号[11,24],本文研究也发现过表达SphK2能部分逆转Qu对Akt/S6K1信号的抑制作用及对JNK信号的激活作用。
另外,Qu处理A431细胞可以明显激活JNK信号通路,进而诱导肿瘤细胞凋亡。当采用JNK信号通路的特异性抑制剂SP600125与Qu共同处理细胞时,降低了Qu对A431细胞凋亡的诱导作用。A431细胞中JNK的激活可能是神经酰胺积累所引起的,也可能是Qu抑制SphK2表达的效应分子。已有研究提出神经酰胺能诱导JNK信号通路活化,进而促使肿瘤细胞凋亡;对JNK信号通路进行抑制可以明显改善神经酰胺诱导的细胞凋亡[25]。Qu降低A431细胞中SphK2表达可以诱导神经酰胺的产生,促使皮肤癌细胞的凋亡。综上所述,Qu可通过抑制Sphk2信号通路降低SCC细胞的增殖活性。
