白花蛇舌草提取物抗多发性骨髓瘤细胞机制研究
2019-12-25刘淑艳林圣云
刘淑艳 黄 畅 林圣云
多发性骨髓瘤(MM)为血液科常见恶性肿瘤,目前多种新药包括新一代的蛋白酶体抑制剂、单克隆抗体及移植技术的应用和发展,大大改善了MM 患者预后。但几乎所有患者都会复发,而且对标准治疗方案耐药[1]。临床除使用西药治疗外常辅助以中草药治疗以期缩短缓解时间、减轻并发症、改善耐药、提高患者生活质量及延长患者生命。白花蛇舌草为临床常用抗肿瘤中药,有实验证明,白花蛇舌草多糖成分对MM 细胞具有诱导凋亡作用[2]。本研究将白花蛇舌草提取物(HDE)单体成分作用于不同MM 细胞,初步探究其抗肿瘤成分及抗肿瘤机制,为研究MM治疗新药及改善耐药提供依据。
1 材料与方法
1.1 材 料 RPMI 8226 和NCI-H929 细胞株来源于浙江大学附属第一医院血液学研究所。HDE 由浙江省中医院中药制剂室从白花蛇舌草(杭州萧山医药公司中药分公司,批号110326)中提取制备。硼替佐米(西安杨森制药有限公司,规格:3.5mg,批号170615343);As2O3(黑龙江哈尔滨医大药业,规格:10mg,批号20170401)。
1.2 试剂及仪器 IMDM 培养液(Gibco);胎牛血清(Gibco);四甲基偶氮唑蓝(MTT,Sigma);碘化丙锭(PI)试剂盒(联科生物,批号A82381024);细胞凋亡检测试剂盒(联科生物,批号A80010633);二氧化碳孵育箱(美国Thermo,3111);流式细胞仪(美国BD公司,FACS CantoⅡ);酶标仪(美国BIO-TEX,Epoch2);二甲基亚砜(DMSO,SIGMA 公司);水平式离心机(北京京立离心机有限公司,LDZ5-2)。
1.3 方 法
1.3.1 HDE 制备 取200g 白花蛇舌草的干燥全草,经粉碎后用5400mL 体积分数80%乙醇浸泡(RT,0.5h)并浓缩提取(80℃,2h),再将经过干燥蒸发得到的提取物溶解于200mL 蒸馏水中,用乙酸乙酯进行液液萃取,把过滤和干燥得到的5g 提取物再次溶解于100mL 蒸馏水中,并用蒸馏水和体积分数60%乙醇进行连续多次洗脱,将乙醇馏分洗脱物收集和干燥后用蒸馏水配成12mg/mL 的受试物样品。
1.3.2 细胞培养 细胞悬浮生长于DMEM 培养液(含胎牛血清)的培养瓶中,并置于CO2孵育箱中进行孵育,常规换液并观察细胞生长情况,每2~3 天传代1 次,取对数生长期细胞进行实验。
1.3.3 MTT 法检测细胞增殖抑制情况 取对数生长期RPMI 8226 及NCI-H929 细胞,以6×105/mL 接种于96 孔培养板,终体积150μL。分别按终浓度1.25、2.50、5.00、7.50、10.00μM 加入As2O3,按终浓度12.5、25.0、50.0、75.0、100.0nM 加入硼替佐米,作用24、48h。分别按终浓度25、50、75、100、125μg/mL 加入HDE,作用48、72h。培养结束后每孔加入MTT 15μL(5g/L),37℃放置4h;2500r/min 离心20min,弃上清液,每孔加入DMSO 150μL,振动仪振动10min 使结晶物摇匀溶解。酶联免疫分析仪读取490nm 处的吸光度(OD)值,并用以下公式计算各组细胞增值抑制率。实验设4 个平行孔,重复实验3 次。按公式计算细胞增殖抑制率。实验重复3 次,每组设3 个复孔,取平均值为最终结果。Logit 法计算半数抑制浓度(IC50);细胞增殖抑制率(%)=(对照组OD-实验组OD)÷(对照组OD-空白组OD)×100%。
1.3.4 流式细胞术检测细胞凋亡及细胞周期 RPMI 8226 细胞以2×105/mL 接种于培养瓶,终体积5mL。按终浓度2.5、5.0、10.0μM 分别加入As2O3,按终浓度25、50、100nM 分别加入硼替佐米,作用24h 后测定细胞细胞凋亡及细胞周期。按终浓度50、100、150μg/mL分别加入HDE,作用48h 后测定细胞凋亡及细胞周期,同时设空白(不加药)对照组,800r/min 离心5min后收集细胞,分别收集1.5×105个和2×105个细胞,冷PBS 洗涤2 次,800r/min,4℃离心5min,弃上清。100μL 1×Binding Buffer 重悬细胞,加5μL Annexin V-FITC 和5μL PI 染色剂,轻轻混匀,避光室温反应15min,加入300μL 1×Binding Buffer 重悬,立刻用流式细胞仪检测,用Cellquest 1.2 分析软件分析结果。
1.3.5 统计学方法 应用SPSS 19.0 软件进行数据分析处理。计量资料以均数±标准差()表示,单变量两组比较采用t 检验,多组资料比较采用单因素方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 不同药物及浓度对RPMI 8226 及NCI-H929细胞增殖抑制的影响 不同浓度As2O3、硼替佐米及HDE 作用于RPMI 8226 及NCI-H929 细胞增殖的抑制作用具有浓度及时间依赖性(趋势图见图1-1 至2-3)。不同药物作用于细胞的IC50 见表1。
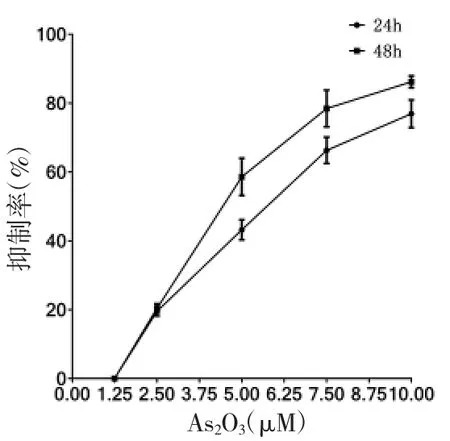
图1-1 不同浓度As2O3作用于RPMI 8226
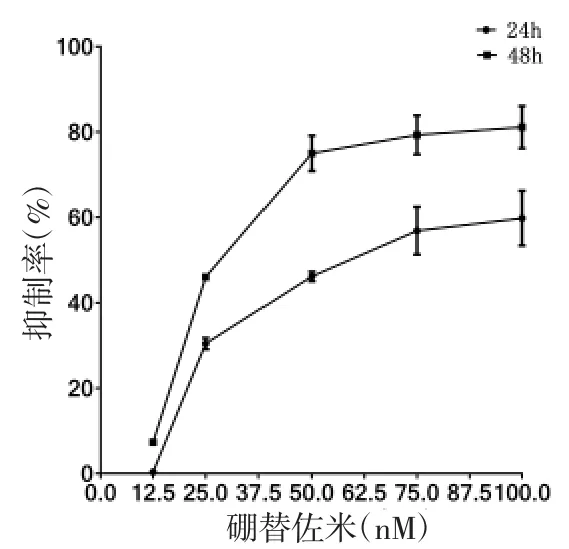
图1-2 不同浓度硼替佐米作用于RPMI 8226
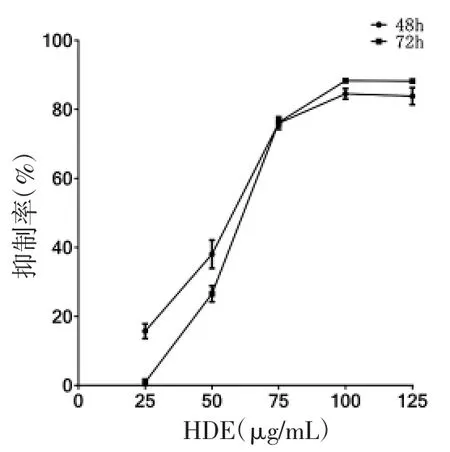
图1-3 不同浓度HDE 作用于RPMI 8226
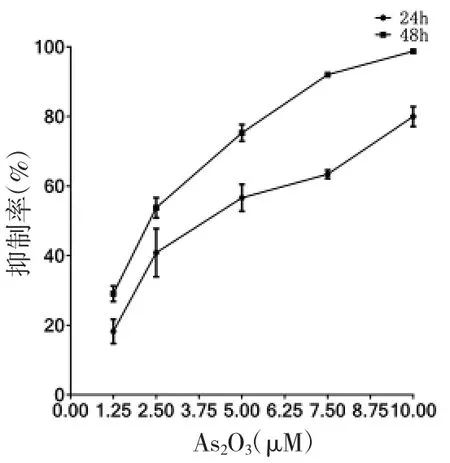
图2-1 不同浓度As2O3作用于NCI-H929
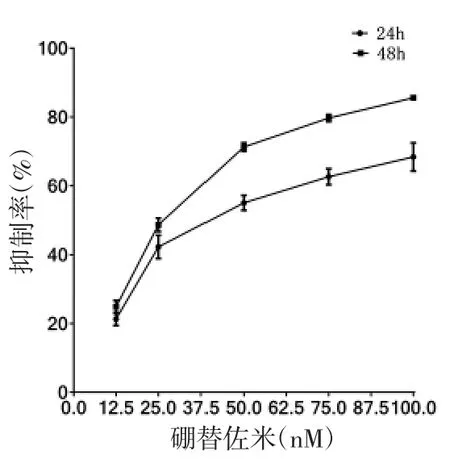
图2-2 不同浓度硼替佐米作用于NCI-H929
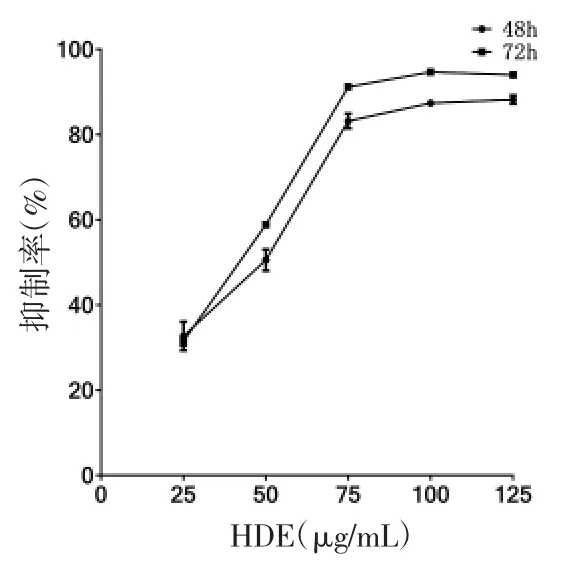
图2-3 不同浓度HDE 作用于NCI-H929
2.2 不同药物及浓度对RPMI 8226 及NCI-H929细胞周期的影响 流式细胞仪结果显示,与对照组比较,硼替佐米均可使RPMI 8226 及NCI-H929 细胞G2/M 期所占比例增加,HDE 均可使RPMI 8226及NCI-H929 细胞G0/G1 期所占比例显著增加。而As2O3对RPMI 8226 细胞周期无明显影响,可使NCI-H929 细胞G0/G1 期所占比例增加。且上述三种药物浓度越大,对RPMI 8226 及CNI-H929 细胞周期影响越大。见图3-1、2,表2-4。

图3-1 不同药物对RPMI 8226 细胞周期的影响
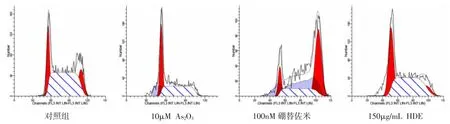
图3-2 不同药物对NCI-H929 细胞周期的影响
2.3 不同药物及浓度对RPMI 8226 及NCI-H929细胞凋亡的影响 流式细胞仪结果显示,与对照组比较,As2O3、硼替佐米、HDE 均可诱导细胞凋亡,且随着浓度的增加,细胞凋亡比例增高。见图4-1、2,表5-7。
表1 不同药物不同时间作用于RPMI 8226、NCI-H929 细胞的IC50()

表1 不同药物不同时间作用于RPMI 8226、NCI-H929 细胞的IC50()
注:HDE:白花蛇舌草提取液;IC50:半数抑制浓度
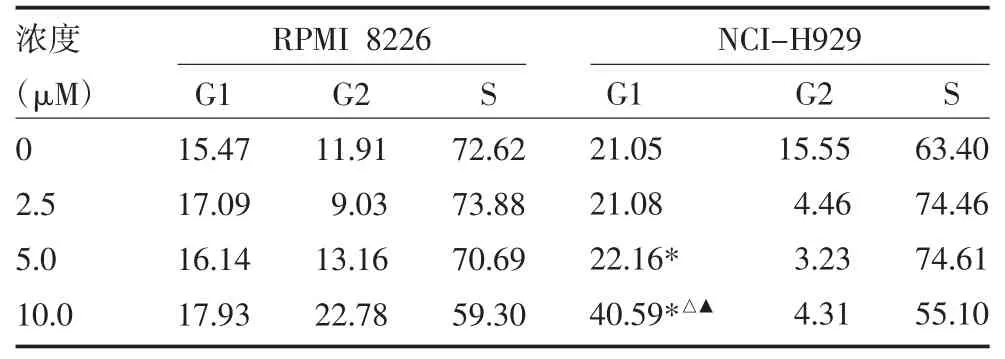
表2 不同浓度As2O3对RPMI 8226、NCI-H929细胞周期影响(%)
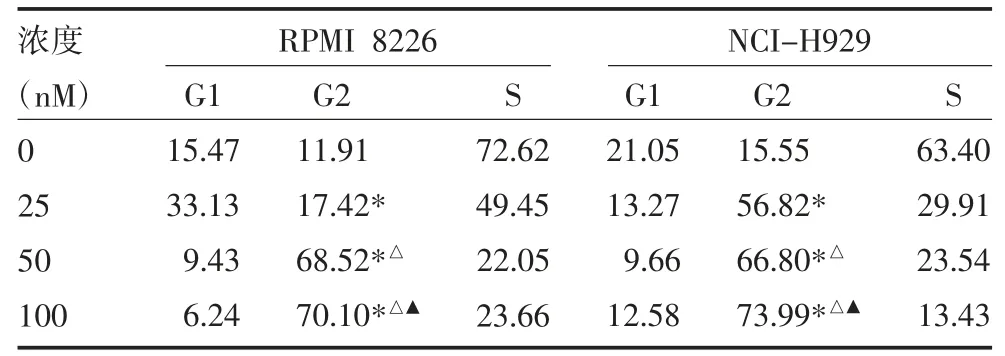
表3 不同浓度硼替佐米对RPMI 8226、NCI-H929细胞周期影响(%)
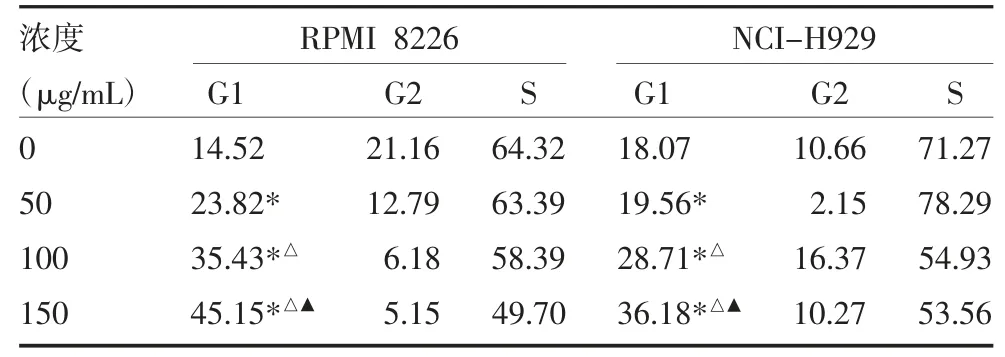
表4 不同浓度HDE 对RPMI 8226、NCI-H929细胞周期影响(%)
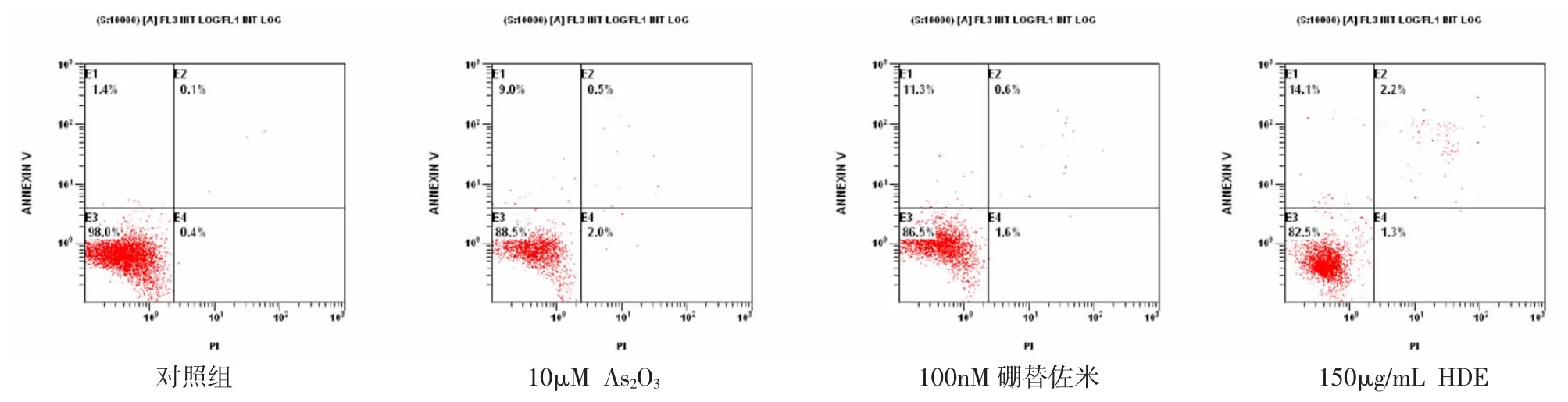
图4-1 不同药物对RPMI 8226 细胞凋亡的影响
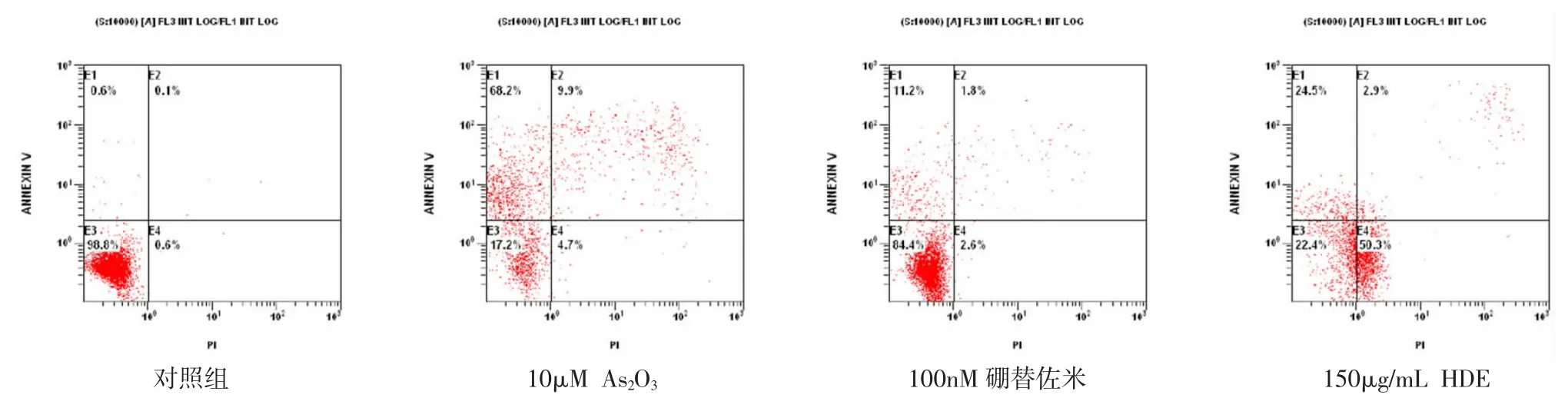
图4-2 不同药物对NCI-H929 细胞凋亡的影响
表5 不同浓度As2O3作用于RPMI 8226、NCI-H929 细胞24h 的凋亡率(%,)
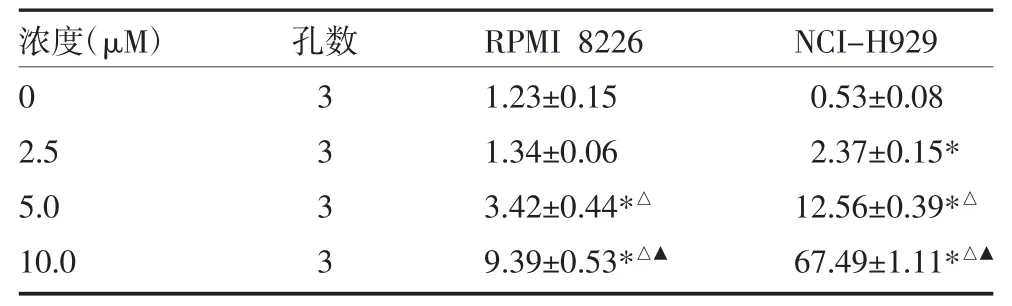
表5 不同浓度As2O3作用于RPMI 8226、NCI-H929 细胞24h 的凋亡率(%,)
注:不同浓度As2O3对RPMI 8226、NCI-H929 细胞凋亡率的影响(P均<0.01);与0μM 组比较,*P<0.05;与2.5μM 组比较,△P<0.05;与5.0μM 组比较,▲P<0.05
表6 不同浓度硼替佐米作用于RPMI 8226、NCI-H929细胞24h 的凋亡率(%,)

表6 不同浓度硼替佐米作用于RPMI 8226、NCI-H929细胞24h 的凋亡率(%,)
注:不同浓度硼替佐米对RPMI 8226、NCI-H929 细胞凋亡率的影响(P均<0.01);与0nM 组比较,*P<0.05;与25nM 组比较,△P<0.05;与50nM 组比较,▲P<0.05
表7 不同浓度HDE 作用于RPMI 8226、NCI-H929 细胞48h的凋亡率(%,)
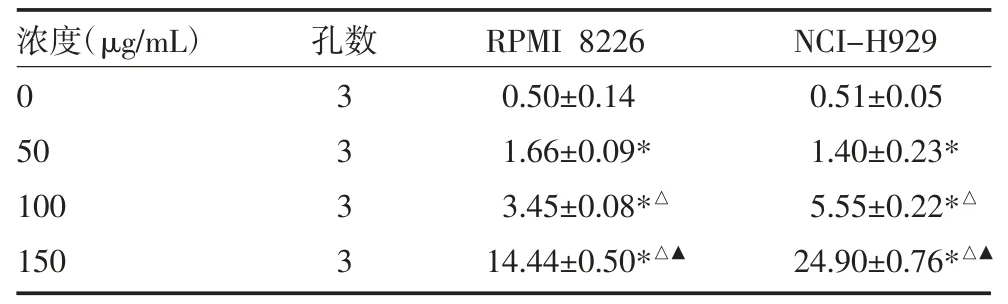
表7 不同浓度HDE 作用于RPMI 8226、NCI-H929 细胞48h的凋亡率(%,)
注:不同浓度HDE 对RPMI 8226、NCI-H929 细胞凋亡率的影响(P 均<0.01);与0μg/mL 组比较,*P<0.05;与50μg/mL 组比较,△P<0.05;与100μg/mL 组比较,▲P<0.05;HDE:白花蛇舌草提取液
3 讨论
本实验提取白花蛇舌草浸取物,结果显示,HDE在一定浓度范围内对MM 细胞具有较为明显剂量依赖的杀伤作用,50~75μg/mL 对细胞的抑制作用最为明显。其通过改变细胞周期及诱导细胞凋亡来发挥抑制MM 的作用。
肿瘤细胞的周期调控也是治疗肿瘤的方法之一[3]。本研究发现,HDE 可阻滞MM 细胞在G0/G1期,这是其具有抗肿瘤作用的机理之一,其对细胞周期素D1、E 以及细胞周期正性因子CDK2/4/6 的作用机制还需进一步实验研究。研究显示,一定浓度的As2O3可使Hs-SμLton 细胞主要阻滞于G0/G1 期,而诱发细胞凋亡。As2O3诱导MM 细胞凋亡与线粒体相关[4]。HDE 促凋亡作用可能与As2O3有相似之处。同时其具有诱导MM 细胞凋亡的作用,但具体机制与蛋白酶体抑制剂不同。以硼替佐米为代表的蛋白酶体抑制剂可将MM 细胞阻滞在G2 期,其具体的机制包括促进MM 细胞内促凋亡蛋白NOXA 和抑癌基因p53 表达,激活Caspase 通路,导致组蛋白高度乙酰化,从而导致MM 细胞凋亡等[5-6]。目前治疗MM 新药物及方法层出不穷,免疫调节剂、组蛋白去乙酰化酶抑制剂、信号转导调节剂、单克隆抗议及CAR-T治疗等均在深入研究[7-8]。
目前已知的可能导致MM 耐药的机制较多,有研究发现,miR-221-222 可下调激素敏感MM 细胞中p53 相关凋亡调节物(PUMA),促使MM 细胞对激素耐药[9]。高表达的重组蛋白及超二倍体都与MM 的预后良好相关,重组蛋白的下调导致MM 细胞对免疫调节剂的耐药[10]。硼替佐米耐药机制部分原因可能是IGF-1 及受体的高表达激活下游的Akt 及JNK 通路[11]。Hedgehog 信号通路的活化,促进下游抗凋亡基因BCL2 的表达可抑制硼替佐米诱导的细胞凋亡作用[12]。组蛋白去乙酰化抑制剂(HDACi)对于多种抗MM 药物的耐药,可通过下调相关耐药基因(miR-221-222、c-Myc)、消除IL-6 和IGF-1 对MM 细胞的保护作用、阻碍HIF-1α 活化、降低NF-κB 活性等,从而发挥克服相关药物耐药[13-16]。目前中药有效成分作为化疗及靶向治疗肿瘤的辅助治疗,逆转MM 耐药方面均发挥了较大作用,为其他抗MM 中药的研究提供了更为成熟的思路及方法[17-18]。
综上所述,HDE 可能通过诱导RPMI 8226 及NCI-H929 细胞凋亡及阻滞细胞周期来抑制骨髓瘤细胞增殖。
