生物技术处理船舶舱底含油污水
2019-12-24石建强张少君王明雨
石建强,张少君,王明雨
(山东交通学院船舶与轮机工程学院,山东威海 264200)
0 引言
船舶在运行过程中产生含油污水,如果未加处理就排放,污水进入水体或土壤会影响生态环境和人类健康,且难以在短时间内清除。随着航运业的快速发展,如何治理船舶舱底的含油污水(以下简称含油污水)越发受到人们的重视[1-2]。含油污水主要由船舶机舱内各系统中的油泄漏产生,含有大量乳化油及石油烃类污染物,主要采用物理法、化学法和生物法[3]处理,相较于物理法和化学法,生物法具有安全可靠、成本低、处理效果好、无二次污染等特点[4]。
石油烃污染物最终是由海洋微生物自然降解而消除,微生物修复技术是处理石油烃污染物最有效的方法[5-6]。据报道,已经筛选分离出来的石油烃降解菌有100余属,200多种[7]。林佳辉等[8]从青海油田附近被石油污染的土壤中分离得到一株中度嗜盐菌SalinicolazeshuniistrainN4T,对柴油的5 d降解率为56%。AI-Hawash等[9]从鲁迈拉油田分离得到2株原油降解真菌RMA1和RMA2,14 d后对原油的降解率分别为57%和55%。船舶舱底含油污水的成分复杂,单一菌株大多只能降解一种或是几种烃类,含油污水的复杂性决定了需要多种菌株共同参与降解[10]。罗群等[11]从含油污水中筛选菌株构建复合菌群,菌群对含油污水的降解率达到73.11%,比单菌株提高了30%。Chaudhary等[12]利用两株石油降解菌K-6、Y2-2和一株固氮菌KCTC 2426构建复合菌群,处理40 d后,从土壤中清除83.10%的柴油。相较于单一菌株,复合菌群可极大提高对石油污染物的降解率[13-15],构建复合降解菌群将成为油污处理最经济环保的手段。
本研究对含油污水分离纯化得到S1、S2和S5三株高效石油烃降解菌,构建复合菌群S15并考察不同环境因素下菌群对烃降解能力的影响,研究菌群对烃类物质降解的特性,以期为生物技术清除含油污水提供理论依据和技术支持。
1 试验材料与方法
1.1 试剂
生物试剂盒购自某生物科技有限公司;引物、测序委托某生物科技有限公司合成。0#柴油购于某中国石化加油站;二氯甲烷、正己烷、石油醚、丙酮等均为色谱纯。
1.2 菌株与培养基
从含油污水中分离出23株石油烃降解菌,优选对含油污水耐受性最好、降解率最高的5株石油烃降解菌S1、S2、S3、S4和S5,进行复配菌群构建。
LB培养基:蛋白胨、酵母膏、NaCl的质量浓度分别为10、5、2 g·L-1。
无机盐培养基:C10H14N2Na2O8、KH2PO4、CaCl2、K2HPO4、MgSO4·7H2O、NH4Cl的质量浓度分别为0.01、3.0、0.01、1.5、0.1、2 g·L-1,pH值为7.5±0.1。
柴油培养基:量取4 g·L-1的灭菌柴油添加到无机盐培养基中。
富集培养基:量取4 g·L-1的灭菌舱底含油污水添加到无机盐培养基中。
1.3 试验方法
1.3.1 筛选高效降解菌
将加入5 mL含油污水的无机盐培养基放在37 ℃、转速为180 r·min-1的恒温摇床上富集培养48 h,每次取3 mL发酵后的培养液连续转接3代,将传代完成后的新鲜培养液再按照10-1~10-7梯度稀释,分别涂布到LB(Luria-Bertani)固体培养基平板;将培养基平板置于恒温培养箱(37 ℃)中培养2 d,分离纯化平板上的菌落并编号整理,转接至富集培养基中,培养并观察菌落的生长状况。
1.3.2 单株菌对柴油的降解率
1)柴油的紫外吸收标准曲线
用石油醚萃取柴油培养基并稀释至适宜质量浓度,用紫外分光光度计进行全波长扫描,确定最佳吸收波长。配制质量浓度为0、5、10、15、20、30、40 mg·L-1的柴油标样系列溶液,在最佳波长下读取吸光值,绘制标准曲线。
2)柴油降解率
将5株菌株以2%的体积分数分别接种到柴油培养基,在37 ℃、转速为180 r·min-1的恒温摇床上培养7 d。以未接入菌株的空白柴油培养基为对照组,每组试验设置3个平行组。取发酵液在离心温度为4 ℃,9000 r·min-1的转速下离心转动15 min;取20 mL石油醚对离心后上清液萃取,超声波振荡10 min后静置分层,回收上层有机相,经无水硫酸钠脱水后,倒入50 mL容量瓶中,定容后保存待测。根据绘制的标准曲线,计算样品中柴油的降解率[16]
(1)
式中:C1为对照组中的柴油的质量浓度,C2为样品中的柴油的质量浓度。
1.3.3 复合菌群的构建
将筛选出的优势菌株按照不同的配伍,等比例接种构建复合菌群。将不同的菌群分别接种到柴油培养基,以未接入菌株的空白柴油培养基为对照组,每组试验设置3个平行组,在37 ℃、转速为180 r·min-1的恒温摇床上培养7 d,然后计算各菌群的降解率并进行对比,筛选出最佳降解菌群。
1.3.4 菌株16S rDNA鉴定
表1 PCR反应程序

温度/℃时间/s循环次数94180194 30 58 303572 60726001
将筛选出的优势株菌进行16S rDNA鉴定。使用生物试剂盒提取菌株基因组序列,利用引物(27F:5′-AGAGTTTGATCMTGGCTCAG-3′和1492R:5′-AAGGAGGTGWTCCARCC-3′)对菌株16S rDNA基因进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR扩增反应程序设计见表1,委托苏州金唯智生物科技有限公司完成测序。
在NCBI数据库中使用局部序列排比检索工具(basic local alignment search tool,BLAST)方法对测序结果进行序列比对,选取同源性较高的序列。采用CLUSAL X软件比对序列,使用MEGA 7.0软件Neighbor-Joining(N-J)法构建系统发育树[17]。
1.3.5 环境因素对菌群降解率的影响
1)盐度
将光密度D(λ)600 nm=1.5的菌液按2%的接种体积分数接入6组NaCl质量浓度分别为0、2、4、6、8、10 g·L-1的柴油培养基中。在37 ℃恒温、转速为180 r·min-1的摇床上培养7 d,每组实验设置3个平行组,检测每组菌液的残油质量浓度,分别计算降解率并进行对比,选择最适盐度。
2)pH
将D(λ)600 nm=1.5的菌液按2%的接种体积分数,在最适盐度下接入pH值分别为6.0、6.5、7.0、7.5、8.0的5组柴油培养基中,在37 ℃恒温、转速为180 r·min-1的摇床上培养7 d,每组实验设置3个平行组,测定每组菌液的残油质量浓度,分别计算降解率并进行对比,选择最佳pH值。
3)温度
将D(λ)600nm=1.5的菌液按2%的接种体积分数,在最适盐度和pH值下接入5组柴油培养基中,将5组菌液分别置于温度为25、30、35、40、45 ℃的环境下,转速为180 r·min-1时振荡培养7 d,每组实验设置3个平行组,测定每组菌液7 d后的残油质量浓度,分别计算降解率并进行对比,选择最佳温度。
1.3.6 菌群产表面活性剂
1)表面张力
在室温下,使用表面/界面张力仪测量方法中的铂金环法测定单株菌及菌群发酵液在0~10 d内的表面张力,重复3次取平均值。
2)乳化活性
采用乳化指数(E24)法,按照1:1的比例,分别将菌株活化培养后的发酵液、上清液、等体积菌体重悬液与4种烷烃物质加入10 mL试管中,漩涡震荡3 min,室温静置24 h后计算E24[18],重复3次取平均值。
(2)
式中:Hr为乳化层高度,Hy为有机相总高度。
3)细胞疏水性
将培养5 d后的菌株发酵液在10 000 r·min-1的转速下离心10 min,采用生理盐水洗涤收集的菌体并稀释至D(λ)600nm=0.5。取4 mL菌体重悬液加入等体积的4种烷烃物质,以不加入菌体重悬液的烷烃物质为对照组,漩涡震荡2 min,静置30 min后取下层水相测量D(λ),重复3次取平均值。细胞疏水性(cell surface hydrophobicity,CSH)为[19]
(3)
式中:D(λ)S为试验组光密度,D(λ)D为对照组光密度。
4)表面活性剂
参考Biniarz的方法[20]提取表面活性剂,使用高效液相色谱(岛津LC-20AT)检测粗提物,将乙腈-水-TFA溶液分别作为流动相A和流动相B,洗脱速度为1.0 mL·min-1,色谱柱温度为35 ℃,进样量为10 μL,设二极管阵列(photo diode array,PDA)检测器检测波长为210、254、280、320、450 nm,通过内部添加标准品的方法判断表面活性剂的性质。
1.3.7 菌群降解柴油的GC-FID测定
将菌群按2%的接种体积分数接种到柴油为唯一碳源的培养基中(柴油的质量浓度为4 g·L-1),在最适生长环境下培养7 d,采用GC-FID(岛津GC-2014C)测定菌株发酵液。GC-FID载气为高纯N2,色谱柱选用Wonda Cap 5(规格为30 m×0.25 mm×0.25 μm),初始柱温50 ℃,保留1 min,然后以5 ℃·min-1的速度将柱温增加至280 ℃,进样口和检测器温度均为280 ℃,采集60 min,得到气相色谱图。
2 结果与讨论
2.1 单株菌
2.1.1 筛选
分离纯化后得到5株形态完整、生长良好的高效原油降解菌S1、S2、S3、S4和S5,如图1所示,5株菌在LB培养基上的显微形态观察结果如表2所示。

图1 S1~S5在平板培养基上的菌落形态
表2 S1~S5菌落的显微形态
2.1.2 柴油的紫外吸收标准曲线
全波长范围扫描溶有石油烃的石油醚样品,在波长为256 nm时有明显的吸收峰,测试波长为256 nm。以样品质量浓度为x轴,对应吸光度为y轴,拟合标准曲线,拟合方程为:y=0.002 0x+0.001,线性相关系数R2=0.999 38,拟合度较高,适用于分析测试油污的质量浓度。
2.1.3 降解率
采用紫外分光光度计,通过柴油标准曲线拟合方程计算5株菌在柴油培养基中发酵7 d后培养基中残油的含量,得到菌株S1~S5对柴油的7 d降解率分别为68.05%、62.72%、11.25%、20.11%和42.47%。
2.2 复合菌群
将筛选出的优势菌株S1、S2和S5按照不同的配比构建4组复合菌群,分别命名为S12、S15、S25、和S125,测试复合菌群及不含菌群的空白组对柴油的7 d降解率,结果分别为75.17%、83.12%、53.77%、77.87%和0,因此,S15为最佳降解复合菌群。S15由S1、S52株菌组合而成,降解率高于单株菌及其它菌群,推测这2株菌之间存在协同降解作用,有利于石油烃的降解消除。通过菌落形态观察,菌株S1和S5可能为芽孢杆菌属,有研究表明芽胞杆菌属内亲缘性近的菌株复配主要表现为协同降解作用[21],需进一步做分子鉴定来确定菌属。
2.3 菌株鉴定结果
使用1%的琼脂糖凝胶电泳检验2株石油烃降解菌S1和S5的16S rDNA序列PCR扩增产物,得到相应的电泳图谱,如图2所示。检测结果表明所提取DNA纯度较好,符合测序要求。

图2 S1、S5的PCR扩增产物电泳图谱
使用N-J法在MEGA 7.0软件中进行建树分析,如图3所示。鉴定结果表明S1菌株为Bacillustoyonensis,S5菌株为Bacillusalbus,均为芽孢杆菌属。关于芽孢杆杆菌强化降解石油污染的文献很多,Parthipan等[22]研究发现有的枯草芽孢杆菌可产天然脂肽类表面活性剂,对石油的降解率为87%。由此推测S15具有高降解率的原因是其内部的各单菌均为可分泌天然脂肽的芽孢杆菌,脂肽在石油烃的降解过程中起到乳化、增溶的作用,且彼此之间表现为协同降解,因此S15对石油污染环境具有修复潜力和应用前景。


图3 S1、S5的16S rDNA系统发育树状图
2.4 不同环境因素下S15的降解率
在不同盐度、pH值及温度下培养S157 d后测定S15对柴油的降解率,盐度不同时的测定结果如图4所示。NaCl的质量浓度为0时,S15对柴油的降解效率为82.58%;在NaCl质量浓度为0~2 g·L-1时,S15仍保持较高的降解效率;S15对柴油的降解效率随着盐度的升高而迅速降低,尤其是NaCl的质量浓度大于6 g·L-1时,降解率急剧下降,说明S15在低盐环境中可发挥最佳的降解效果。
S15对pH值变化的耐受性较宽泛,如图5所示。当pH值为7.5时,S15的降解率高达81.95%,pH值为6~8时S15保持较好的降解效果,S15的降解率随碱性的增强显著下降。含油污水的环境一般为中性,测试结果表明S15适用于处理含油污水。
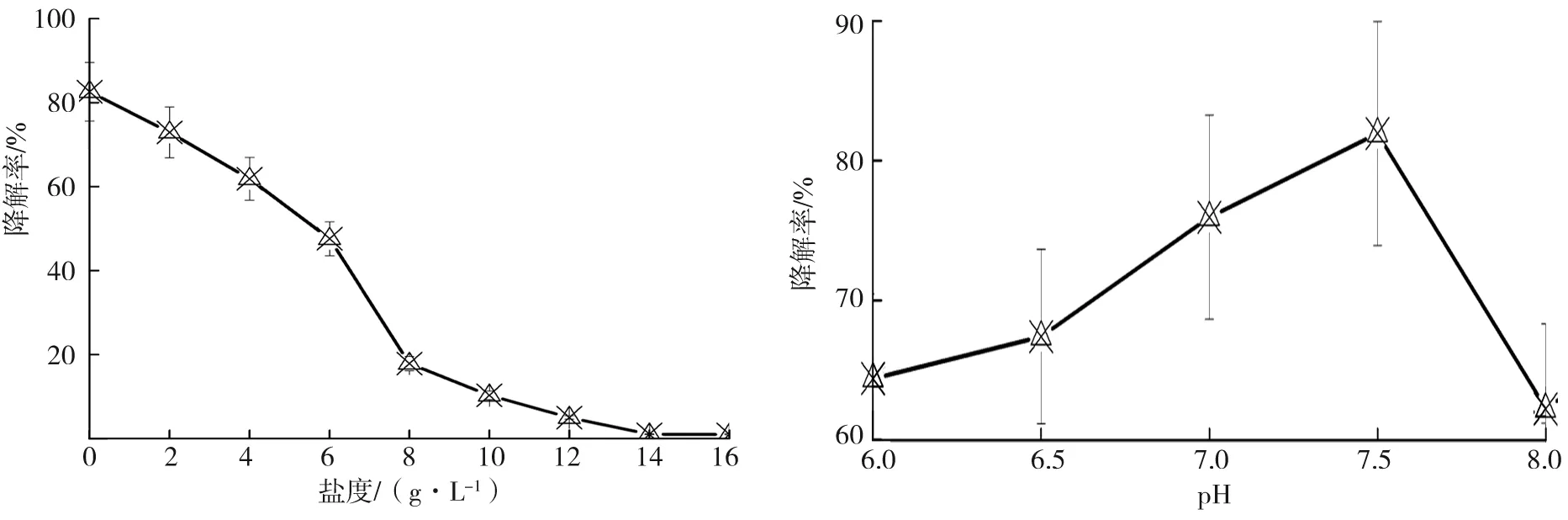
图4 S15降解效率随盐度的变化规律 图5 S15降解效率随pH的变化规律

图6 S15降解率随温度的变化规律
S15对柴油的降解率随温度的变化规律如图6所示,可以看出,S15在25~35 ℃时对柴油的降解能力较高,35 ℃时S15的降解率最佳,为81.96%。此后,S15的降解率随温度的升高呈线性下降。含油污水的温度一般为25~35 ℃,所以S15适用于处理含油污水。
2.5 菌群产表面活性剂特性
2.5.1 表面张力
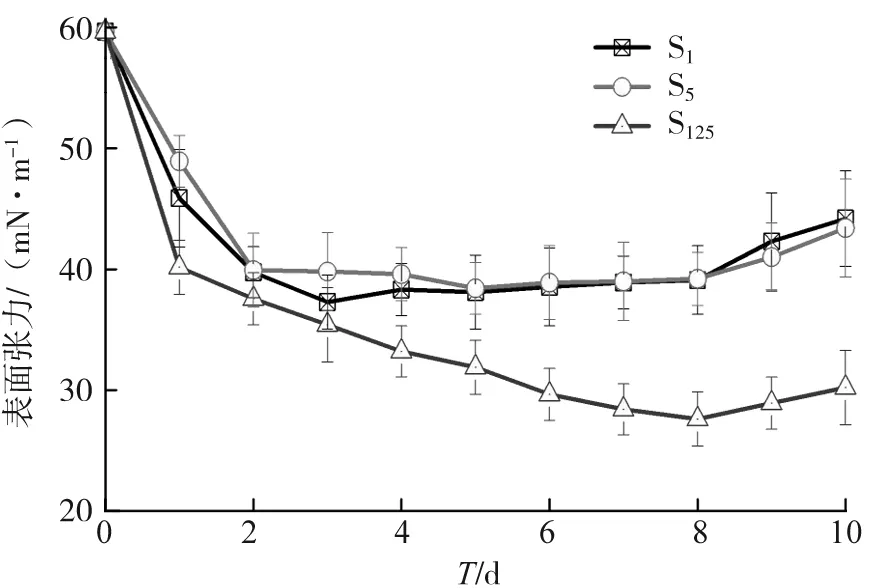
图7 不同菌株发酵液的σ
测定S1、S5及S15活化后在发酵液0~10 d的表面张力σ,结果如图7所示。S1发酵液的σ在2 d后趋于平稳,σ=(38±2)mN·m-1;6 d后σ升高,菌株产表面活性剂能力降低;S5发酵液的σ在5 d时达到最低,为38.42 mN·m-1,之后σ随时间延长逐渐回升。S1与S5发酵液的σ回升可能是培养基pH的改变限制了菌株继续产生表面活性剂,也有可能是部分生物表面活性剂被菌株当作碳源消耗[23];S15发酵液的σ随时间延长持续降低,在7 d时达到最低,为27.60 mN·m-1,之后σ开始升高,10 d后σ为30.21 mN·m-1,菌群降低σ的能力较好。一般认为,能将σ降低到45 mN·m-1以下的菌株可视为产表面活性剂菌[24]。根据试验结果可判断S1、S5以及S15均能产表面活性剂,能使菌株与疏水烃类物质成分充分接触,因此S15对柴油具有良好的降解效果。
2.5.2 乳化特性与细胞疏水性
测定静置24 h后的S1、S5及S15的发酵液、上清液、菌悬液与不同烷烃类物质的乳化指数E24,如图8、9所示。由图8、9可以看出,S1与S5对十六烷、正辛烷、正己烷和二甲苯的乳化特性形成互补,S1对十六烷和正辛烷有较高的乳化能力,S5对正己烷和二甲苯有较高的乳化能力。
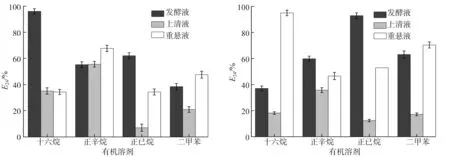
图8 S1对不同疏水底物的E24 图9 S5对不同疏水底物的E24
测定S15对不同疏水底物的E24,如图10所示。由图10可以看出,S15对4种疏水底物的E24均超过80%,乳化效果较好,大大增加了降解菌群与烃类的接触面积,可与烃类形成稳定的乳状液体,促进降解菌群对烃类的摄取和降解。
细胞疏水性(cell surface hydrophobicity,CSH)是决定细胞表面黏附性的主要因素[25]。一般细胞疏水性CSH越高,菌株对该类烷烃的吸附效果越好。不同菌株对不同疏水底物的CSH测定结果如图11所示,相较于S1、S5,S15对4种烃类疏水底物的CSH均大于50%,表现出较好的细胞疏水性。结合图7可以推测,S1产表面活性剂的能力低于S5,S1对烃类的疏水能力差,S15具有持续产生生物表面活性剂的能力,大大提高了其细胞表面疏水能力,对烷烃类物质普遍具有较好的吸附特性,这也是S15具有较高降解率的原因。显然,生物表面活性剂产量的变化在一定程度上影响菌株的乳化性和疏水性,试验结果与许学峰等[26]得到的结论一致。菌株分泌天然表面活性剂使得S15乳化烷烃类物质效果更好,有利于进一步利用并降解石油烃。

图10 S15对不同疏水底物的E24 图11 不同菌株对不同疏水底物的CSH
2.5.3表面活性剂
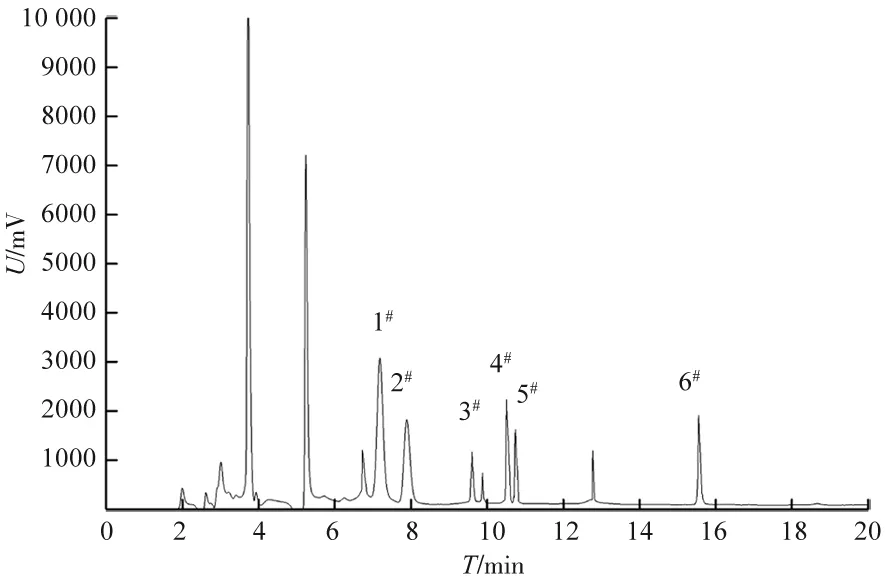
图12 S15发酵液粗提物的HPLC测试结果
对S15发酵液的粗提物与标准品分别进行高效液相色谱(high performance liquid chromatograph,HPLC)检测,流动相A (乙腈、水、TFA的体积比为10:89.2:0.8)和流动相B(乙腈、水、TFA的体积比为89.2:10:0.8)梯度洗脱0~20 min,一次洗脱所用流动相B的体积比为5%~15%,流速为1.0 mL·min-1,进样量10 μL,柱温35 ℃,PDA检测波长为254 nm,测试结果如图12所示。在保留时间t分别为7.178、7.882、9.600、10.506、10.741、15.552 min时,分别出现6个脂肽吸收峰。可初步判断,菌群分泌的表面活性剂类型为脂肽型表面活性剂,是微生物生长繁殖过程中产生的重要次级代谢产物[27],可分离得到多种能够分泌生物表面活性剂的芽孢杆菌[28-29]。生物表面活性剂具有良好的乳化增溶性能,能显著提高石油烃降解菌对污染物的生物利用度[30]。
2.5.4降解分析
在以柴油为唯一碳源的培养基中培养7 d(柴油的质量浓度为4 g·L-1),分析S15对柴油烷烃C10~C28的降解率。S15对柴油各组分降解GC-FID效果如图13所示,测试数据如表3所示。
a) 降解前 b) 降解后图13 GC-FID检测柴油图谱
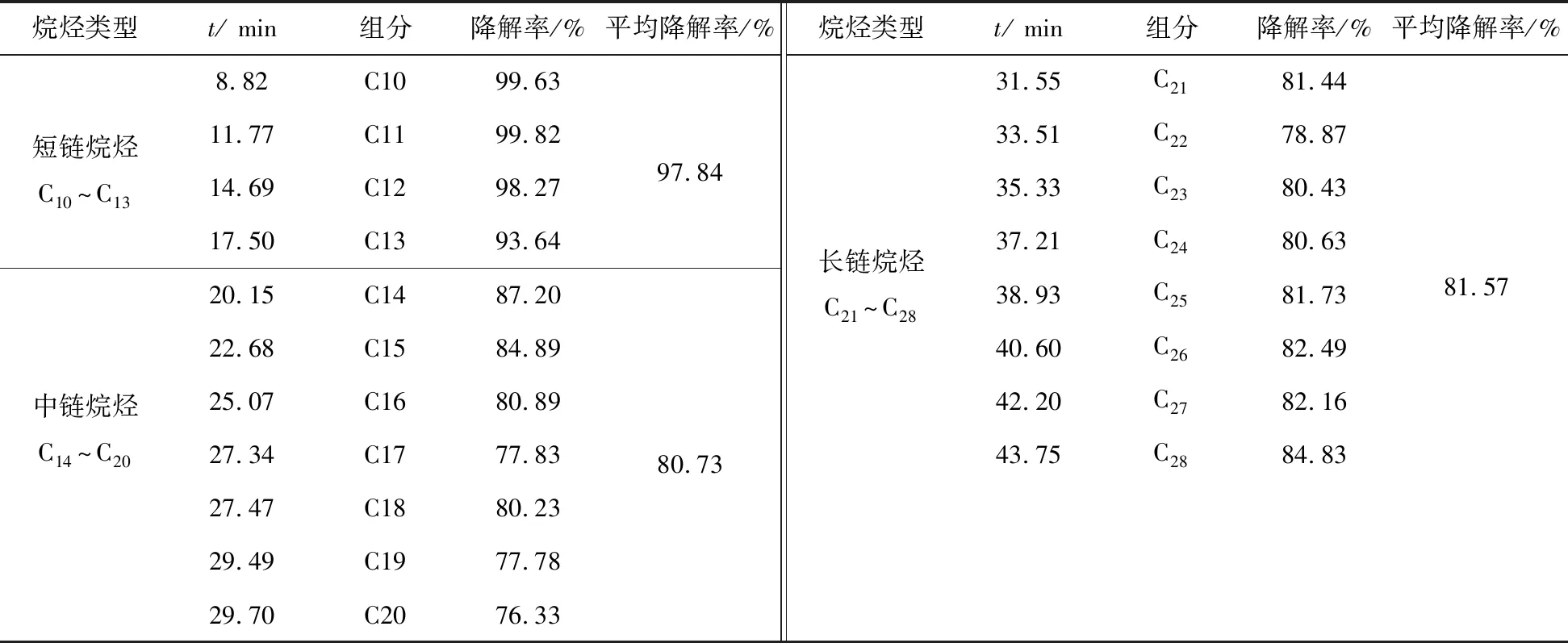
表3 S15对柴油各组分的降解率
柴油主要由碳原子数为C10~C22的复杂烃类混合物构成,由图13、表3可看出,菌群S15对柴油组分中短链烃类的降解效果高于中链烷链和长链烷烃,原因是S15对长链烷烃的乳化和摄取能力随碳链的增加而变差。与单菌株S1和S5相比,菌群S15对柴油的降解效果具有更加明显的优势。试验结果表明,混合菌群是生物法处理石油烃污染物的有效工具。
3 结论
1)分离自船舶舱底含油污水中的菌株S1和S5均具有高效的柴油降解能力,经16S rDNA鉴定S1为Bacillustoyonensis、S5为Bacillusalbus,S1与S5属于可分泌表面活性剂的芽孢杆菌,芽胞杆菌属内亲缘性近的菌株,复配表现为协同降解作用。
2)构建复合菌群并选择降解表现最佳菌群S15。 S15在表面活性剂的作用下,表现出极高的乳化能力(80%以上)和CSH(50%以上),经HPLC分析显示,该表面活性剂为脂肽类生物表面活性剂,在降解过程中起到乳化增溶石油烃污染物的作用,促进S15对石油的摄取和降解。S15的7 d平均柴油降解率达83.12%,其中对短链烷烃的降解率高达97.84%,高于单株菌以及其它菌群对柴油的降解率。S15对石油污染环境具有较强的修复潜力和应用前景。
