5-十七烷基间苯二酚对三阴性乳腺癌MDA-MB-231细胞增殖的抑制作用
2019-12-23解明思朱科学孙宝国
解明思,刘 洁,朱科学,孙宝国,王 静,*
(1.天津科技大学 食品科学与工程学院,天津 300457;2.北京工商大学 中国- 加拿大食品营养与健康联合实验室,北京 100048;3.北京工商大学 北京食品营养与人类健康高精尖创新中心,北京 100048;4.江南大学 食品学院,江苏 无锡 214122)
乳腺癌是全世界女性最常见的恶性肿瘤之一,对女性身心健康构成严重威胁。三阴性乳腺癌是一类雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)与人类表皮生长因子受体2(human epidermal growth factor receptor-type 2,Her-2)均为阴性的恶性乳腺癌,具有复发率高、侵袭性高且预后差等特点,常规治疗效果较差,且对化疗药物易产生耐药性,因此,针对三阴性乳腺癌的治疗策略研究日益成为乳腺癌研究领域的焦点之一[1]。
近年来,天然植物中有效组分的抗癌活性愈发受到学界认可,而全谷物因具有多种保健作用而引起了营养研究者的兴趣。全谷物在预防乳腺癌的发生和发展过程中具有重要作用,流行病学证据显示,大量摄入含有麸皮的全谷物食品与罹患乳腺癌风险存在负相关性[2-3]。5-烷基间苯二酚(5-alkylresorcinols,ARs)是存在于小麦、黑麦等麦类作物中的一类特殊的两亲性酚类化合物[4]。研究表明,ARs具有抗氧化、调节血脂、抑菌等多种生理活性,并能作为小麦、黑麦等全谷物食品摄入的生物标记物[5-9]。本课题组前期分离并比较了不同麦麸单体ARs体外抗炎活性,结果表明,5-十七烷基间苯二酚(5-heptadecylresorcinol,AR-C17)具有较强的抗炎活性[10]。已有研究表明,麦麸中的ARs对不同的肿瘤细胞具有一定的细胞毒性[11-12]。目前,ARs对乳腺癌的增殖抑制活性的影响尚未见报道,其具体作用机理亦不明确。
本研究采用不同浓度的AR-C17体外作用于人三阴性乳腺癌 MDA-MB-231 细胞,通过观察AR-C17对乳腺癌细胞增殖的影响,并结合其对细胞凋亡、细胞自噬的调控,探讨AR-C17抑制乳腺癌细胞增殖的作用机制,希望为全谷物在乳腺癌防治中的应用提供参考,并为谷物副产物的综合开发利用提供依据。
1 材料与方法
1.1 材料与试剂
人三阴性乳腺癌MDA-MB-231细胞,购自美国ATCC细胞库;5-十七烷基间苯二酚AR-C17(纯度大于98%),上海敏旭化工科技有限公司;雷帕霉素(rapamycin,Rapa),中国MCE公司;氯喹(chloroquine,CQ)、2′,7′-二氯荧光素二乙酸酯(2′,7′-dichlorofluorescein diacetate,DCF-DA)、二氯甲基亚砜(dimethyl sulfoxide,DMSO)、RIPA总蛋白提取裂解液、蛋白酶抑制剂及Annexin V-FITC/PI凋亡检测试剂盒,美国Sigma-Aldrich公司;PhosSTOP磷酸酶抑制剂,瑞士Roche公司;5×蛋白上样缓冲液、聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜及ECL超敏显色液,美国Bio-rad公司。Bax、Bcl-2、LC3-Ⅱ及β-actin一抗,羊抗兔IgG(HRP)二抗及自噬检测试剂盒,英国Abcam公司;Ki-67一抗、固定透化工作液及流式染色缓冲液,美国Affymetrix eBiosciences公司;高糖培养基、胎牛血清、Hank’s平衡盐溶液(Hank’s balanced salt solution,HBSS)、磷酸盐缓冲液(phosphate buffer saline,PBS)、0.25%质量分数胰酶(含EDTA)、0.25%胰酶(无EDTA)及CaspGLOWTM荧光活性试剂盒,美国Gibco-Invitrogen公司;CCK-8细胞存活率试剂盒,日本东仁公司;线粒体膜电位检测试剂盒及Z- VAD- FMK,上海碧云天生物技术有限公司。
1.2 仪器与设备
HF90型CO2培养箱,上海力康仪器有限公司;IX73型倒置荧光显微镜,日本Olympus公司;Synergy H1型紫外酶标仪,美国Biotek公司;Cytoflex型流式细胞仪,美国Beckman公司;ChemiDocTM型凝胶成像仪,美国Bio-Rad公司。
1.3 实验方法
1.3.1细胞培养
人乳腺癌细胞MDA-MB-231培养于含有质量分数10%胎牛血清的高糖培养基中,37 ℃、体积分数5% CO2条件下培养,每2~3 d按照1∶3比例传代,取对数生长期的细胞备用。
1.3.2细胞存活率检测
MDA-MB-231细胞消化收集后,以6×104个细胞/mL的密度接种于96孔板内。培养24 h后,每组加入不同药物处理,每组设6个复孔。48 h后,每孔加入10 μL 5 mg/mL的CCK-8试剂,37 ℃培养2 h,用酶标仪检测450 nm处吸光值。
1.3.3胞内肿瘤增殖标志物Ki-67水平测定
MDA-MB-231细胞以6×104个细胞/mL的密度接种于6孔板内。培养24 h后,用25 μmol/L AR-C17处理细胞。作用24 h后消化收集细胞,PBS清洗后加入固定透化工作液,4 ℃避光孵育30 min;采用PBS清洗重悬细胞,加入Ki-67一抗,室温避光孵育30 min;PBS清洗后用流式染色缓冲液重悬细胞,流式细胞仪检测。
1.3.4胞内ROS水平测定
采用DCF-DA检测胞内活性氧水平。MDA-MB-231细胞以6×104个细胞/mL的密度接种于96孔板内。培养24 h后,采用不同浓度AR-C17处理细胞。24 h后,细胞经HBSS清洗后加入10 μmol/L DCF-DA荧光探针,37 ℃无CO2培养60 min。HBSS清洗后加入无血清培养基,酶标仪以激发波长488 nm,发射波长530 nm条件检测荧光强度。
1.3.5细胞凋亡检测
MDA-MB-231细胞以6×104个细胞/mL的密度接种于6孔板内,培养24 h,采用不同药物处理细胞24 h。用不含EDTA的胰酶消化收集细胞,冰PBS清洗后加入500 μL染色缓冲液重悬细胞,并先后加入10 μL Annexin V-FITC和5 μL PI 混匀,室温避光反应30 min。PBS清洗后加入500 μL染色缓冲液重悬细胞,流式细胞仪检测。
1.3.6活性Caspase 检测
MDA-MB-231细胞以6×104个细胞/mL的密度接种于6孔板内。24 h后,用不同药物处理细胞,并消化收集细胞,PBS清洗2次后用完全培养基重悬细胞,每管样品加入1 μL FITC-VAD-FMK探针,37 ℃孵育60 min,PBS清洗并重悬细胞,流式细胞仪检测。
1.3.7线粒体膜电位检测
采用JC-1法测定线粒体膜电位(ΔΨm)的变化。MDA-MB-231细胞以6×104个细胞/mL的密度接种于6孔板内,24 h后,用不同药物处理细胞。12 h后消化收集细胞,PBS清洗2次后用含有JC-1探针的染色缓冲液重悬细胞,37 ℃、体积分数5% CO2条件下孵育30 min,缓冲液清洗2次,流式细胞仪检测。
1.3.8自噬体检测
参考试剂盒说明书步骤[13],测定细胞内自噬体生成量的变化。MDA-MB-231细胞以6×104个细胞/mL的密度接种于6孔板内。24 h后,用不同药物处理细胞,其中雷帕霉素为自噬诱导剂阳性对照。16 h后消化收集细胞,PBS清洗后用250 μL体积分数5%胎牛血清的培养基重悬细胞,并加入250 μL自噬荧光染料37 ℃避光孵育30 min。PBS清洗并重悬细胞,流式细胞仪检测。
1.3.9Western-Blot检测蛋白表达
MDA-MB-231细胞以6×104细胞/mL的密度接种于6孔板内培养24 h,随后用不同药物处理细胞。处理结束后冰上刮取细胞并用含有体积分数10%磷酸酶抑制剂和体积分数1%蛋白酶抑制剂的RIPA细胞裂解液提取总蛋白;冰上每10 min震荡一次,30 min后12 000 r/min离心15 min,取上清液,二喹啉甲酸法测定蛋白含量。蛋白样品和上样缓冲液充分混合后,95 ℃、5 min充分变性蛋白质备用。蛋白样品经SDS-PAGE凝胶电泳后,转至PVDF膜上。用含吐温-20的三乙醇胺缓冲液(fris buffered saline with Tween-20,TBST)洗膜3次(5 min/次)后,用质量分数5%的脱脂牛奶封闭1 h,随后用TBST洗膜3次(5 min/次),加入一抗4 ℃摇床过夜;TBST洗膜3次(5 min/次),加入二抗(1∶10 000),室温孵育1 h,再以TBST洗膜后加入适量ECL显色液,在凝胶成像仪下曝光,检测不同蛋白的表达,采用Image Lab软件分析实验结果。
1.4 数据分析
2 结果与分析
2.1 AR-C17浓度对MDA-MB-231细胞存活率的影响
AR-C17结构如图1。为了解AR-C17对人乳腺癌MDA-MB-231细胞的增殖抑制作用,本研究以不同剂量的AR-C17(0、10、25、40 μmol/L)处理细胞48 h,采用CCK-8法研究AR-C17对MDA-MB-231细胞存活率的影响,结果如图2。图2显示,随AR-C17浓度的升高,MDA-MB-231细胞存活率逐渐减低,并呈现剂量依赖关系。与空白组相比,AR-C17浓度为10、25、40 μmol/L时,MDA-MB-231的存活率分别降低约16.46%、50.78%和92.14%(P<0.05)。AR-C17对MDA-MB-231细胞的半数致死量IC50为25.78 μmol/L,后续单一浓度实验选取25 μmol/L作为AR-C17对MDA-MB-231细胞作用机制的研究浓度。

图1 5-十七烷基间苯二酚结构式Fig.1 Structure of 5-heptadecylresorcinol

不同小写字母表示差异显著(P<0.05)。图2 AR-C17浓度与MDA-MB-231细胞存活率的关系Fig.2 Effect of AR-C17 on viability of MDA-MB-231 cells
2.2 AR-C17浓度对MDA-MB-231细胞胞内肿瘤增殖标志物Ki-67水平的影响
选取接近IC50的25 μmol/L AR-C17处理细胞24 h,实验结果如图3。图3表明,与空白组相比,25 μmol/L的AR-C17能够显著抑制MDA-MB-231细胞胞内Ki-67蛋白的表达水平,抑制率达41.27%(P<0.05),说明AR-C17能够有效降低MDA-MB-231细胞内Ki-67的表达水平。Ki-67与肿瘤细胞增殖紧密相关,是肿瘤诊断及预后中广泛应用的一个指征肿瘤增殖活力的指标[14-15]。本实验中,AR-C17组与空白组比较,Ki-67的胞内含量显著降低(P<0.05),结合细胞存活率说明,AR-C17对MDA-MB-231细胞具备抑制增殖的能力。

*:P<0.05,与空白组相比,差异显著;胞内Ki-67相对表达量表示为相对于空白组的倍数。图3 AR-C17浓度与MDA-MB-231细胞胞内Ki-67表达水平的关系Fig.3 Effect of AR-C17 on relative expression of intracellular Ki-67 of MDA-MB-231 cells
2.3 AR-C17浓度对MDA-MB-231细胞ROS生成的影响
为研究AR-C17浓度对细胞ROS的影响,以不同剂量AR-C17(0、10、25、40 μmol/L)处理细胞24 h,并利用DCF-DA 荧光探针探究MDA-MB-231细胞ROS水平的变化,实验结果如图4。图4表明,与空白组相比,不同浓度的AR-C17均能够显著促进MDA-MB-231细胞生成胞内ROS,并呈剂量依赖关系;当AR-C17浓度为10、25、40 μmol/L时,胞内ROS含量显著升高,相对ROS 含量分别为空白组的4.04、4.19和7.70倍(P<0.05),说明AR-C17能够显著提高MDA-MB-231细胞胞内ROS水平。

不同小写字母表示差异显著(P<0.05),相对ROS含量表示为相对于空白组的倍数。图4 AR-C17与MDA-MB-231细胞ROS生成量的关系Fig.4 Effect of AR-C17 on ROS generation in MDA-MB-231 cells
2.4 AR-C17浓度对MDA-MB-231细胞线粒体膜电位的影响
线粒体膜电位下降反映线粒体功能障碍,是指征细胞早期凋亡活动的重要指标。利用JC-1荧光探针研究MDA-MB-231细胞线粒体膜电位的变化,将25 μmol/L AR-C17处理细胞12 h,实验结果见图5。在正常生理状态下,JC-1探针在线粒体基质内以聚集体形式存在,发红色荧光(PI通道);当线粒体膜破裂,膜电位下降,JC-1会解聚成单体进入胞质当中,发绿色荧光(FITC通道)。由图5可知,与空白组相比,25 μmol/L AR-C17能够使红色荧光减弱,绿色荧光增强,JC-1单体细胞比例上升15.9%(P<0.05),说明AR-C17能够降低MDA-MB-231细胞的线粒体膜电位。
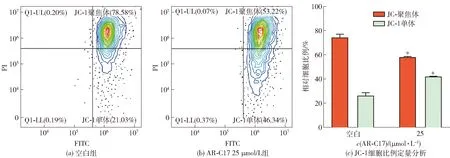
*:P<0.05,与空白组相比,差异显著。图5 25 μmol/L AR-C17对MDA-MB-231细胞膜电位的影响Fig.5 Effect of AR-C17 on relative ratio of JC-1aggregate/JC-1 monomer of MDA-MB-231 cells
2.5 AR-C17浓度对MDA-MB-231细胞凋亡的影响
为进一步探究AR-C17对人乳腺癌MDA-MB-231细胞凋亡的影响,本研究采用Annexin-V-FITC/PI双染法进行研究。以不同剂量的AR-C17(0、10、25、40 μmol/L)处理细胞24 h,实验结果如图6。由图6可知,随着AR-C17浓度的升高,早凋和晚凋的细胞比例逐渐增多。与空白组相比,当AR-C17浓度为10、25、40 μmol/L时,凋亡率分别提高7.87%,19.72%和34.13%(P<0.05)。结果表明,AR-C17能够促进MDA-MB-231细胞发生凋亡,且呈剂量依赖性。细胞凋亡是一系列基因调控的高度程序化的主动死亡过程[16],活性氧ROS的过量生成是激活凋亡的重要步骤[17]。过量的ROS可以破坏线粒体膜完整性,造成线粒体通透性改变,线粒体膜电位下降,诱发凋亡下游活动。在本实验中,结合2.3和2.4中分析结果,与空白组相比较,AR-C17处理能够显著提高ROS含量(P<0.05),同时降低线粒体膜电位(P<0.05),显著增加凋亡细胞比例(P<0.05)。结果提示,AR-C17能够刺激MDA-MB-231细胞产生ROS,通过改变线粒体膜通透性来促进下游细胞凋亡活动。

不同小写字母表示差异显著(P<0.05)。图6 AR-C17对MDA-MB-231细胞凋亡的影响Fig.6 Effect of AR-C17 on apoptosis of MDA-MB-231 cells
2.6 AR-C17浓度对MDA-MB-231细胞胞内活性Caspase含量的影响
活性Caspase含量的上升可以指征细胞凋亡发生。将25 μmol/L AR-C17处理细胞24 h,并用流式细胞术检测AR-C17对细胞活性Caspase含量的影响,实验结果如图7。图7表明,与空白组相比,AR-C17处理组的平均荧光强度是空白组的1.42倍(P<0.05),说明25 μmol/L AR-C17能够显著提高MDA-MB-231细胞活性Caspase的含量。Caspase蛋白是凋亡活动重要参与者。在促凋亡信号的刺激下,线粒体启动凋亡,胞浆中的细胞色素C与凋亡相关因子结合形成凋亡小体,进一步引发Caspase的级联反应,执行细胞凋亡[18]。在本实验中,与空白组相比,AR-C17组活性Caspase含量显著上升(P<0.05),说明AR-C17能够刺激活性Caspase的产生,促进细胞凋亡的执行。
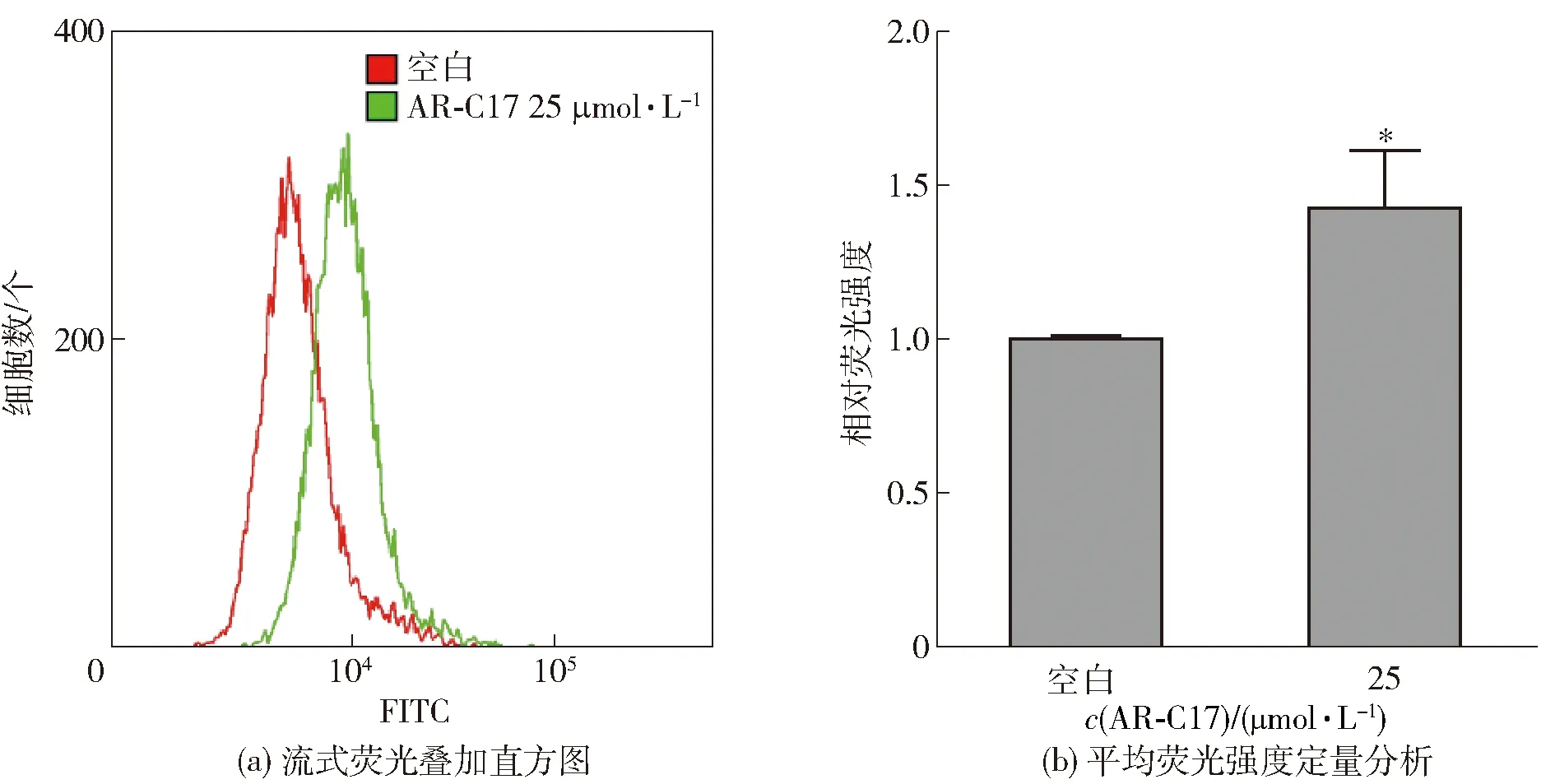
*:P<0.05,与空白组相比,差异显著;相对荧光强度结果表示为相对于空白组的倍数。图7 25 μmol/L AR-C17对MDA-MB-231细胞活性Caspase含量的影响Fig.7 Effect of 25 μmol/L AR-C17 on actived Caspase in MDA-MB-231 cells
2.7 AR-C17浓度对MDA-MB-231细胞自噬小体生成的影响
为了解AR-C17对MDA-MB-231细胞自噬体的影响,将不同剂量AR-C17(0、10、25、40 μmol/L)及阳性对照Rapa处理细胞16 h,并采用流式细胞术检测不同处理对细胞自噬体生成的影响,实验结果见图8。图8显示,Rapa 和AR-C17(浓度10、25、40 μmol/L)的相对荧光强度分别为空白组的1.96、3.39、3.61、4.45倍(P<0.05)。结果表明,AR-C17能够诱导MDA-MB-231细胞产生自噬体,其效果较自噬阳性对照更为显著。

不同小写字母表示差异显著(P<0.05),Rapa为阳性对照,相对荧光强度表示自噬小体含量相对于空白组的倍数。图8 AR-C17对MDA-MB-231细胞自噬体含量的影响Fig.8 Effect of AR-C17 on autophagosome formation in MDA-MB-231 cells
2.8 AR-C17浓度对MDA-MB-231细胞凋亡和自噬相关蛋白的影响
为探究AR-C17对MDA-MB-231细胞凋亡、自噬蛋白表达的影响,将不同剂量AR-C17(0、10、25、40 μmol/L)作用细胞24 h,并采用Western blot法检测AR-C17对蛋白表达的影响,实验结果如图9。图9表明,与空白组相比,随着AR-C17浓度的升高,MDA-MB-231细胞Bax/Bcl-2蛋白表达比值逐渐增高,当AR-C17浓度为10、25、40 μmol/L时,Bax/Bcl-2表达比值分别为空白组的1.63、1.99和5.18倍(P<0.05)。此外,与空白组相比,随着AR-C17浓度的升高,MDA-MB-231细胞自噬关键蛋白 LC3-Ⅱ表达比值逐渐增高。当AR-C17浓度为10、25、40 μmol/L时,LC3-Ⅱ表达量分别为空白组的1.38、1.75和2.91倍(P<0.05)。LC3-Ⅰ转化为LC3-Ⅱ是细胞自噬中的重要步骤,因此LC3-Ⅱ的上调可以作为细胞自噬活动的标志[19]。结果表明,AR-C17能够上调MDA-MB-231细胞中Bax/Bcl-2蛋白表达比值及LC3-Ⅱ蛋白相对表达量,且呈剂量依赖性。

不同小写字母表示差异显著(P<0.05)。图9 AR-C17浓度对MDA-MB-231细胞蛋白表达的影响Fig.9 Effect of AR-C17 on protein expressions in MDA-MB-231 cells
Bcl-2蛋白在细胞凋亡过程中扮演重要角色。Bax是Bcl-2家族中具有代表性的促凋亡蛋白,而Bcl-2则是抗凋亡蛋白。二者的相对表达量在凋亡活动中往往决定了细胞存活的方向[20]。在本实验中,较空白组,AR-C17处理Bax蛋白表达水平上升,同时Bcl-2蛋白表达水平下降,Bax/Bcl-2比值上升,提示AR-C17通过增强Bax蛋白表达,减弱Bcl-2蛋白表达,来促进MDA-MB-231细胞的凋亡过程。
自噬是广泛存在于真核生物中的一种由溶酶体介导的细胞自我降解机制,通过细胞内外部的协调和自我消解来对抗不良扰动从而保持细胞稳态[21-22]。自噬在调节肿瘤细胞的存活和死亡方面起着双重作用[21,23-24]:一方面,自噬降解受损或功能失调的细胞成分,使细胞群体达到生存目的;另一方面,过度自噬可直接导致自噬性细胞死亡,发挥抗肿瘤作用[24]。有证据表明,许多癌细胞中的自噬可能会提高化疗药物效果[25]。在本实验中,结合2.7中结果,与空白组比较,AR-C17处理能够使胞内自噬体含量显著增加(P<0.05),自噬特征蛋白LC3-Ⅱ表达增强,二者结果提示,AR-C17能够诱导MDA-MB-231细胞发生自噬。
2.9 AR-C17协同凋亡自噬抑制剂对MDA-MB-231细胞存活率的影响
为进一步探讨AR-C17作用下凋亡和自噬对MDA-MB-231细胞的作用,实验分为空白对照、凋亡抑制剂Z-VAD-FMK、自噬抑制剂CQ、AR-C17协同Z-VAD-FMK、AR-C17协同CQ及AR-C17组,分别处理细胞48 h,并用CCK-8法研究不同处理方式对MDA-MB-231细胞活性的影响,实验结果见图10。图10显示,凋亡抑制剂Z-VAD-FMK与AR-C17共同作用能够缓解对MDA-MB-231细胞存活的抑制作用,与25 μmol/L AR-C17组相比,细胞存活率提高约9.95%(P<0.05);而自噬抑制剂CQ与AR-C17共同作用则进一步加剧对MDA-MB-231细胞存活的抑制作用,与25 μmol/L AR-C17组相比,细胞存活率进一步降低22.4% (P<0.05),同时CQ单独作用于细胞时,对细胞存活率没有显著影响(P>0.05)。结果说明,凋亡抑制剂Z-VAD-FMK协同AR-C17能够缓解对MDA-MB-231细胞的增殖抑制作用,自噬抑制剂CQ协同AR-C17会进一步加剧对MDA-MB-231细胞的增殖抑制作用。
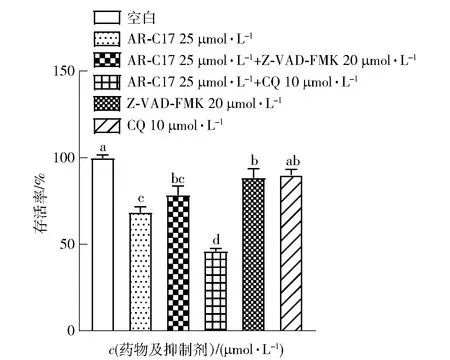
不同小写字母表示差异显著(P<0.05)。图10 AR-C17协同不同抑制剂对MDA-MB-231细胞存活率的影响Fig.10 Effect of AR-C17 and/or chloroquine or Z-VAD-FMK on cell viability of MDA-MB-231 cells
2.10 AR-C17协同CQ对MDA-MB-231细胞凋亡的影响
为进一步探讨抑制自噬对MDA-MB-231细胞凋亡的影响,实验分为空白对照、CQ、AR-C17协同CQ及AR-C17,分别作用细胞24 h,并采用Annexin-V-FITC/PI双染法研究不同处理对MDA-MB-231细胞凋亡的影响,实验结果见图11。图11显示,与空白组相比,AR-C17组与CQ+AR-C17组细胞凋亡率分别提高16.90%和60.62%(P<0.05),CQ+AR-C17组的细胞凋亡率又显著高于AR-C17组(P<0.05)。结果表明,与AR-C17单独作用相比,CQ协同AR-C17能够显著增加MDA-MB-231细胞的凋亡率。

不同小写字母表示差异显著(P<0.05)。图11 AR-C17协同自噬抑制剂对MDA-MB-231细胞凋亡的影响Fig.11 Effect of AR-C17 and/or chloroquine on apoptosis of MDA-MB-231 cells
2.11 AR-C17协同CQ对MDA-MB-231细胞胞内活性Caspase含量的影响
为进一步探讨抑制自噬对MDA-MB-231细胞内活性Caspase的影响,实验分为空白对照、CQ、AR-C17协同CQ及AR-C17分别作用细胞24 h,并采用流式细胞术研究不同处理对MDA-MB-231细胞活性Caspase的影响,实验结果见图12。图12显示,AR-C17组和CQ+AR-C17组的平均荧光强度分别为空白组的13.36倍和16.12倍,能够显著增加细胞活性Caspase含量(P<0.05),其中CQ+AR-C17的细胞凋亡比例又显著高于AR-C17组别(P<0.05)。结果表明,与AR-C17单独作用相比,CQ协同AR-C17能够显著增加MDA-MB-231细胞的活性Caspase含量。

不同小写字母表示差异显著(P<0.05),相对荧光强度表示为相对于空白组的倍数。图12 AR-C17协同自噬抑制剂对MDA-MB-231细胞胞内活性Caspase含量的影响Fig.12 Effect of AR-C17 and/or chloroquine on actived Caspase in MDA-MB-231 cells
细胞的凋亡和自噬是相互关联的,两者之间调节都会影响肿瘤细胞的命运[26]。当予以外界干预,两个过程可以同时被激发,既有可能发挥协同调节的作用,也有可能相反,表现出拮抗的效果[27-29]。在某些情况下,自噬能够作为细胞抵抗化疗的生存策略[30];而在其他情况下,自噬则会显示出抗肿瘤潜力[31]。有研究表明,抑制自噬可以增加细胞凋亡,从而增强抗肿瘤活性[32-33]。结合2.9和2.10中的结果,与单独使用AR-C17组相比,自噬抑制剂CQ与AR-C17共同作用可以加剧细胞死亡,降低细胞存活率(P<0.05),显著上调凋亡细胞比例(P<0.05)和活性Caspase的含量(P<0.05)。结果提示,抑制自噬能够进一步促进AR-C17诱导的MDA-MB-231细胞凋亡,AR-C17与自噬抑制剂联用或可成为一种有效地提高化疗药物敏感性的方法,其作用机制尚需进一步研究和验证。
3 结 论
本研究从细胞增殖、凋亡、自噬及凋亡与自噬的相互关系几方面探讨了AR-C17对人乳腺癌MDA-MB-231细胞的影响。研究表明,AR-C17可降低MDA-MB-231细胞的存活率,半数致死量浓度可显著抑制胞内Ki-67的表达量,说明AR-C17可有效抑制MDA-MB-231的增殖活力;AR-C17可刺激ROS过量生成,引起线粒体膜电位下降,提高凋亡细胞比例,上调Bax/Bcl-2表达比例,提高活性Caspase含量,说明AR-C17可诱导MDA-MB-231细胞发生凋亡;AR-C17亦可刺激胞内自噬体的生成并显著上调LC3-Ⅱ的表达,说明AR-C17可诱导MDA-MB-231细胞发生自噬。研究发现,抑制自噬可以进一步降低细胞存活率,加剧细胞凋亡并进一步上调活性Caspase生成量,说明自噬抑制剂协同AR-C17可以加剧对MDA-MB-231细胞的凋亡作用。本研究旨在为深入研究AR-C17抗肿瘤的分子机制提供细胞水平的实验依据,并为将AR-C17及麦麸作为功能性营养添加剂在乳腺癌防治中的应用奠定理论基础。乳腺癌肿瘤的发生发展机制十分复杂,需要继续进行体内实验,对AR-C17的抗肿瘤作用进行验证和更深入的研究。
