双酶提取蒲公英根多糖工艺优化及其抗氧化性研究
2019-12-23刘珊珊刘亚琼
刘珊珊,刘亚琼,张 琦,路 瑶
(河北农业大学 食品科技学院,河北 保定 071001)
蒲公英(TaraxacummongolicumHand.-Mazz.),菊科,为多年生草本植物,种类繁多,营养价值和药用价值高,资源丰富。蒲公英的叶、花、根均可食用,用于制作沙拉、保健茶、酿酒及咖啡替代品等[1],2012年被国家卫生部列入《既是食品又是药品的物品名单》。
蒲公英根含有多糖、黄酮、4-羟基苯乙酸肌醇酯(PIS)等多种生理活性成分[2-3],具有抗氧化[4]、抗癌[5]、抗炎[6]等多重有益生理作用。蒲公英根多糖含量丰富,目前多糖提取常用的方法有:传统热水浸提法、超声辅助提取法、酶提取法等[7-8]。酶解法不仅能提高多糖得率,还有助于保持多糖的活性,因而受到广泛关注。已有报道采用木瓜蛋白酶对蒲公英进行酶解,多糖得率为3.08%,优于传统的热水提取;亦有使用纤维素酶提取蒲公英多糖,得率达20.67%[9-10]。上述研究均为单酶法提取多糖,有研究显示,复合酶提取法能有效提高多糖提取率[11],但将该方法应用在蒲公英根多糖的提取尚未见报道。
本研究拟以烘焙后的蒲公英根粉为原料,采用木瓜蛋白酶- 纤维素酶双酶协同提取蒲公英根多糖,并通过响应面试验对蒲公英根粉酶解工艺参数进行优化,以期为蒲公英根多糖提取提供新的思路,促进蒲公英产业发展。
1 材料与方法
1.1 材料与试剂
蒲公英根粉(80目),试验室自制;纤维素酶(400 U/mg),北京奥博星生物技术有限责任公司;木瓜蛋白酶(50万U/g),上海源叶生物科技有限公司;重蒸酚、1,1-二苯基-2-三硝基苯肼(DPPH),北京索莱宝科技有限公司;无水乙醇、浓硫酸均为分析纯。
1.2 仪器与设备
AR423CN型电子天平,奥豪斯仪器(上海)有限公司;H.SWX- 600BS型电热恒温水温箱,金坛市朗博仪器制造有限公司;C20- SH2040型美的多功能电磁炉,美的集团股份有限公司(广东);PAL- α型手持糖度计,ATAGO(爱拓)中国分公司;UV2200型紫外可见分光光度计,上海舜宇恒平科学仪器有限公司。
1.3 实验方法
1.3.1酶解工艺实验
酶解工艺流程:取1.00 g蒲公英根粉,加定量水,加酶水浴酶解,沸水浴灭酶5 min,流水快速冷却至室温,用300目滤布过滤得酶解液。
蒲公英根粉制备:蒲公英根粉碎过80目检验筛,120 ℃烘焙35 min,每10 min翻动一次,防止焦煳。酶液配制:木瓜蛋白酶液酶活200 U/mL,纤维素酶液酶活200 U/mL,4 ℃保存待用。
1.3.2单因素实验
1.3.2.1 单酶酶解实验
按1.3.1实验操作,分别进行纤维素酶、木瓜蛋白酶酶解实验,设料水比(g∶mL)为1∶10、1∶20、1∶30、1∶40、1∶50 (酶添加量1.0 mL,60 ℃ 酶解1.5 h),酶解温度为30、40、50、60、70 ℃(料水比为1∶30,酶添加量1.0 mL,酶解1.5 h),酶液添加量分别为0、0.5、1.0、2.0、3.0、4.0 mL(料水比为1∶30,木瓜蛋白酶处理组50 ℃酶解1.5 h,纤维素酶处理组60 ℃酶解1.5 h),测定酶解液多糖得率、可溶性固形物含量和DPPH自由基清除率,确定适宜的料水比、酶解温度和酶液添加量。
1.3.2.2 双酶协同作用与酶解效果实验
按1.3.1实验操作,料水比为1∶30,加入纤维素酶液1 mL,设木瓜蛋白酶液添加量为0、1、2、3、4 mL(50 ℃酶解1.5 h),酶解温度设置为50、55、60 ℃(木瓜蛋白酶液2 mL,酶解1.5 h),酶解时间为0.5、1.0、1.5、2.0、2.5、3.0 h(木瓜蛋白酶液2 mL,酶解温度55 ℃)。测定酶解液多糖得率、可溶性固形物含量和DPPH自由基清除率,确定适宜的酶添加量、酶解温度和酶解时间。
1.3.3响应面试验设计
根据单因素实验结果,利用双酶协同提取蒲公英根多糖,选取酶添加量、酶解温度、酶解时间为实验因素,以多糖含量为响应值,通过Design Expert 8.05软件设计三因素三水平Box-Behnken响应面试验,试验方案如表1。通过二次多元回归方程拟合,得到各实验因素与响应值之间函数关系的回归方程,根据响应面图确定适宜的酶解工艺条件。
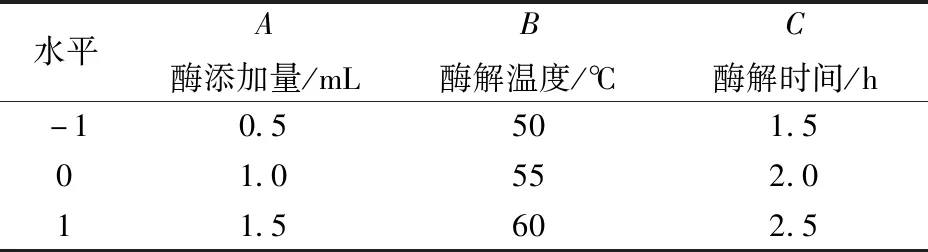
表1 响应面设计中的自变量及其水平Tab.1 Independent variables and their levels in response surface design
1.4 理化指标测定
1.4.1可溶性固形物含量测定
使用手持糖度计测量溶液的可溶性固形物含量。
1.4.2多糖含量测定
采用硫酸- 苯酚法测定多糖含量[9]。
葡萄糖标准曲线的绘制:以光密度为纵坐标,葡萄糖的含量为横坐标,绘制标准曲线。按式(1)计算多糖得率。
(1)
式(1)中:Y为多糖的得率,%;C为多糖的质量浓度,μg/mL;N为稀释的倍数;V为酶解液体积,mL;m为蒲公英根粉质量,g。
1.4.3DPPH自由基清除率的测定
参照文献[12],将酶解液适当稀释,各处理组常温避光反应30 min,525 nm下测定吸光度,按式(2)计算清除率。
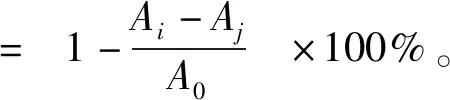
(2)
式(2)中:A0为2 mL无水乙醇+2 mL DPPH溶液的吸光度;Ai为2 mL待测液+2 mL DPPH溶液的吸光度;Aj为2 mL待测液+2 mL无水乙醇的吸光度。
1.5 数据统计方法
采用SPSS 22.0软件分析实验结果,差异显著水平为0.05;使用Design-Expert 8.05软件分析响应面结果;使用Origin 9.0软件绘图。
2 结果与分析
2.1 葡萄糖标准曲线分析
葡萄糖标准曲线回归方程为:
y=0.545 83x+0.041 72,R2=0.994 0,该曲线线性良好(图1),可用于计算多糖含量。
2.2 单因素实验结果分析
2.2.1料水比对酶解效果的影响
料水比对蒲公英根粉酶解效果的影响实验结果见图2。由图2可知:随着料水比的增加,木瓜蛋白酶和纤维素酶多糖得率均呈先上升后平缓趋势,木瓜蛋白酶的酶解效果优于纤维素酶;可溶性固形物含量和DPPH自由基清除率逐渐降低。当料水比较低时,底物分散程度差,不利于酶和底物充分接触,料水比增加到一定程度后,酶促反应处于动态平衡,得率趋于平稳,而可溶性固形物被稀释,DPPH自由基的清除能力不断降低。由实验结果可知,适宜的料水比为1∶30。
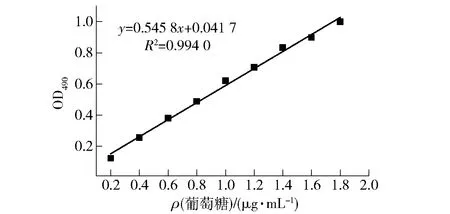
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
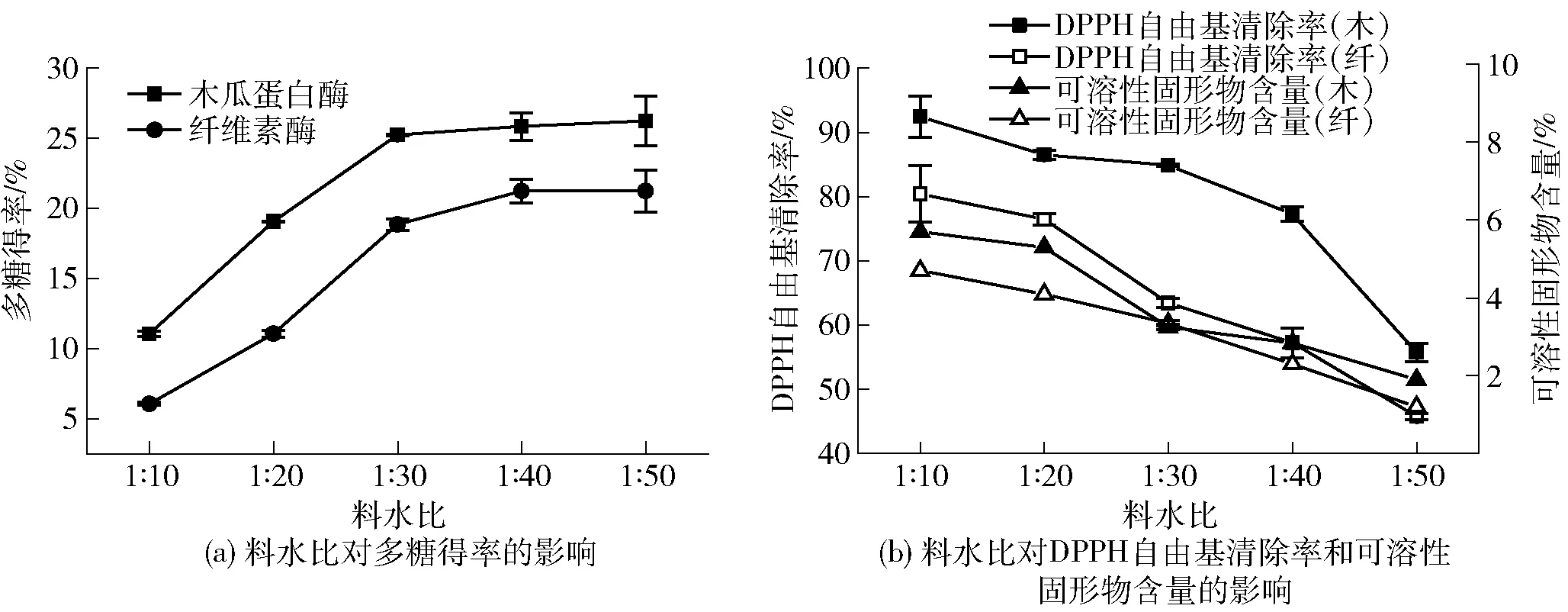
图2 料水比对蒲公英根多糖酶解效果的影响Fig.2 Effects of solid-liquid ratio on enzymatic hydrolysis of dandelion root polysaccharide
2.2.2酶解温度对酶解效果的影响

图3 酶解温度对蒲公英根多糖酶解效果的影响Fig.3 Effects of temperature on enzymatic hydrolysis of dandelion root polysaccharide
酶解温度对蒲公英根酶解效果的影响见图3。由图3可知:随着酶解温度的升高,多糖得率、DPPH自由基清除率均呈先上升后下降的趋势;木瓜蛋白酶在50 ℃时出现峰值,纤维素酶在60 ℃时出现峰值;纤维素酶处理组的可溶性固形物含量随酶解温度升高而增加,木瓜蛋白酶处理组则呈先上升后下降趋势。随着温度升高,酶活性增加,木瓜蛋白酶水解细胞壁上的糖蛋白,解除糖蛋白对多糖的束缚;纤维素酶作用于植物细胞壁上的纤维素,促进蒲公英根多糖的释放,进而多糖得率升高;当温度超过酶最适作用温度,酶解作用降低,导致多糖得率下降,DPPH自由基清除率与多糖含量相关,趋势同步。由实验结果可知,木瓜蛋白酶酶解的适宜温度为50 ℃,纤维素酶酶解的适宜温度为60 ℃。
2.2.3酶添加量对酶解效果的影响
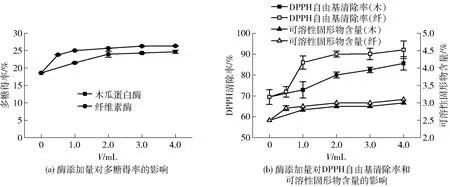
图4 酶添加量对蒲公英根多糖酶解效果的影响Fig.4 Effects of enzyme addition on enzymatic hydrolysis of dandelion root polysaccharide
酶添加量对蒲公英根酶解效果的影响见图4。由图4可知:随着酶添加量的增加,多糖得率、DPPH自由基清除率和可溶性固形物含量均呈上升趋势。木瓜蛋白酶在添加量为0~2.0 mL,纤维素酶添加量为0~1.0 mL时,多糖得率明显升高,DPPH自由基清除率同步变化。继续增加酶量,多糖得率变化不大,这是因为随着酶添加量的增加,底物与酶接触机会增多,多糖能够更多地分离出来。当酶量达到一定量后,酶解反应趋于稳定,继续增加酶用量也很难明显提高多糖得率。由实验结果可知,木瓜蛋白酶的适宜添加量为2.0 mL,纤维素酶的适宜添加量为1.0 mL。
2.2.4双酶协同作用对酶解效果的影响
2.2.4.1 酶添加量对双酶酶解效果的影响
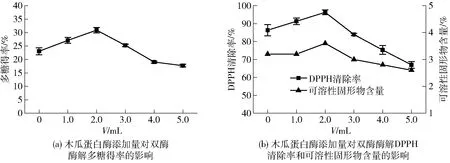
图5 酶添加量对蒲公英根多糖双酶协同酶解效果的影响Fig.5 Effects of enzyme addition on synergistic enzymatic hydrolysis of dandelion root polysaccharide
酶添加量对蒲公英根双酶酶解效果的影响见图5。由图5可知:在纤维素酶悬液添加量为1.0 mL时,随着木瓜蛋白酶悬液添加量的增加,多糖得率、DPPH自由基清除率和可溶性固形物含量均呈先上升后下降的趋势。木瓜蛋白酶添加量为2.0 mL时出现峰值,可能是因为在木瓜蛋白酶悬液添加量达到饱和之前,两者表现为增效作用,而当添加量过高时出现反馈抑制。由实验结果可知,木瓜蛋白酶悬液的适宜添加量为2.0 mL。
2.2.4.2 酶解温度对双酶酶解效果的影响
酶解温度对蒲公英根双酶酶解效果的影响见图6。由图6可知:随着酶解温度的增加,多糖得率、DPPH自由基清除率和可溶性固形物含量均呈现先上升后下降的趋势,且均在55 ℃时出现峰值。故双酶协同适宜的酶解温度为55 ℃。
2.2.4.3 酶解时间对双酶酶解效果的影响
酶解时间对蒲公英根双酶酶解效果的影响见图7。由图7可知:随着酶解时间的增加,多糖得率、DPPH自由基清除率均呈先上升后下降趋势,在2.0 h时出现峰值;可溶性固形物含量呈缓慢上升趋势。延长酶解时间有助于酶与底物充分结合,促进多糖溶出;但酶解时间过长可能会导致活性物质抗氧化能力减弱,生产周期变长、生产成本增加。由实验结果可知,适宜酶解时间为2.0 h。
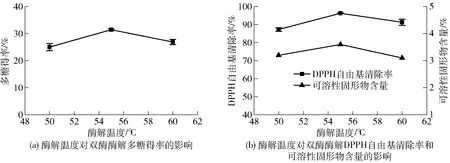
图6 酶解温度对蒲公英根多糖双酶协同酶解效果的影响Fig.6 Effects of hydrolysis temperature on synergistic enzymatic hydrolysis of dandelion root polysaccharide
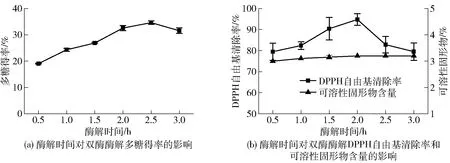
图7 酶解时间对蒲公英根多糖双酶协同酶解效果的影响Fig.7 Effects of hydrolysis time on synergistic enzymatic hydrolysis of dandelion root polysaccharide
2.3 Box-Behnken响应面试验结果
Box-Behnken响应面试验结果见表2,方差分析结果如表3。多糖得率为22.10%~33.34%,蒲公英根多糖得率(Y1)对酶解温度(A)、酶解时间(B)和酶添加量(C)的二次多项回归方程,见式(3)。
Y1=32.9-0.59A-0.60B-0.54C+0.34AB-0.93AC-0.47BC-6.7A2-1.73B2-1.67C2。
(3)
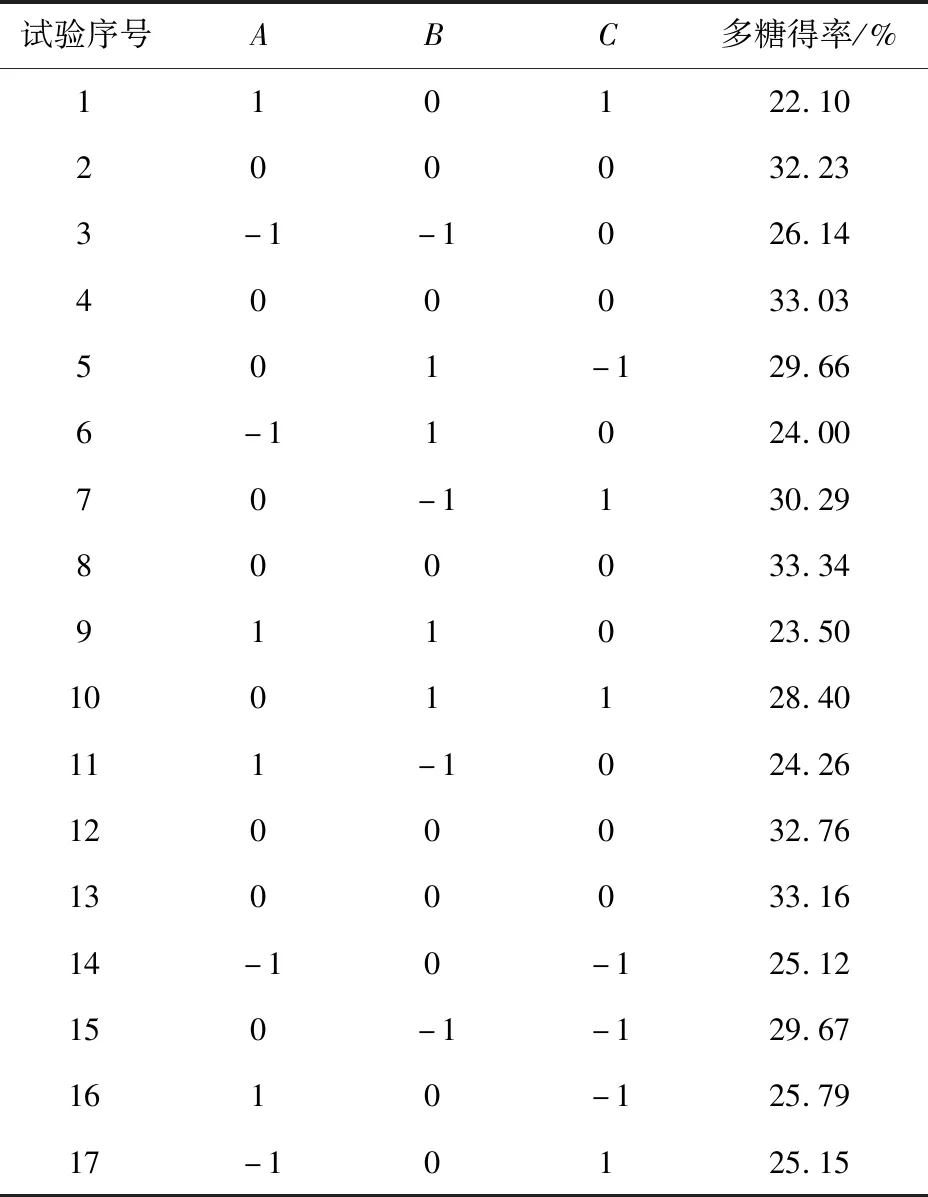
表2 Box-Behnken试验设计与结果Tab.2 Experimental results of Box-Behnken experiment
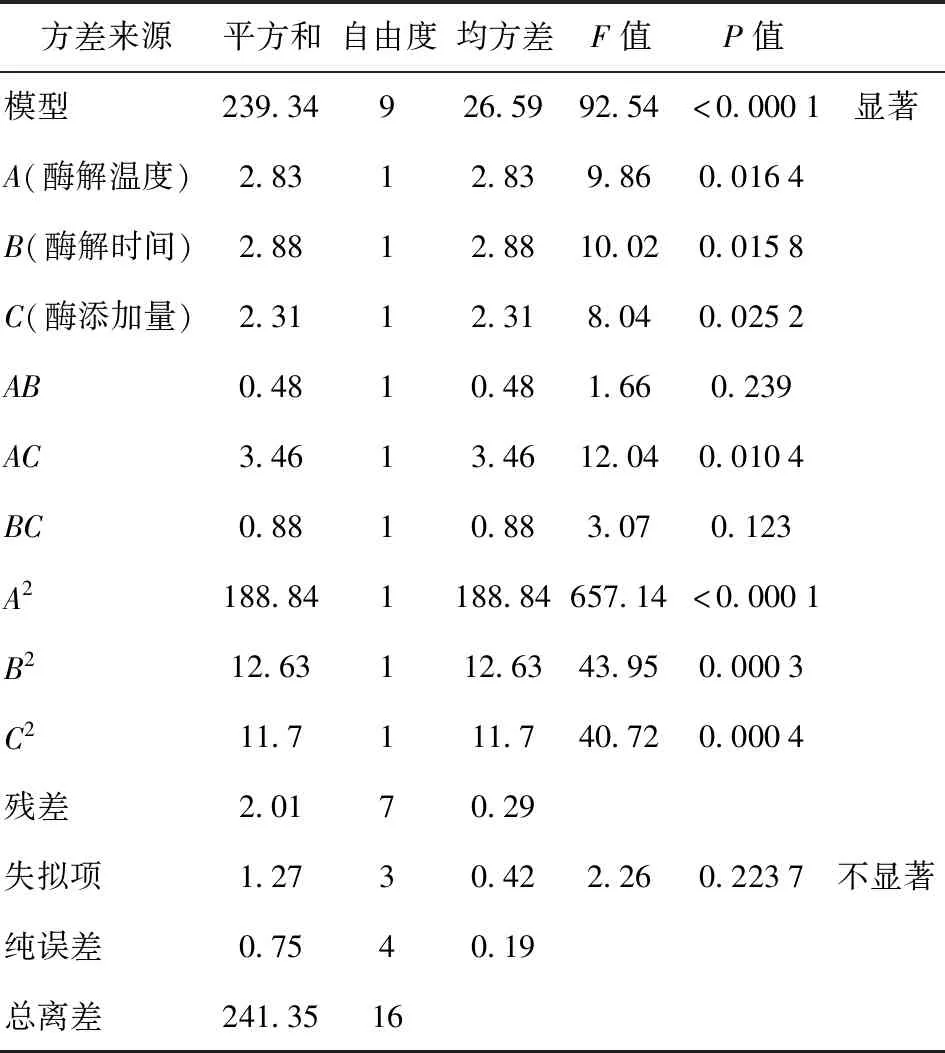
表3 回归模型方差分析Tab.3 Variance analysis of regression model
方差分析结果表明,建立的模型具有很高的显著性(P<0.000 1,F=92.54),模型的失拟项P值为0.223 7,大于0.05,失拟项检验不显著,说明模型适当。可以看出,影响多糖得率的因素按照由大到小顺序依次为:酶解时间(B)、酶解温度(A)、酶添加量(C)。在所选各因素水平范围内,A、B、C、A2、B2、C2、AC对Y的影响显著(P<0.05),因此,交互项和二次项对响应值也有较大的影响。
响应面模型可靠性分析见表4,试验模型拟合度为0.991 7,表示试验结果的预测值与实际值高度相关;校正决定系数为0.980 9,模型的精密度为25.360,变异系数为1.900,说明试验结果较可靠,建立的模型能够较好地描述多糖得率随酶解条件的变化规律,可用此模型对多糖得率进行分析和预测。
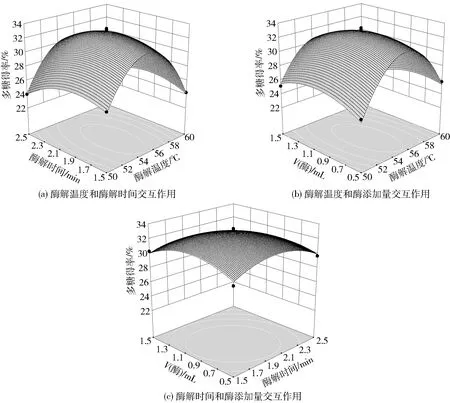
图8 各因素交互作用的响应面图Fig.8 Response surface diagram of interaction of various factors
由回归方程所做的响应面图如图8。由回归方程可知,二次项系数为负值,表明方程具有最大值。

表4 响应面模型可靠性分析Tab.4 Reliability analysis of response surface model
任何两个交互因素的响应面都存在最高点,酶解时间和酶解温度对多糖得率的影响较大,酶添加量对得率的影响较小。通过软件Design-Expert 8.05分析,适宜酶解条件:酶解温度为55.31 ℃,酶解时间为1.9 h,纤维素酶液添加量0.99 mL,木瓜蛋白酶液添加量1.98 mL,料水比1∶30,在此条件下多糖得率的预测值为32.89 mg/g,验证实验多糖得率为32.97 mg/g,与预测值的相对误差为0.08 mg/g,说明该响应面结果可靠。
蒲公英根粉处理前后多糖含量和DPPH自由基清除率情况如表5。由表5可知,蒲公英根经过烘焙后多糖含量升高至(18.74±0.58)mg/g,这可能是因为烘焙使原料水分降低、孔结构也发生了变化,有利于物质的提取[13]。有报道显示,高温会导致纤维素和半纤维素糖苷键断裂,生成大量脱水糖、酮类以及聚合度不同的糖类活性中间体[14],其详细的裂解机理仍有待进一步研究。采用双酶协同酶解后多糖得率为(32.97±0.13)mg/g,DPPH自由基清除率达92.31%±0.25%,酶解液抗氧化性显著提高。
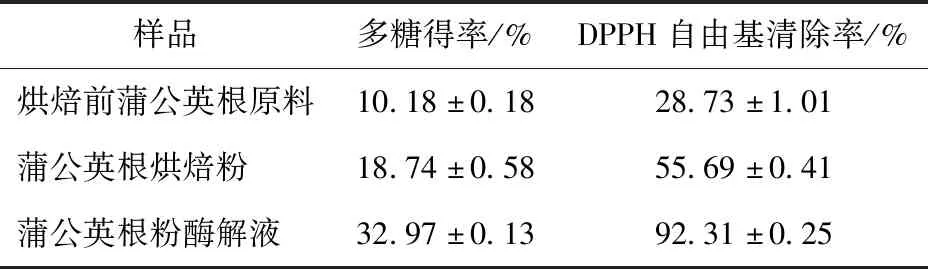
表5 酶解前后蒲公英多糖得率及DPPH自由基清除率Tab.5 Polysaccharide yield and DPPH free radical scavenging rate of dandelion polysaccharide before and after enzymatic hydrolysis
3 结 论
1)采用单酶法提取蒲公英根多糖的适宜条件为:料水比(g∶mL)1∶30 g/mL,纤维素酶酶解温度50 ℃,添加量1.0 mL;木瓜蛋白酶酶解温度60 ℃,添加量为2.0 mL。
2)纤维素酶和木瓜蛋白酶协同提取蒲公英根多糖提取率高于单酶法。采用Box-Behnken响应面试验建立了双酶协同提取蒲公英根多糖的二次多项式回归模型,影响多糖得率的工艺因素主次顺序为酶解时间、酶解温度、酶添加量。确定了适宜的酶解条件为:酶解温度55 ℃,酶解时间1.9 h,纤维素酶液添加量0.99 mL(200 U/mL),木瓜蛋白酶液添加量1.98 mL(200 U/mL),料水比(g ∶mL)1∶30。
烘焙和酶解工艺可提高蒲公英根多糖得率和DPPH自由基清除率,二者存在正相关关系。
