克氏综合征胎儿脐带间充质干细胞模型的建立
2019-12-23罗建安杨树法于秀义陈振文
罗建安 杨树法 于秀义 刘 欣 陈振文
(首都医科大学基础医学院医学遗传学与发育生物学学系,北京 100069)
克氏综合征,即Klinefelter综合征(Klinefelter’s syndrome, KS),是最常见的性染色体三体综合征。新生儿男婴发病率为1/450至1/600[1]。KS患者的临床表征为小睾丸、高促性腺激素性腺功能减退、乳房发育、学习困难。患者易患糖尿病、心血管、呼吸道和胃肠道疾病,常常导致较高的病死率[2-3]。患有KS的个体在婴儿期、儿童期或成年期均患有医疗和社会功能障碍,对个人、家庭和社会产生有害影响。由于伦理的原因,对KS综合征患者以及人体标本组织进行研究不易进行。目前缺乏足够有效的实验模型,因此KS综合征的分子致病机制仍未被深入了解。过去的几十年中,尽管通过诱导多能干细胞模型(induced pluripotent stem cells, iPSCs)一定程度上揭示了KS综合征异常发育机制[4],但由于iPSCs细胞模型的局限性,使有关KS的研究相对滞后,迫切需要建立一种更贴近疾病真实状况的KS综合征细胞模型。围产期来源的脐带结缔组织,即沃顿组织(Wharton’s jelly, WJ),具有快速增生、免疫调节能力强、 维持多系分化能力、基因组稳定、无致瘤性和遗传稳定性好等特点。沃顿组织来源的间充质干细胞(Klinefelter’s syndrome umbilical cord mesenchymal stem cells,KUMSCs)是多能细胞,可分化成骨细胞、软骨细胞、脂肪和肌原细胞以及神经元和神经胶质细胞[5-6]。由于Wharton细胞谱系的可塑性,使其成为发育生物学研究和再生医学研究的重要材料[7]。本研究中,笔者从具有47,XXY染色体核型的KS胎儿脐带中获取并建立了间充质干细胞系,鉴定了细胞模型的质量和体外成骨成脂分化的潜能。本研究所建立的Klinefelter综合征胎儿脐带间充质干细胞模型可成为研究围产期KS胎儿异常发育的理想细胞模型,为深入研究KS疾病的致病机理和药物研发提供了理想材料。
1 材料与方法
1.1 细胞的来源与培养
本研究经过首都医科大学医学伦理委员会批准(批准号:2017-KY-043-01),并获得捐献者的知情同意,从正常足月产及患有KS流产胎儿(采自首都医科大学附属北京妇产医院)的脐带中分离得到间充质干细胞。
1.2 主要仪器和试剂
PCR仪(美国BIO-RAD公司);PAC-30型电泳仪(美国BIO-RAD公司);凝胶成像仪(美国BIO-RAD公司);漩涡混合器(北京科尔德科贸有限公司)等。CO2恒温培养箱(美国ThermoFisher公司);低温离心机(Allegra X-15R)美国Beckman公司;支原体检测试剂盒(美国R&D公司);流式细胞仪(C6TM,美国BD公司);胎牛血清(fetal bovine serum ,FBS)、胰酶(美国Gibco公司);DPBS(美国Corning公司);秋水仙碱、Ⅱ型胶原酶(美国Sigma公司);D-MEM/F12、间充质干细胞培养基(友康生物公司)。
1.3 实验方法
1.3.1 间充质干细胞(mesenchymal stem cells, MSCs)的原代分离、纯化与扩增培养
将收集到的脐带组织置于无菌玻璃皿中,用DPBS反复冲洗3~4次,去除血渍和其他杂质,然后剪碎至1.0 mm3左右大小;加0.075%(质量分数)Ⅱ型胶原酶15 mL(具体视组织块大小),37 ℃水浴锅中振荡消化40 min,将消化好的组织混悬液置于无菌大玻璃皿中,清洗1~2次后,将消化过的脐带小组织块置于新的100 mL的有盖小玻璃瓶中,加入0.125%(质量分数)的胰酶15 mL,37 ℃水浴锅中振荡消化40 min后将组织消化混悬液过滤(70 μm尼龙筛网),收集细胞悬液于50 mL离心管中,200 g低温离心8 min。弃上清,向细胞沉淀中加入脐带间充质干细胞培养基(D-MEM/F-12∶FBS=10∶1)。取10 μL细胞混悬液和1.0 μL 0.4%(质量分数)的台盼蓝混合后进行细胞计数和细胞活率测定,具体传代瓶数视计数结果而定,传代至3~4代后冻存KUMSCs及二倍体脐带间充质干细胞(diploid umbilical cord mesenchymal stem cells,DUMSCs)细胞株(作为实验对照)。
1.3.2 细胞安全性评价
预先获取孕妇的病原体检测信息,保证合格后进行干细胞制备;在原代、分离和传代扩增培养后,获取细胞培养上清液检测细菌、真菌、支原体、病毒、梅毒螺旋体等病原体和内毒素,检测结果均为阴性,符合干细胞质量要求。
1.3.3 成骨细胞诱导分化
使用P2~P3代的细胞,将细胞按(1.5~3.0)×103个/cm2的接种密度接种到6孔板中,按2.0 mL/孔的量加入脐带间充质干细胞专用培养基(D-MEM/F-12∶FBS=10∶1),并标注对照孔和待诱导孔。细胞融合度达到85%以上时,根据六孔板标注加入对应的诱导分化液和间充质干细胞培养基。
1.3.4 成脂细胞诱导分化
使用P2~P3代的细胞,将细胞按(1.5~3.0)×103个/cm2的接种密度接种到6孔板中,按2.0 mL/孔的量加入脐带间充质干细胞专用培养基(D-MEM/F-12∶FBS=10∶1),并标注阴性对照孔和待诱导孔。待细胞融合度达到100%以上时,根据六孔板标注的加入对应的诱导分化液和间充质干细胞培养基。
1.3.5 G显带染色体核型分析
将处于分裂中期的细胞与100 ng/mL秋水仙碱一起培养50 min。将细胞用0.25%(质量分数)胰蛋白酶/0.05%(质量分数)EDTA消化成单细胞,用低渗溶液KCl(0.075 mol/L)处理,用固定液固定2~3次。用预先配好的Giemsa工作液,充分染色10 min后用自然流水轻轻润洗,观察染色体的形态和数量,并用染色体核型分析软件进行分析,保留图谱。
1.3.6 流式细胞术分析细胞免疫表型
细胞用DPBS重悬到细胞浓度为5.0×106个/mL,并保证细胞总量在≥5×105/管。加入抗体前,将细胞悬液用DPBS洗涤2次,并弃去细胞上清,留取细胞沉淀。取EP管,将待检细胞均分,并用DPBS洗涤2~3次,并在设置好对照管、检测管和同型对照管后,加入对应流式荧光抗体试剂,4 ℃环境下避光孵育30 min,每10 min轻轻弹散一次。孵育结束后用流式细胞仪进行检测和分析。
1.3.7 PCR扩增及产物电泳
为进一步证明建立的细胞模型具有多向分化潜能,利用RT-PCR及凝胶电泳方法测定成脂分化标志物过氧化物酶体增生剂激活受体γ(peroxisome proliferator-activated receptor γ, PPARγ)和成骨分化标记物骨桥蛋白(osteopontin, OSP)基因的表达。PCR扩增条件:95 ℃预变性5 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,26个循环,接72 ℃继续延伸7 min。PCR产物于4 ℃保存。使用18S作为内部对照。用于PCR的引物序列:(PPARγ:F3′-5′:CCAAGCTGCTCCAGAAAATG, R3′-5′:AGGAGCGGGTGAAGACTCAT; OSP:F3′-5′:CACCTGTGCCATACCAGTTAAAC, R3′-5′:ATCCATGTGGTCATGGCTTT″; 18S:F3′-5′:GTAACCCGTTGAACCCCATT, R3′-5′:CCATCCAATCGGTAGTAGCG)。称取琼脂糖2 g,加入到Tris-硼酸电泳缓冲液中,用微波炉加热约5~10 min,自然冷却至50 ℃左右,加入EB混匀,使EB终浓度为0.5 μg/mL,灌入插好梳子的凝胶槽中,约30 min后拔出梳子。将凝胶放入电泳槽中。吸取5 μL样品加入凝胶孔中。在凝胶样品中央或两侧加入5 μL的50 bp DNA Marker。电泳条件为120 V,35 min,将电泳后的琼脂糖凝胶放入凝胶成像系统采集图像并分析结果。
2 结果
2.1 建立细胞系均符合安全性评价标准
经对分离培养的脐带间充质干细胞进行乙型肝炎病毒、丙型肝炎病毒、人类免疫缺陷病毒、人巨细胞病毒、EB病毒、人嗜T细胞病毒和梅毒螺旋体的抗体和抗原以及细菌、真菌、支原体和内毒素检测,结果均为阴性,符合脐带间充质干细胞建系标准(表1)。

表1 病毒、螺旋体、细菌、真菌、支原体、内毒素检测Tab.1 Detection of viruses, bacteria, fungi, mycoplasma, endotoxin
2.2 KS胎儿脐带间充质干细胞中分离、形态学特征及核型分析鉴定
细胞经传代培养后长势良好,台盼蓝染色后,细胞活率都在98%以上,镜下观察符合干细胞形态特征。为了检测在脐带间充质干细胞传代过程中细胞的染色体稳定性,使用染色体核型分析技术检测培养≥10代的DUMSCs及KUMSCs,结果显示染色体核型分别为46,XY和47,XXY,说明该模型的遗传稳定性良好(图1)。

图1 KUMSCs和DUMSCs细胞模型构建示意图及核型分析Fig.1 Diagram for KUMSCs and DUMSCs cell model building and cytogenetic karyotyping
2.3 KUMSCs和DUMSCs细胞免疫表型具有间充质干细胞的特征
为确定所分离的胎儿脐带间充质干细胞是否具有干细胞特性,流式细胞分析技术显示脐带间充质干细胞的相关标志物CD105、CD90、CD73、CD44、 CD29呈阳性表达(均>98%),抗原标志物CD34、CD45、HLA-DR表达阴性(均<2%);DUMSCs和KUMSCs对间充质相关标志物CD105、 CD90、 CD73、 CD44、 CD29呈阳性(且均>98%);CD34、CD45、HLADR表达阴性(均<2%),说明DUMSCs和KUMSCs均符合脐带间充质干细胞免疫学表征。详见图2。
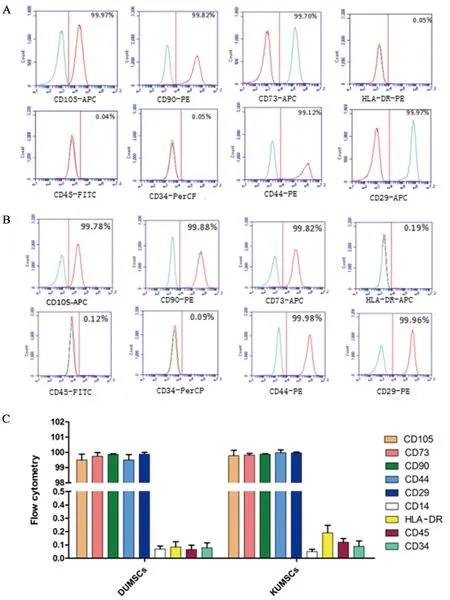
图2 DUMSCs和KUMSCs细胞免疫表型检测Fig.2 Immunophenotyping analyses of KUMSCs和DUMSCs cell lines
2.4 KUMSCs和DUMSCs细胞具有成骨、成脂的分化潜能
表征MSCs的黄金标准是分化成多个谱系的能力。本结果显示,PCR技术和琼脂糖凝胶电泳鉴定成脂分化基因PPARγ在诱导分化前后表达量差异有统计学意义(图3A); PCR技术和琼脂糖凝胶电泳鉴定成骨分化基因OSP在诱导分化前后表达量差异有统计学意义(图3B); 同时测定细胞的成骨分化潜能,在成骨分化培养基中诱导21 d后,通过茜素红染色指示骨矿化的该沉积物呈阳性反应(图3C);另外测定细胞的成脂分化潜能,在成脂分化培养基中诱导21 d后,通过组织化学染色技术观察到细胞中油红O脂滴的大量积累(图3D) 。
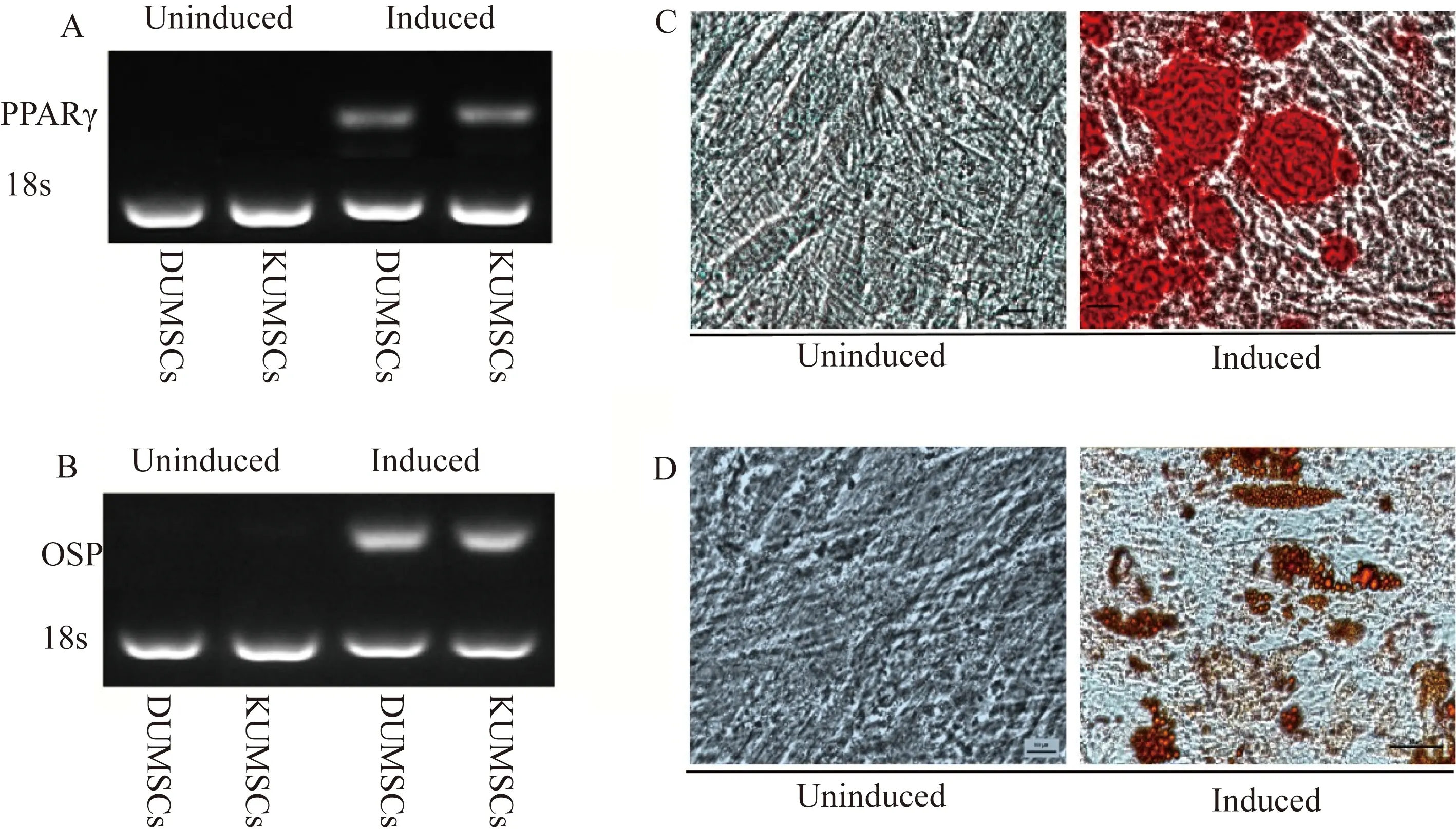
图3 KUMSCs和DUMSCs成骨、成脂分化潜能Fig.3 Osteogenic and adipogenic differentiation potential of KUMSCs and DUMSCs cell lines
3 讨论
Klinefelter综合征是人类中常见的性染色体异常。几乎所有的KS患者都表现出无精子症,且易患糖尿病,心血管疾病和癌症等疾病的风险增加,后代的染色体异常风险也会增加[8-9],更好地了解KS发病基础机制将有助于为患者提供新的治疗方案。本研究从KS胎儿脐带中成功分离并建立了间充质干细胞KUMSCs细胞模型,这可用于KS的致病机制研究。以往研究[4, 10]KS综合征常用的干细胞模型是胚胎干细胞(embryonic stem cells, ESCs)和人成体细胞诱导多能干细胞模型,例如源自成年人睾丸组织的iPSCs细胞模型。胚胎干细胞引起了伦理问题,而iPSCs是通过体细胞的直接重编程产生的,增加了iPSCs细胞的致瘤性和临床安全性的问题[11-13],尤其是c-myc 通过插入突变或破坏抑癌基因形成肿瘤[14]以及重编程引起的表观遗传记忆[15]。因此,在用于临床应用的ESC或iPSCs的过程中,需要采取关于安全性和功效的预防措施。
在早期MSCs临床前和临床试验中,移植的MSCs的安全性在动物模型和人体试验中得到了充分证明[16-17]。本课题组所建立的KS胎儿脐带间充质干细胞模型经流式细胞术和核型分析技术鉴定其没有发生染色体数目和结构的改变,具有遗传稳定性,但仍需进行进一步研究,以确保细胞模型的安全性。此外,对正常二倍体及KS胎儿来源的间充质干细胞进行相关质量控制检测,包括病原微生物学(细菌、真菌、支原体、病毒、螺旋体)、内毒素、细胞数、细胞活率等检测,结果表明所建立的细胞系DUMSCs和KUMSCs具有安全性。
细胞的纯度和状态直接影响细胞的鉴别和诱导分化的效果。从Wharotn’s jielly中分离间充质干细胞通常有两种分离方式:外植体方法和酶消化方法[18]。外植体方法的缺点是片段通常漂浮在培养基中。与外植体方法相比,酶消化方法可以提供更均质的细胞群和更一致的细胞数目。因此,本研究中先后使用酶消化法[0.075%(质量分数)的Ⅱ型胶原酶和0.125%(质量分数)的胰酶]进行实验,成功获得了理想的干细胞。本研究显示KUMSCs具有干细胞的典型特征,但在细胞形态上与DUMSCs的形态却有明显区别,主要是旋涡状生长趋势、细胞短梭形、细胞立体感、光泽度、分裂象方面存在一定差异。
流式细胞技术检测数据结果表明两种细胞模型在CD105、CD73、CD90、CD44、CD29均大于98%,而CD34、CD45、HLA-DR均小于2%,均符合干细胞免疫表型的要求[19-20]。但免疫表型的检测与细胞培养代数不同而表现出差异,为确保实验的准确性,笔者均选取大于P3代细胞纯度更高的细胞进行检测分析。
总之,本研究所建立的KS胎儿脐带间充质干细胞系为高质量多能干细胞,具有遗传稳定性和良好的分化潜能,可用于KS疾病的发病机制研究和药物开发实验。未来的研究,例如评估KUMSCs细胞模型的临床药物实验的研究,将进一步表征这些细胞在潜在治疗用途中的效用。
