抗体偶联药物抗CD30-MCC-DM1的制剂处方研究
2019-12-23张恒宾徐珺曹雪梅张一帆吴劲松杨彤沈毅珺
张恒宾,徐珺,曹雪梅,张一帆,吴劲松,杨彤,沈毅珺
论著
抗体偶联药物抗CD30-MCC-DM1的制剂处方研究
张恒宾,徐珺,曹雪梅,张一帆,吴劲松,杨彤,沈毅珺
筛选并确定新型抗体偶联药物抗 CD30-MCC-DM1(F0002-ADC)的制剂处方,解决该药溶解度偏低、冻干制剂含水量较高等问题,进而得到适用于该药物的制剂处方。
对缓冲盐、pH 值、蛋白保护剂以及助溶剂等条件或参数设计实验进行考察。
得到了蛋白浓度5 g/L、pH5.0、缓冲盐枸橼酸浓度10 mmol/L、蛋白保护剂蔗糖浓度6%(w/v)、表面活性剂聚山梨酯 20 浓度0.02%(w/v)以及助溶剂盐酸精氨酸浓度3%(w/v)的制剂处方,制得的冻干制剂含水量低于 3%。
该制剂配方能提高药物溶解度、降低冻干制剂含水量,并通过长期稳定性实验验证了该配方能满足 F0002-ADC 的临床需求。
抗体偶联药物; CD30; 制剂处方; 精氨酸盐酸盐
通过抗体偶联药物(antibody-drug conjugate,ADC),Paul Ehrlich 的魔弹理论正在变成现实[1]。典型的 ADC 是由连接子将单克隆抗体和细胞毒素偶联起来的复合物[2],同时具有抗体的靶向性和小分子化药的高效杀伤性,是免疫治疗和化疗的完美结合。ADC 通过静脉注射进入体内,在单克隆抗体的靶向作用下,运输至肿瘤细胞并被吞噬进入溶酶体,连接子在此被酶切或降解,最终释放细胞毒素杀伤肿瘤细胞[3]。
注射用重组人鼠嵌合抗 CD30 单克隆抗体-MCC-DM1 偶联剂(F0002-ADC)是上海复旦张江生物医药股份有限公司和上海交联药物研发有限公司共同开发的创新偶联药物新药,目前已进入临床阶段(临床申请号:NCT03894150)。
F0002-ADC 结构为:F0002 单抗、酶不可降解连接子 SMCC 以及高活性的微管蛋白抑制剂 DM1(图 1)。F0002-ADC 可特异性杀伤 CD30 阳性肿瘤细胞,并且由于其释放的小分子不具有“旁观者效应”,可避免对正常细胞的伤害[4]。

图1 F0002-ADC 结构示意图
Figure 1 General view of F0002-ADC
ADC 药物制剂处方的开发与传统抗体药物类似,但是抗体-小分子偶联的形式会引入新的质量属性[5],因此在制剂处方的选择过程中需要兼顾单克隆抗体与小分子两者的性质。首先,ADC 的主体框架为单克隆抗体,因此在制剂研究过程中需要考虑单抗的稳定性;其次,还要充分考虑到小分子药物对整个 ADC 理化性质的影响。例如,由于偶联的细胞毒素通常为强疏水性小分子[6],易导致 ADC 药物整体的可溶性降低,直接影响药物特性。
F0002-ADC 在工艺开发过程中就遭遇类似问题:F0002-ADC 样品在稍高浓度(> 5 mg/ml)即出现乳白色絮状不溶物,溶解性较差。为提高溶解性,最终选择添加助溶剂,并通过优化冻干工艺消除了助溶剂对冻干粉饼外形的影响。
F0002-ADC 药物的制剂处方研究主要分为三部分:制剂处方初筛、制剂处方优化以及长期稳定性评估。其中制剂处方初筛主要确定了蛋白保护剂、表面活性剂及其浓度。制剂处方优化是在初筛的基础上确定 pH 值、缓冲盐及其浓度、助溶剂及其浓度、蛋白保护剂浓度。最后通过长期稳定性研究评估各项理化性质及活性的变化情况来确认最终处方。
1 材料与方法
1.1 主要仪器和试剂
LyoBeta 6PL 冻干机购自西班牙 Telstar 公司;Q2000 差示扫描量热仪购自美国 TA 公司;E2695 高效液相分析系统购自美国Waters 公司;TSKgel G3000SWXL 色谱柱(5 μm,7.8 mm ×300 mm)购自日本Tosoh 公司;PA800 plus 毛细管电泳分析系统购自美国 Beckman Coulter 公司;831 KF 库仑法卡氏水分测定仪购自瑞士 Metrohm 公司;SpectraMax m2e 多功能酶标仪为 Molecular Devices 公司产品。枸橼酸购自湖南华日制药有限公司;蔗糖购自默克公司;盐酸精氨酸购自上海协和氨基酸有限公司;聚山梨酯 20 购自美国 JT Baker 公司。
1.2 方法
1.2.1 F0002-ADC 的制备 表达 F0002 单抗的 CHO 细胞复苏后经摇瓶扩增、反应器种子扩增,进入 42 L 反应器生产。收获的上清液经亲和层析、深层过滤、阳离子交换层析及 UF/DF 超滤浓缩后制得单克隆抗体样品。单克隆抗体与连接子 SMCC 经第一步偶联后形成抗体-MCC 中间产物,抗体-MCC 再与细胞毒素 DM1 进行第二步偶联形成抗体-MCC-DM1 偶联剂,制得 F0002-ADC 样品。
1.2.2 差示扫描量热法(DSC)分析 样品稀释至 1 mg/ml,脱气 10 min;根据 tray setup 中对应位置,分别取脱气后供试液 400 μl 至相应 96 孔板孔内,再将 96 孔板置于样品槽。设置样品槽温度 15 ℃,起始温度 25 ℃,终止温度 100 ℃,升温速率 9 ℃/min。用 Proteus Analysis 软件对数据进行分析。
1.2.3 尺寸排阻色谱法(SEC)纯度分析 色谱柱:TSKgel G3000SWXL(5 μm,7.8 mm × 300 mm);流动相:0.2 mol/L K2HPO4,0.2 mol/L KCl,15% 异丙醇,pH 5.5;流速:0.6 ml/min;上样量:200 μg;柱温:25 ℃;样品池温度:5 ℃;检测波长:280 nm。用 Waters E2695 高效液相分析系统对实验结果进行数据处理,用面积归一化法计算纯度。
1.2.4 毛细管电泳(CE-SDS)纯度分析 用 SDS 样品缓冲液(0.1 mol/L Tris-HCl 缓冲液,含 1% SDS,pH 9.0)将供试品稀释至 1 mg/ml,分别吸取 95 μl 稀释的蛋白溶液,2 μl 10 kD 内标,5 μl β-巯基乙醇,全部加入 0.5 ml 离心管中,旋涡振荡混匀后,置于恒温混匀仪中 70 ℃孵育 10 min,冷却至室温,取 100 μl,采用毛细管电泳分析系统处理样品,带宽:10 nm,样品池温度:10 ℃,毛细管温度:25 ℃,检测波长:220 nm。原始图谱导入 Empower 软件,按面积归一化法计算。
1.2.5 含水量分析 参考《中华人民共和国药典》2015 年版通则 0832 第一法中库伦滴定法,以卡尔-费休氏反应为基础,应用永停滴定法(《中华人民共和国药典》2015 年版通则 0701)测定供试品,根据碘和二氧化硫在吡啶和甲醇溶液中与水定量反应的原理来测定水分。将供试品快速捣碎,精密称取 20 mg 样品加入水分测定仪中进行反应。每批测定 3 瓶供试品,每瓶测定 2 次。
1.2.6 相对结合活性分析 将 hCD30 抗原以 108 ng/ml 包被于 96 孔酶标板中,2 ~ 8 ℃静置过夜。3% BSA 室温封闭 2 h。将梯度稀释的 F0002-ADC 样品(20000 ~ 1.4 ng/ml)与生物素化 F0002 抗体等体积混匀后加入酶标板中,竞争结合hCD30 抗原,室温下,200 r/min 转速离心孵育1 h。以 HRP 标记的链霉亲和素为酶联,同上条件孵育 1 h。TMB 显色,1 mol/L H2SO4终止。置于酶标仪 m2e 中,450 nm(检测)/650 nm(参比)波长下进行读数。选择四参数拟合方式对数据进行分析。
1.2.7 生物学活性分析 用含 10% 胎牛血清的 RPMI1640 培养基将 Karpas299 细胞稀释至 5 × 104/ml,100 μl/孔种于 96 孔细胞培养板中。随后加入梯度稀释的 F0002-ADC 样品(50 ~ 0.3 ng/ml)。在 37 ℃,5% CO2的培养箱中孵育 77 h 后,加入 30 μl/孔的阿尔玛蓝染料,继续孵育 19 h。室温混匀半小时后,置于酶标仪 m2e 中,530 nm(激发)/590 nm(发射)波长进行读数。选择四参数拟合曲线对结果进行数据分析。
1.2.8 助溶效果比较实验 F0002-ADC 在开发初期遇到溶解性较差的问题,一般可以尝试通过调整 pH、改变盐种类/浓度、添加助溶剂等多种方式解决[7-8]。设计实验考察了以下两种方法:提高制剂的 pH 值和添加助溶剂盐酸精氨酸[9]。
控制抗体浓度 10 mg/ml,将 F0002-ADC 样品分别置换到五种不同 pH 值和盐酸精氨酸的缓冲液中。缓冲液条件如下:① 20 mmol/L 琥珀酸盐,3% 盐酸精氨酸,pH 5.0;② 20 mmol/L 琥珀酸盐,pH 5.0;③ 20 mmol/L 琥珀酸盐,pH 5.5;④20 mmol/L 枸橼酸盐,pH 6.0;⑤ 20 mmol/L 枸橼酸盐,pH 6.5。室温下静置 2 h 后观察样品溶解性。
1.2.9 不同处方样品的DSC 实验 在 pH 6.0 条件下,设计不同浓度的枸橼酸、蔗糖以及盐酸精氨酸的配方组合,通过 DSC考察不同处方中的 ADC的 Tm值。具体缓冲液条件如下:① 25 mmol/L枸橼酸盐,3% 蔗糖,3% 盐酸精氨酸,pH 6.0;② 50 mmol/L 枸橼酸盐,3% 蔗糖,3% 盐酸精氨酸,pH 6.0;③ 25 mmol/L 枸橼酸盐,3% 蔗糖,pH 6.0;④ 25 mmol/L 枸橼酸盐,6% 蔗糖,3% 盐酸精氨酸,pH 6.0;⑤ 50 mmol/L 枸橼酸盐,6% 蔗糖,3% 盐酸精氨酸,pH 6.0;25 mmol/L 枸橼酸盐,6% 蔗糖,pH 6.0。
1.2.10 缓冲盐浓度对冻干制剂含水量的影响实验 控制抗体浓度 5 mg/ml,将 F0002-ADC 样品分别置换到三种不同浓度(10、25 和 50 mmol/L)的枸橼酸盐缓冲液(6% 蔗糖,3% 盐酸精氨酸,pH 5.0)中。样品冻干后检测含水量。
1.2.11 40 ℃加速实验 控制抗体浓度 5 mg/ml,将 F0002-ADC 样品放置到 pH 分别为 5.0、5.5 和 6.0 的缓冲液中。缓冲条件如下:25 mmol/L 枸橼酸盐,6% 蔗糖,3% 盐酸精氨酸,0.02% 聚山梨酯 20。
分别在第 0、3、5、7、14、30 天取样检测 SEC-HPLC 及 CE-SDS 纯度,考察在不同 pH 下冻干样品的稳定性变化。
1.2.12 长期稳定性实验 依据制剂处方优化结果,进行 3 批样品生产。样品放置于 2 ~ 8 ℃条件下,进行 24 个月的长期稳定性考察,分别在第0、3、6、9、12、15、18、21、24 个月取样送检。主要考察项目有 SEC、CE-SDS(还原/非还原)、含水量、生物学活性以及相对结合活性。
2 结果
2.1 助溶效果比较实验结果
助溶结果如表 1 所示,提高制剂的 pH 值和添加助溶剂盐酸精氨酸均能有效提高 F0002-ADC 药物的溶解性。但是由于提高制剂 pH 值会对 ADC 药物的稳定性产生较大的风险。因此在配方中添加 3% 的盐酸精氨酸成为提高溶解性的首选。

表 1 助溶效果比较
2.2 不同处方样品的 DSC 实验结果
DSC 结果如表 2 所示,在选取的制剂处方及其参数范围内,制剂冻干前后Tm值及差值均无明显差异,即热稳定性无差异。
通过 DSC 样品含水量的分析,还发现如下趋势:3% 盐酸精氨酸的添加会导致含水量的增加;含水量与枸橼酸的浓度正相关,与蔗糖浓度相关性不大。
2.3 缓冲盐浓度对冻干制剂含水量的影响
含水量检测结果如表 3 所示,制剂含水量与缓冲盐浓度正相关,10 mmol/L 和 25 mmol/L 枸橼酸浓度的配方均能满足含水量< 3% 的药典要求。暂定枸橼酸浓度为 10 mmol/L,为满足渗透压要求,蔗糖质量浓度相应确定为 6%。
2.4 40 ℃加速实验结果
40 ℃加速实验结果如图 2 所示,ADC 冻干制品的纯度在 pH 5.0、5.5、6.0 下均较稳定;相对结合活性在 79% ~ 88% 之间,无明显差异。

表 2 不同制剂配方下 DSC 及含水量结果

表 3 不同枸橼酸浓度下冻干样品水含量的测定
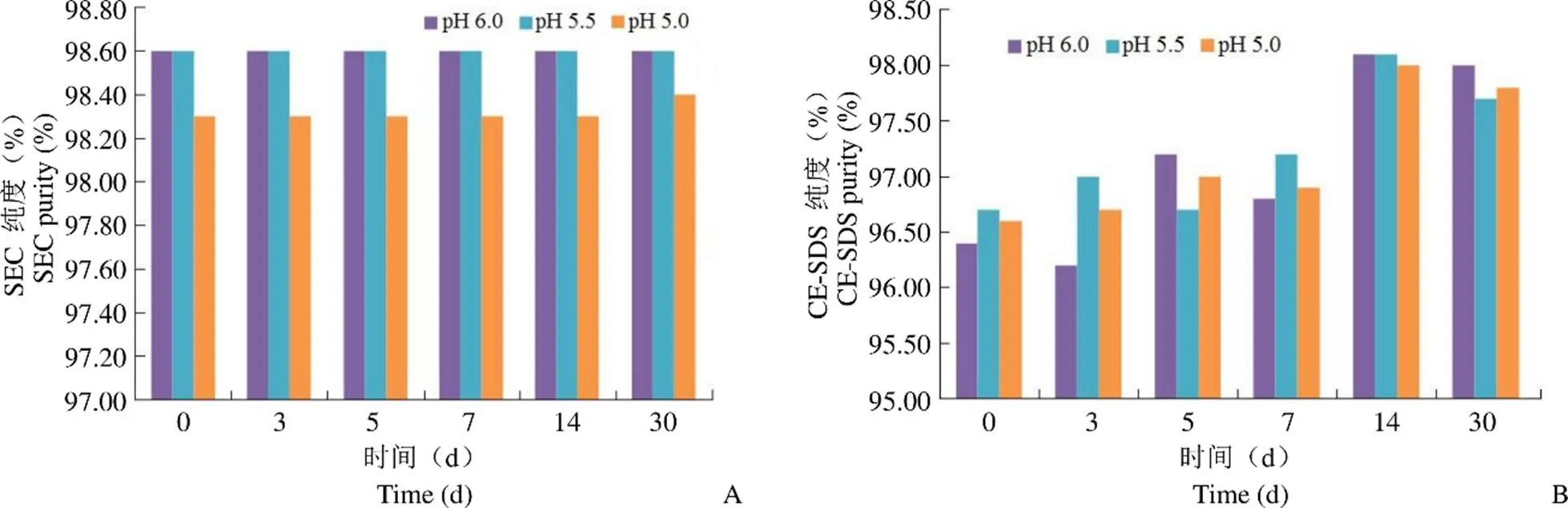
图 2 冻干制剂纯度比较(A:冻干样品 SEC 纯度;B:冻干样品 CE-SDS 纯度)
Figure 2 Purity compare of freeze-drying cakes (A: SEC-HPLC result of freeze-drying sample; B: CE-SDS result of freeze-drying sample)
2.5 长期稳定性实验结果
长期稳定性检测结果如图 3 所示,F0002-ADC 成品经过长期考察,各指标均无明显变化,符合 F0002-ADC 成品质量标准。
3 讨论
一个典型的制剂配方,除主药外,还应该包含:pH 缓冲盐、蛋白保护剂、表面活性剂以及助溶剂等组分[10]。通常在冻干制品中会加入蛋白保护剂以帮助蛋白在冻干过程中保持稳定。常用的蛋白保护剂有糖类、醇类、特定的氨基酸等。在单抗制剂中,蔗糖作为非还原性糖被广泛应用[11],结合部分已上市ADC 药物的处方,F0002-ADC 选择蔗糖作为蛋白保护剂。表面活性剂的加入能减少蛋白变性,阻止聚体及微粒的形成,抗体类药物和 ADC 常用的表面活性剂有聚山梨酯 20 和聚山梨酯 80[12]。本课题中,由于 F0002-ADC 与 Kadcyla 具有相同的连接子和细胞毒素,所以直接采用相同的表面活性剂(0.02% 聚山梨酯 20)。
制剂处方的 pH 值是制剂稳定性的重要影响因素,选择 pH 值的范围要考虑主药的理化性质,不恰当的 pH 值会造成抗体质量下降,主要表现在聚体含量增加、抗体的溶解性差异、氧化及脱酰胺化等方面[13]。由氨基酸组成的生物大分子的 pH 值稳定范围通常在5.0 ~ 7.0 之间,参考已批准上市的 20 多种抗体制剂配方,pH 值选择范围在 6.3 ± 0.6 之间[14],结合已上市 ADC 药物的制剂处方以及 F0002-ADC 的理化性质,将 pH 值的初步考察范围定为 5.0 ~ 6.0。枸橼酸盐由于具有较高的崩塌温度,且在冻融过程中 pH 的变化范围不大,被广泛应用于冻干产品的制剂处方中[7-8],根据初步选定的 pH 范围,确定枸橼酸作为制剂中 pH 缓冲盐。40 ℃加速实验结果表明,ADC 冻干制品的纯度在 pH 5.0、5.5、6.0 下均较稳定;相对结合活性在 79% ~ 88% 之间,无明显差异。另据报道,由于抗体与连接子之间酰胺键易产生断裂,ADC 药物在 pH 4.0 ~ 7.2 的范围内都能发现游离小分子药物[15]。且 pH 值越高,小分子药物脱落就越迅速,最终选择的制剂 pH 为 5.0。
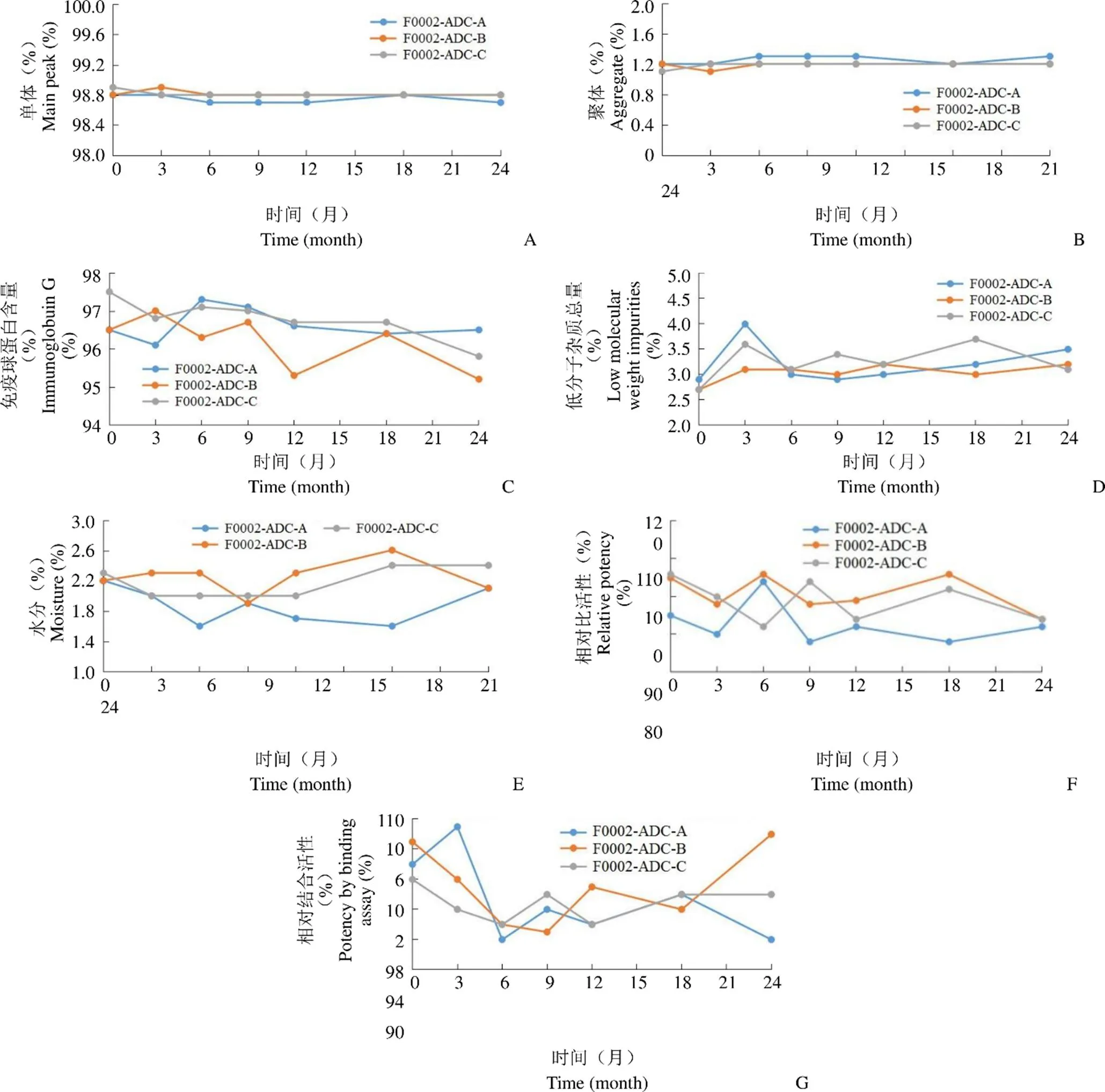
图 3 长期稳定性检测结果(A:SEC 单体变化趋势;B:SEC 聚体变化趋势;C:还原 CE-SDS 单体变化趋势;D:非还原 CE-SDS 低分子变化趋势;E:含水量变化趋势;F:生物学活性变化趋势;G:相对结合活性变化趋势)
Figure 3 Long-term stability experiment results (A: Main peak by SEC-HPLC; B: Aggregate by SEC-HPLC; C: Immunoglobuin G by CE-SDS (under reducing condition); D: Low molecular weight impurities by CE-SDS (under non-reducing condition); E: Moisture; F: Relative potency; G: Relative potency by binding assay)
F0002-ADC 与具有相同的连接子和小分子药物 DM1。考虑到小分子药物的稳定性,制剂配方的 pH 值确定为 5.0。
综上,经文献归纳及实验研究,确定F0002-ADC制剂处方为 10 mmol/L 枸橼酸盐,6% 蔗糖,3% 盐酸精氨酸,0.02% 聚山梨酯 20,pH 5.0。
依据制剂处方研究结果进行的 3 批次 24 个月长期稳定性考察,结果表明,F0002-ADC 成品各指标均无明显变化,符合 F0002-ADC 成品质量标准。表明本品在长期条件下稳定性良好,该制剂处方能够保证主药稳定有效。
F0002-ADC 制剂处方开发过程中,面临的最大问题是样品溶解度偏低以及含水量较高。最终通过添加盐酸精氨酸解决溶解度偏低的问题;通过降低盐浓度(10 mmol/L 枸橼酸盐),将最终制剂的含水量控制在 3% 以内。
在研究过程中,利用 DSC 对样品的缓冲盐、蛋白保护剂和助溶剂条件进行快速筛选,因为选定的条件充分参考已上市成熟的 ADC 制剂配方,Tm值并未显示出差异性;但是通过该实验发现了缓冲盐浓度、助溶剂对冻干样品含水量的影响。最终得到了 10 mmol/L 枸橼酸盐,6% 蔗糖,3% 盐酸精氨酸,0.02% 聚山梨酯 20,pH 5.0 的制剂处方。然后通过长期稳定性数据最终验证了选定制剂配方的可行性。
[1] Witkop B. Paul Ehrlich and his Magic bullets--revisited. Proc Am Philos Soc, 1999, 143(4):540-557.
[2] McCombs JR, Owen SC. Antibody drug conjugates: design and selection of linker, payload and conjugation chemistry. AAPS J, 2015, 17(2):339-351.
[3] Jain N, Smith S, Ghone S, et al. Current ADC linker chemistry. Pharm Res, 2015, 32(11):3526-3540.
[4] Shen Y, Yang T, Cao X, et al. Conjugation of DM1 to anti-CD30 antibody has potential antitumor activity in CD30-positive hematological malignancies with lower systemic toxicity. MAbs, 2019, 11(6):1149-1161.
[5] Wakankar AA, Feeney MB, Rivera J, et al. Physicochemical stability of the antibody-drug conjugate Trastuzumab-DM1: changes due to modification and conjugation processes. Bioconjug Chem, 2010, 21(9): 1588-1595.
[6] Buecheler JW, Winzer M, Tonillo J, et al. Impact of payload hydrophobicity on the stability of antibody-drug conjugates. Mol Pharm, 2018, 15(7):2656-2664.
[7] Reddy K RC, Lilie H, Rudolph R, et al. L-Arginine increases the solubility of unfolded species of hen egg white lysozyme. Protein Sci, 2005, 14(4):929-935.
[8] Trevino SR, Scholtz JM, Pace CN. Measuring and increasing protein solubility. J Pharm Sci, 2008, 97(10):4155-4166.
[9] Inoue N, Takai E, Arakawa T, et al. Specific decrease in solution viscosity of antibodies by arginine for therapeutic formulations. Mol Pharm, 2014, 11(6):1889-1896.
[10] Ji JA, Liu J, Wang YJ. Formulation development for antibody-drug conjugates//Wang J, Shen WC, Zaro JL. Antibody-drug conjugates -- the 21st century magic bullets for cancer. New York: Springer, Cham, 2015:79-95.
[11] Carpenter JF, Crowe JH. The mechanism of cryoprotection of proteins by solutes. Cryobiology, 1988, 25(3):244-255.
[12] Kerwin BA. Polysorbates 20 and 80 used in the formulation of protein biotherapeutics: structure and degradation pathways. J Pharm Sci, 2008, 97(8):2924-2935.
[13] Usami A, Ohtsu A, Takahama S, et al. The effect of pH, hydrogen peroxide and temperature on the stability of human monoclonal antibody. J Pharm Biomed Anal, 1996, 14(8-10):1133-1140.
[14] Warne NW. Development of high concentration protein biopharmaceuticals: the use of platform approaches in formulation development. Eur J Pharm Biopharm, 2011, 78(2):208-212.
[15] Chih HW, Gikanga B, Yang Y, et al. Identification of amino acid residues responsible for the release of free drug from an antibody-drug conjugate utilizing lysine-succinimidyl ester chemistry. J Pharm Sci, 2011, 100(7):2518-2525.
Formulation study of anti-CD30-MCC-DM1
ZHANG Heng-bin, XU Jun, CAO Xue-mei, ZHANG Yi-fan, WU Jin-song, YANG Tong, SHEN Yi-jun
We aim to optimize and determine the formulation of anti-CD30-MCC-DM1 (F0002-ADC) to improve its stability and reduce the moisture of its freeze-drying sample.
Experiments were designed to investigate the parameters such as buffer salts, pH, protein protectants, and solubilizers to find the optimal formulation of F0002-ADC.
After screening, the best formulation was found to contain 5 g/L F0002-ADC, 6% (w/v) sucrose, 3% (w/v) Arg-HCl, 0.02% (w/v) polysorbate-20 and 10 mmol/L citric acid, pH 5.0.
The formulation can improve the solubility of F0002-ADC, and reduce the moisture of its freeze-drying sample. Long-term stability experiments confirm the formulation meet the clinical requirements of F0002-ADC.
Antibody-drug conjugate ; CD30; Formulation; Arg-HCl
SHEN Yi-jun, Email: yjshen@fd-zj.com
Author Affiliations: School of Life Sciences, Fudan University, Shanghai 200000, China (ZHANG Heng-bin); Shanghai Fudan-Zhangjiang Bio-Pharmaceutical Co., Ltd., Shanghai 201210, China (ZHANG Heng-bin, XU Jun, CAO Xue-mei, ZHANG Yi-fan, WU Jin-song, YANG Tong, SHEN Yi-jun)
10.3969/j.issn.1673-713X.2019.06.004
200000 上海,复旦大学生命科学学院(张恒宾);201210 上海复旦张江生物医药股份有限公司(张恒宾、徐珺、曹雪梅、张一帆、吴劲松、杨彤、沈毅珺)
沈毅珺,Email:yjshen@fd-zj.com
2019-08-12
