UGT1A1基因多态性与伊立替康治疗小细胞肺癌疗效及预后的关系△
2019-12-21曹亮姬泽萱张长洪刘建华陈艳红支学军
曹亮,姬泽萱,张长洪,刘建华,陈艳红,支学军
河北北方学院附属第一医院呼吸内科,河北 张家口 075000
小细胞肺癌(small cell lung cancer,SCLC)是一类恶性程度极高的肿瘤,具有增长速度快、增长指数高、对初始化疗敏感等特点[1]。虽然目前治疗SCLC的化疗方案首选依托泊苷联合顺铂,但新型抗肿瘤药物伊立替康也逐渐被应用于临床,伊立替康是一种半合成水溶性喜树碱类衍生物,在人体内转变为喜树碱,降解细胞中的DNA拓扑异构酶Ⅰ从而使DNA单链断开,导致双螺旋结构解体以达到抗肿瘤目的。尿苷二磷酸葡糖醛酸转移酶1A(uridine diphosphoglucuronosyl transferase 1A,UGT1A)基因是人体内对内源性及外源性化合物进行生物转化、解毒并加强排泄的重要酶类。UGT1A基因通过不同的剪接方式形成了9种有功能的转录产物,其中UGT1A1酶对伊立替康的疗效影响最大,UGT1A1基因多态性也与伊立替康的不良反应相关,使用伊立替康化疗前行UGT1A1基因多态性检测,可以筛查高危人群、预测伊立替康的严重不良反应,从而指导临床用药。本研究探讨UGT1A1基因多态性与伊立替康治疗SCLC疗效及预后的关系,现报道如下。
1 资料与方法
1.1 一般资料
收集2016年1月至2017年1月河北北方学院附属第一医院收治的SCLC患者的病历资料。纳入标准:①经纤维支气管镜或经皮穿刺肺活检术确诊为SCLC;②未进行化疗或距离末次化疗时间长达4周以上;③血常规、心电图及肝肾功能正常;④生存时间大于3个月。排除标准:①合并其他部位肿瘤;②妊娠或哺乳期妇女。根据纳入、排除标准,共纳入60例SCLC患者,根据化疗方法不同分为观察组和对照组,每组30例。观察组中,男性16例,女性14例,年龄35~78岁,平均(60.8±7.9)岁;对照组中,男性17例,女性13例,年龄34~80岁,平均(60.1±8.2)岁,两组患者性别和年龄比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 方法
观察组患者采用伊立替康联合顺铂进行化疗,第1、8和15天给予伊立替康 60 mg/m2静脉注射,第1~3天给予顺铂60 mg/m2静脉注射,21天为1个周期,化疗2个周期。对照组患者采用依托泊苷联合奈达铂进行化疗,第1~3天给予依托泊苷80 mg/m2联合250~500 ml生理盐水进行静脉滴注1 h,奈达铂给药剂量、时间及方式同依托泊苷。21天为1个周期,化疗2个周期。
两组患者化疗前30 min用昂丹司琼8 mg联合地塞米松5 mg静脉推注预防呕吐,并使用阿托品注射液0.25 mg皮下注射预防腹泻。对白细胞总数低的患者给予粒细胞集落刺激因子治疗,应用1~2天后复查血常规,白细胞达标后可以给予上述治疗方案,治疗期间根据患者的病情复查血常规、生化检查、胸部计算机断层扫描(CT),化疗2个周期后进行疗效评价。
1.3 UGT1A1基因多态性检测
治疗前,采集观察组患者2 ml外周血,放在抗凝管中,置于-20℃冰箱待检。采用德国QIAGEN的Blood Mini Kit DNA提取试剂盒提取基因组的DNA。UGT1A1基因多态性检测:设计引物序列,采用聚合酶链反应(polymerase chain reaction,PCR)扩增UGT1A1的相关基因片段(UGT1A1*28和UGT1A1*6)。基因片段测序后,结果采用DNAStar软件进行显示,人工校读分析UGT1A1*28和UGT1A1*6位点基因型。
1.4 观察指标及评价标准
依据实体瘤疗效评价标准(response evaluation criteria in solid tumor,RECIST)1.1 版[2]进行疗效评价:完全缓解(complete response,CR),肿瘤病灶完全消失,持续4周及以上;部分缓解(partial response,PR),肿瘤病灶最大径之和减少≥30%,持续4周及以上;疾病稳定(stable disease,SD),肿瘤病灶最大径之和减少<30%或增加<20%,持续4周及以上;疾病进展(progressive disease,PD),肿瘤病灶最大径之和增加≥20%或出现新病灶。客观缓解率(objective response rate,ORR)=(CR+PR)例数/总例数×100%。不良反应参照世界卫生组织(WHO)抗癌药物常见毒副反应分级标准[3]进行评价。
1.5 随访
以患者复查和电话等方式进行随访,随访截止时间为2018年7月。随访内容包括:患者一般状况;是否在外院有治疗及治疗方案;术后是否发生肿瘤转移。无进展生存时间是指从患者治疗开始至疾病进展或任何原因死亡的时间。
1.6 统计学方法
采用SPSS 19.0统计学软件对数据进行分析。计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效的比较
观察组患者的ORR为50.00%(15/30),高于对照组患者的40.00%(12/30),差异无统计学意义(P>0.05)。(表1)
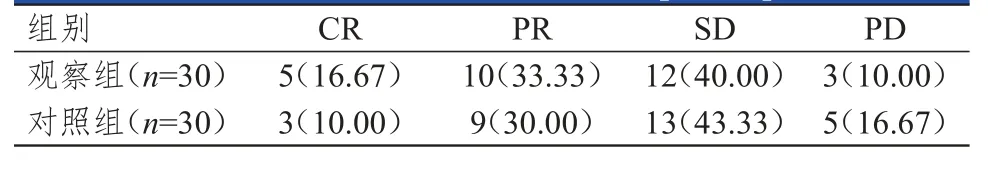
表1 两组患者的临床疗效[n(%)]
2.2 不良反应发生率的比较
观察组患者的不良反应发生率为43.33%(13/30),低于对照组患者的60.00%(18/30),差异无统计学意义(P>0.05)。(表2)
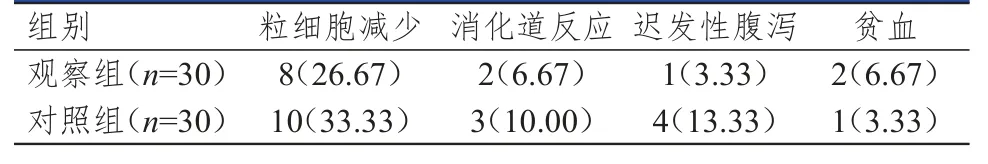
表2 两组患者的不良反应发生情况[n(%)]
2.3 生存情况的比较
随访结束后,观察组与对照组患者的无进展生存时间分别为(10.34±7.03)个月和(11.07±6.99)个月,两组患者的无进展生存时间比较,差异无统计学意义(P>0.05)。
2.4 UGT1A1基因多态性分布
观察组中,UGT1A1*28基因型为基因启动子区TA序列呈6次重复的野生型(TA6/6)、TA序列6次和7次重复的杂合突变型(TA6/7)、TA序列7次重复的纯合突变型(TA7/7)所占比例分别为76.67%(23/30)、13.33%(4/30)、10.00%(3/30)。UGT1A1*6基因型为G/G野生型、G/A杂合突变型、A/A纯合突变型所占比例分别为60.00%(18/30)、33.33%(10/30)、6.67%(2/30)。
1例患者出现迟发性腹泻,其UGT1A1*28基因型为纯合突变型TA7/7,UGT1A1*6基因型为纯合突变型A/A;2例患者出现贫血,其UGT1A1*28基因型分别为杂合突变型TA6/7和纯合突变型TA7/7,UGT1A1*6基因型分别为杂合突变型G/A和纯合突变型A/A;2例患者出现消化道反应,其UGT1A1*28基因型均为纯合突变型TA7/7,UGT1A1*6基因型均为纯合突变型A/A;8例患者粒细胞减少,其UGT1A1*28基因型分别为4例野生型TA6/6、2例杂合突变型TA6/7、2例纯合突变型TA7/7,UGT1A1*6基因型分别为2例野生型G/G、4例杂合突变型G/A、2例纯合突变型A/A。
3 讨论
在中国,肺癌是造成患者因疾病死亡的首要原因,男性发病率略高于女性,同时中国的发病率和病死率在全世界均处于较高水平。据研究报导,肺癌主要分为非小细胞肺癌和SCLC两种类型,其中SCLC恶性程度高,生长扩散速度快,通常在早期发生转移,其病理切片在显微镜下呈现为纺锤形或多边形的微小细胞[4]。目前临床上主要采用依托泊苷联合顺铂的化疗方案治疗SCLC患者,其近期效果明显,对病情的控制具有较为重要的意义。但依托泊苷联合顺铂治疗SCLC患者具有持续时间短的特征,大部分SCLC患者会在短期内病情有所进展,对患者生存造成威胁。本研究中观察组采用伊立替康联合顺铂的改进化疗方案,顺铂属于广谱类抗癌药物,伊立替康主要作用于细胞增殖周期的S期,与铂类药物在抗肿瘤方面作用相似,因此伊立替康联合顺铂治疗效果显著、不良反应少且不交叉耐药[5]。
伊立替康主要成分为可溶性的喜树碱类衍生物,是喜树碱类中新的细胞毒性药物,作用机制与喜树碱类似,特异性地与拓扑异构酶联合,解旋DNA的双螺旋结构[6]。但伊立替康也存在毒性,从而引起不良反应。临床上较为常见的不良反应主要有迟发性腹泻、中性粒细胞减少、消化道反应和骨髓抑制等,其中迟发性腹泻和中性粒细胞减少是较为常见毒性反应[3]。在临床上,迟发性腹泻定义为用药时段高出24 h后才引发的腹泻,主要体现为呈现水样便或软便;腹痛、腹部胀气及大便次数增加、胃部疼痛等不良症状。本研究结果显示,两组患者的ORR、不良反应发生率和无进展生存时间比较,差异均无统计学意义(P>0.05),表明伊立替康联合铂类药物治疗SCLC的疗效与传统化疗方案相当,不良反应也并未多于传统化疗方案,值得在临床使用,但由于研究时间短暂,其长期治疗效果还未有准确数据说明,存在一定的欠缺。
研究表明,伊立替康的药代动力学会因个体的差异而存在差异性[5]。UGT1A1被证实为伊立替康代谢的关键性酶类,而该基因的多态性分布和酶的相应功能具有关联性,可引起UGT1A1酶活性丧失或下降,从而使伊立替康的临床疗效降低,并出现一系列不良反应[5]。UGT1A1基因中,UGT1A1*28和UGT1A1*6基因的多态性均可影响伊立替康的不良反应[6]。本研究结果显示,观察组患者中UGT1A1*28基因型为野生型TA6/6、杂合突变型TA6/7、纯合突变型TA7/7所占比例分别为76.67%、13.33%、10.00%;UGT1A1*6基因型为G/G野生型、G/A杂合突变型、A/A纯合突变型所占比例分别为60.00%、33.33%、6.67%。UGT1A1基因突变在中国人群中较为常见,同时,伴随基因突变数目的增大,UGT1A酶的活性会逐步降低的表现,从而会影响伊立替康的临床效果,导致不良反应的发生[7-9]。本研究中,1例患者出现迟发性腹泻,其UGT1A1*28基因型为纯合突变型TA7/7,UGT1A1*6基因型为纯合突变型A/A;2例患者出现贫血,其UGT1A1*28基因型分别为杂合突变型TA6/7和纯合突变型TA7/7,UGT1A1*6基因型分别为杂合突变型G/A和纯合突变型A/A;2例患者出现消化道反应,其UGT1A1*28基因型均为纯合突变型TA7/7,UGT1A1*6基因型均为纯合突变型A/A;8例患者粒细胞减少,其UGT1A1*28基因型分别为4例野生型TA6/6、2例杂合突变型TA6/7、2例纯合突变型TA7/7,UGT1A1*6基因型分别为2例野生型G/G、4例杂合突变型G/A、2例纯合突变型A/A。但UGT1A1基因的多态性与使用伊立替康出现不良反应的相关性仍需要进一步研究。
综上所述,临床使用伊立替康治疗SCLC时,进行UGT1A1基因多态性的检测,针对个体差异性设计适宜的治疗方案,合理指导临床用药,将有助于减少不良反应的发生。
