槐耳菌质干预TWIST 介导乳腺癌紫杉醇化疗耐药蛋白及信号转导通路的机制研究△
2019-12-21董岩韩雨杉高平
董岩,韩雨杉,高平#
1大连医科大学附属第一医院肿瘤内科,辽宁 大连 116000
2大连医科大学临床学院,辽宁 大连 116000
近年来,乳腺癌的发病率不断升高,已位居女性恶性肿瘤第1位[1]。随着手术、放疗、化疗等治疗手段的应用,乳腺癌的病死率明显降低。相关研究表明,肿瘤耐药是导致肿瘤患者化疗失败的最主要原因[2],因而也是目前肿瘤患者化疗过程中急需解决的难题。紫杉醇对乳腺癌等恶性肿瘤具有显著疗效,单药紫杉醇治疗乳腺癌的有效率可达56%,但却极易产生耐药性[3]。近年来研究发现,转录因子TWIST及其相关信号调控网络与乳腺癌细胞的增殖及耐药具有密切联系[4-8]。研究表明,在乳腺癌患者化疗过程中给予中医治疗,可以减轻化疗药物导致的不良反应,改善患者的生活质量[9]。槐耳颗粒是国家一类新药,为槐耳菌质的提取物,其原料药是槐耳清膏,主要活性成分为多糖蛋白[10]。相关研究表明,槐耳清膏具有抑制乳腺癌细胞生长、诱导乳腺癌细胞凋亡、诱导机体产生多种细胞因子及提高机体免疫力的作用[11]。本研究对槐耳菌质干预TWIST介导乳腺癌紫杉醇化疗耐药信号调控通路的作用机制进行研究,旨在为临床上应用槐耳清膏治疗耐药性乳腺癌提供理论依据,现报道如下。
1 材料与方法
1.1 细胞
乳腺癌MCF-7细胞株购自中国典型培养物保藏中心。
1.2 主要试剂与仪器
槐耳清膏购自江苏启东盖天力药业有限公司;紫杉醇注射液购自山东齐鲁制药有限公司;DMEM培养基购自美国Genetech公司;胎牛血清购自美国Gibco公司;TWIST-shRNA质粒及阴性对照质粒委托上海吉凯基因化学技术有限公司设计及构建;转染试剂Lipofectamine 2000购自美国Invitrogen公司;G418购自美国Gibco公司;TWIST、GAPDH基因的上、下游引物均由宝生物工程(大连)有限公司合成;RNA提取试剂盒、反转录试剂盒、SYBR TAQ Real time试剂盒均购自日本Takara公司;全蛋白提取试剂盒购自南京凯基生物科技发展有限公司;兔抗人磷酸化蛋白激酶B(phosphorylation protein kinase B,p-AKT)、蛋白激酶B(protein kinase B,AKT)、TWIST、多药耐药相关蛋白(multidrug resistance-associated protein,MRP)、P-糖蛋白(P-glycoprotein,P-gp)单克隆抗体均购自美国Cell Signaling Technology公司;鼠抗人β-actin单克隆抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗小鼠/兔免疫球蛋白G(immunoglobulin G,IgG)均购自北京中杉金桥生物技术有限公司;化学发光法试剂盒购自南京凯基生物科技发展有限公司。
1.3 耐药细胞株的建立
参照低浓度加量持续诱导法[12]建立稳定的耐药细胞株:将MCF-7细胞置于含10%胎牛血清的RPMI1640培养基中培养,在培养液中持续加入紫杉醇,起始浓度设定为半抑制浓度(half maximal inhibitory concentration,IC50)的10%,待存活细胞开始增殖、细胞融合度达80%左右开始传代,传至3代后,逐渐增加紫杉醇的浓度,反复换液、传代,最终获得在含2.5 mg/L紫杉醇的培养基中稳定生长的耐药细胞株,传5代以上获得耐药细胞株,将其命名为“MCF-7/Taxol”。
1.4 台盼蓝拒染法计算细胞存活率[13]
取对数生长期的MCF-7/Taxol细胞,将其接种于含10%胎牛血清的RPM1640培养基中培养,胰蛋白酶消化后调整细胞浓度,使12孔细胞培养板中每孔接种的细胞量为1×105个。培养24 h后,将MCF-7/Taxol细胞分为4组:对照组,更换含有磷酸盐缓冲液的培养液培养;紫杉醇组,更换含有终浓度为3 mg/L紫杉醇的培养液培养;槐耳清膏组,更换含有终浓度为2.5 g/L槐耳清膏的培养液培养;合用组,更换含有终浓度为1.5 mg/L紫杉醇和1.0 g/L槐耳清膏的培养液培养,每组设置3个复孔。药物处理24、72、120 h时,采用0.4%台盼蓝进行活细胞计数,实验重复3次,取平均值,计算细胞存活率。细胞存活率=活细胞数(/活细胞数+死细胞数)×100%。
1.5 蛋白质印迹法(Western blot)检测细胞中TWIST、MRP、P-gp蛋白的表达水平
取药物处理120 h时的对照组、紫杉醇组、槐耳清膏组和合用组MCF-7/Taxol细胞,加入适量的细胞裂解液,于冰上孵育30 min,刮取细胞碎片;随后采用超声粉碎仪进行超声粉碎,低温条件下12 000 r/min,离心20 min,收集蛋白样品。采用BCA蛋白定量检测试剂盒检测蛋白样品的浓度。配制100 μg蛋白样品,经12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离,经转膜、封闭等步骤后,加入TWIST、MRP、P-gp抗体(1∶1000稀释)和内参β-actin抗体(1∶10 000稀释),4℃过夜,然后加入羊抗鼠IgG二抗(1∶1000稀释),室温孵育2 h,电化学发光法显色,凝胶成像分析仪采集图像。实验独立重复3次。
1.6 基因瞬时转染和分组
Lipofectamine 2000介导下进行基因瞬时转染,荧光显微镜下观察瞬时转染48 h后MCF-7/Taxol细胞的转染效果;在转染后的细胞培养基中加入300 μg/ml的G418,以筛选成功转染的MCF-7/Taxol细胞。经过3个月的筛选实验,构建了稳定转染细胞系,将转染带G418抗性TWIST-shRNA质粒的MCF-7/Taxol细胞作为实验组[即TWIST-shRNA(+)];将转染带G418抗性阴性对照质粒的MCF-7/Taxol细胞作为阴性对照组[即TWIST-shRNA(-)]。采用终浓度为3 mg/L的紫杉醇处理TWIST-shRNA(+)组 MCF-7/Taxol细胞,作为TWIST-shRNA(+)紫杉醇组,将未用紫杉醇处理的TWIST-shRNA(+)组细胞作为 TWIST-shRNA(+)对照组;采用终浓度为3 mg/L紫杉醇处理TWIST-shRNA(-)组MCF-7/Taxol细胞,作为TWIST-shRNA(-)紫杉醇组,将未采用紫杉醇处理的TWIST-shRNA(-)组细胞作为TWIST-shRNA(-)对照组。实验独立重复3次。
1.7 RT-PCR 检测各组细胞TWISTmRNA表达水平
待TWIST-shRNA(+)对照组和TWIST-shRNA(-)对照组MCF-7/Taxol细胞的融合度达80%时,采用Trizol试剂提取各组细胞的总RNA,利用反转录试剂盒反转录cDNA。采用SYBR Green法进行逆转录聚合酶链反应(reverse transcriptase polymerase chain reaction,RT-PCR),TWIST基因的上游引物:5′-GGAGTCCGCAGTCTTACGAG-3′;下游引物:5′-TCTGGAGGACCTGGTAGAGG-3′。反应条件:95 ℃预变性30 s;95 ℃变性10 s,58 ℃退火30 s,72℃延伸20 s,共35个循环。以GAPDH为内参,使用2-△△Ct法对TWISTmRNA的相对表达量进行分析。实验独立重复3次。
1.8 Western blot检测p-AKT蛋白的表达水平
取 TWIST-shRNA(+)对照组、TWIST-shRNA(+)紫杉醇组、TWIST-shRNA(-)对照组和TWIST-shRNA(-)紫杉醇组MCF-7/Taxol细胞,以AKT为内参,采用Western blot检测4组细胞中p-AKT的表达水平,具体检测方法参照“1.5”。p-AKT及AKT抗体的稀释比例均为1∶1000。实验独立重复3次。
1.9 统计学分析
采用SPSS 22.0软件进行数据分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,多组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 细胞存活率的比较
台盼蓝拒染法检测结果显示:药物处理24、72、120 h时,对照组、紫杉醇组、合用组和槐耳清膏组MCF-7/Taxol细胞的存活率比较,差异均有统计学 意 义(F=5385.418、8798.517、10766.899,P<0.01);其中,槐耳清膏组MCF-7/Taxol细胞的存活率低于对照组、紫杉醇组和合用组,合用组MCF-7/Taxol细胞的存活率低于对照组和紫杉醇组,差异均有统计学意义(P<0.05);但是对照组和紫杉醇组MCF-7/Taxol细胞的存活率比较,差异无统计学意义(P>0.05)。(表1)
表1 不同组别MCF-7/Taxol细胞存活率的比较(%,±s)
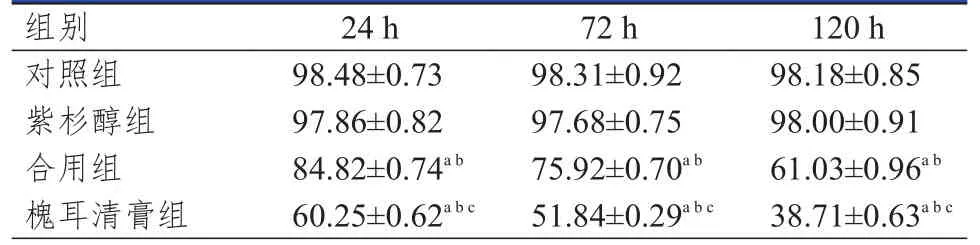
表1 不同组别MCF-7/Taxol细胞存活率的比较(%,±s)
注:a与对照组比较,P<0.05;b与紫杉醇组比较,P<0.05;c与合用组比较,P<0.05
组别对照组紫杉醇组合用组槐耳清膏组24 h 98.48±0.73 97.86±0.82 84.82±0.74a b 60.25±0.62a b c 72 h 98.31±0.92 97.68±0.75 75.92±0.70a b 51.84±0.29a b c 120 h 98.18±0.85 98.00±0.91 61.03±0.96a b 38.71±0.63a b c
2.2 TWIST、MRP、P-gp 蛋白表达水平的比较
Western Blot检测结果显示,药物处理120 h时,对照组、紫杉醇组、合用组和槐耳清膏组MCF-7/Taxol细胞中TWIST、MRP、P-gp蛋白的相对表达量比较,差异均有统计学意义(F=221.487、405.282、190.485,P<0.01)。其中,紫杉醇组MCF-7/Taxol细胞中TWIST、MRP、P-gp蛋白的相对表达量均高于对照组,槐耳清膏组MCF-7/Taxol细胞中TWIST、MRP、P-gp蛋白的相对表达量均低于紫杉醇组和合用组,槐耳清膏组MCF-7/Taxol细胞中TWIST、P-gp蛋白的相对表达量均低于对照组,差异均有统计学意义(P<0.05)。(表2)
表2 不同组别MCF-7/Taxol细胞中TWIST、MRP、P-gp蛋白相对表达量的比较(±s)
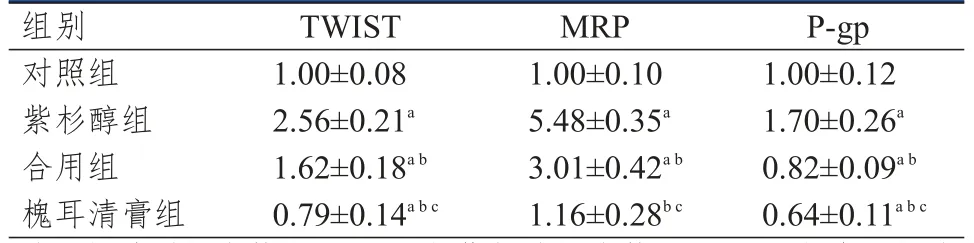
表2 不同组别MCF-7/Taxol细胞中TWIST、MRP、P-gp蛋白相对表达量的比较(±s)
注:a与对照组比较,P<0.05;b与紫杉醇组比较,P<0.05;c与合用组比较,P<0.05
组别对照组紫杉醇组合用组槐耳清膏组TWIST 1.00±0.08 2.56±0.21a 1.62±0.18a b 0.79±0.14a b c MRP 1.00±0.10 5.48±0.35a 3.01±0.42a b 1.16±0.28b c P-gp 1.00±0.12 1.70±0.26a 0.82±0.09a b 0.64±0.11a b c
2.3 TWISTmRNA和p-AKT 蛋白表达水平的比较
RT-PCR法检测结果显示,TWIST-shRNA(+)对照组MCF-7/Taxol细胞中TWISTmRNA的相对表达量为(1.00±0.25),明显低于TWIST-shRNA(-)对照组的(25.13±5.60),表明TWIST-shRNA转染成功。Western blot检测结果显示,TWIST-shRNA(-)紫杉醇组MCF-7/Taxol细胞中p-AKT的相对表达量为TWIST-shRNA(-)对照组的(3.29±0.15)倍,TWIST-shRNA(+)紫杉醇组MCF-7/Taxol细胞中p-AKT的相对表达量为TWIST-shRNA(+)对照组的(0.85±0.21)倍(图1)。
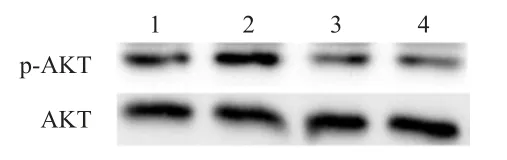
图1 Western blot 检测不同组别MCF-7/Taxol细胞中p-AKT 蛋白的表达水平
3 讨论
近年来,乳腺癌的发病率逐年增高,已成为肿瘤致女性死亡的重要原因,研究表明,全世界每年约有12%的新发乳腺癌病例,而其中10%的乳腺癌死亡病例发生在中国[1,14]。目前,化疗是临床治疗乳腺癌的主要手段之一,通过静脉应用化疗药物,可以促进肿瘤病灶萎缩,提高乳腺癌患者的生存率和生活质量。相关研究表明,分子生物学相关因子的改变,如耐药相关蛋白的高表达,是导致化疗失败的常见原因[15]。近年来研究发现,转录因子TWIST在肿瘤细胞的增殖和转移过程中发挥着重要作用[16]。TWIST是一种碱性螺旋-环-螺旋转录因子,其不仅可以激活或增强肺耐药蛋白、MRP、P-gp、拓扑异构酶Ⅱa等的表达,还可以激活AKT等介导的与肿瘤细胞增殖和转移相关的信号通路,从而形成以TWIST转录因子为中心的介导肿瘤细胞增殖及耐药的信号调控网络[17-18]。
磷酯酰肌醇-3激酶(phosphatidylinositol-3 kinase,PI3K)家族成员属于原癌基因,PI3K/AKT信号转导通路是PI3K家族介导的众多信号转导通路之一,对调节细胞凋亡尤为重要[19]。AKT是一种丝氨酸/苏氨酸蛋白激酶,是PI3K下游的作用靶点。PI3K/AKT信号转导通路是细胞内重要的抗凋亡信号途径,在细胞的存活、增殖、细胞骨架变化及凋亡等过程中发挥重要的生物学功能。PI3K/AKT信号转导通路不仅在恶性肿瘤中异常激活,并且与多种一线化疗药物的耐药性关系密切[20-23]。相关研究表明,在宫颈癌细胞中,TWIST可以通过调控AKT信号通路使宫颈癌细胞对紫杉醇产生耐药性[24]。本研究结果显示,槐耳清膏组MCF-7/Taxol细胞的存活率低于对照组、紫杉醇组和合用组(P<0.05),表明槐耳菌质对紫杉醇耐药乳腺癌细胞具有良好的杀伤作用。同时本研究还发现,药物处理120 h时,紫杉醇组MCF-7/Taxol细胞中TWIST、MRP、P-gp蛋白的相对表达量均高于对照组,槐耳清膏组MCF-7/Taxol细胞中TWIST、MRP、P-gp蛋白的相对表达量均低于紫杉醇组和合用组,槐耳清膏组MCF-7/Taxol细胞中TWIST、P-gp蛋白的相对表达量均低于对照组,差异均有统计学意义(P<0.05);提示乳腺癌细胞对紫杉醇的耐药性可能与TWIST、MRP、P-gp蛋白有关,而槐耳菌质能够通过抑制上述蛋白的表达逆转乳腺癌细胞的紫杉醇耐药。本研究进一步研究发现,TWIST-shRNA(-)紫杉醇组MCF-7/Taxol细胞中p-AKT的相对表达量为TWIST-shRNA(-)对照组的(3.29±0.15)倍,而TWIST-shRNA(+)紫杉醇组MCF-7/Taxol细胞中p-AKT的相对表达量为TWIST-shRNA(+)对照组的(0.85±0.21)倍,表明TWIST基因沉默后,紫杉醇对乳腺癌细胞中p-AKT蛋白表达水平的影响变小,TWIST可能通过调控AKT信号通路使乳腺癌细胞对紫杉醇产生耐药性。
综上所述,槐耳菌质能够有效地抑制紫杉醇耐药乳腺癌细胞的增殖,并通过下调TWIST、MRP、P-gp蛋白的表达逆转乳腺癌细胞的紫杉醇耐药性;而乳腺癌细胞紫杉醇耐药性的产生与TWIST介导的AKT信号通路密切相关。该发现为抗肿瘤药物的研发提供了新思路,为降低肿瘤耐药率、提高肿瘤治疗有效率提供了理论基础。
